Федеральное агентство по образованию Российской Федерации. Электрохимические элементы Химические источники тока
Свинцово–кислотный аккумулятор – на данный момент, этот тип аккумуляторов считается наиболее распространённым, нашел широкую область применения как автомобильный аккумулятор.
Принцип действия аккумулятора
Принцип действия, как говорилось ранее в статье про аккумуляторы , основан на окислительно-восстановительной электрохимической реакции. В данном случае на реакции свинца с диоксидом свинца, находящихся в сернокислотной среде. Во время использования аккумулятора, происходит разряд – на аноде будет происходить восстановление диоксида свинца, а на катоде – окисление свинца.
Во время зарядки аккумулятора, будут проходить ровно обратные реакции, с выделением кислорода на положительном электроде, и выделением водорода на отрицательном. Следует учесть, что на критических значениях, когда происходит зарядка и аккумулятор почти заряжен, может начать преобладать реакция электролиза воды, что приведет к её постепенному исчерпанию.
В итоге, можно сказать, что при заряде серная кислота будет выделяться в электролит, что влечет за собой повышение плотности электролита, а при разряде серная кислота будет расходоваться, и плотность будет падать.
Устройство аккумулятора
Свинцово-кислотный аккумулятор состоит из электродов, разделительных сепараторов (ячеек, изоляторов), которые находятся в электролите. Сами электроды на вид – это свинцовые решетки, только с разным активным веществом, положительный электрод имеет активное вещество – диоксид свинца (PbO 2), отрицательный электрод – свинец.

Рисунок 1 – Общий вид свинцово-кислотного аккумулятора

Рисунок 2 – Ячейка аккумулятора с положительными и отрицательными электродами, разделёнными сепараторами
На рисунке 1 вы можете видеть в моноблоке отдельные ячейки подробно рассмотренные на рисунке 2 – в которых находятся положительные и отрицательные электроды, разделённые сепараторами.
Эксплуатация свинцово-кислотного аккумулятора при низких температурах
В отличии от других типов аккумуляторов, свинцово-кислотные более-менее устойчивы к холоду, как мы видим в последствии – широкое применение на автотранспорте. Свинцово-кислотный аккумулятор теряет 1% своей ёмкости на каждый градус отличный от +20°C, что говорит о том, что при 0°C ёмкость свинцово-кислотного аккумулятора будет составлять лишь 80% его ёмкости. Это обусловлено увеличением вязкости электролита при низких температурах, из-за чего он не может поступать в нормальной степени к электродам, а тот электролит что поступает, быстро истощается.
Зарядка аккумулятора
Для большинства аккумуляторов ток зарядки должен быть написан на корпусе, примерно, он может находиться в пределах от 0.1 до 0.3 емкости аккумулятора. Вообще, общепринятым считается зарядка аккумулятора 10% током от его ёмкости, на протяжении 10 часов. Максимальное напряжение при зарядке не должно превышать 2.3 ± 0.023 В на каждый из элементов аккумулятора. То есть, можно сказать что для свинцового аккумулятора с напряжением в 12 В, напряжение во время зарядки не должно превышать 13.8 ± 0.15 В.
Хранение свинцово кислотных аккумуляторов
Свинцово-кислотные аккумуляторы хранятся только в заряженном состоянии. Хранение их в разряженном состоянии приводит к потере работоспособности.
Окислительно-восстановите льные реакции – реакции, которые идут с изменением степеней окисления элементов.
Окисление – процесс отдачи электронов.
Восстановление – процесс присоединения электронов.
Окислитель – атом, молекула или ион, который принимает электроны.
Восстановитель – атом, молекула или ион, который отдает электроны.
Окислители, принимая электроны, переходят в восстановленную форму:
F2 [ок. ] + 2ē → 2F¯ [восст.].
Восстановители, отдавая электроны, переходят в окисленную форму:
Na0 [восст. ] – 1ē → Na+ [ок.].
Равновесие между окисленной и восстановленной формами характеризуется с помощью уравнения Нернста для окислительно-восстановительного потенциала:
где Е0 – стандартное значение окислительно-восстановительного потенциала; n – число переданных электронов; [восст. ] и [ок. ] – молярные концентрации соединения в восстановленной и окисленной формах соответственно.
Величины стандартных электродных потенциалов Е0 приведены в таблицах и характеризуют окислительные и восстановительные свойства соединений: чем поло-жительнее величина Е0, тем сильнее окислительные свойства, и чем отрицательнее значение Е0, тем сильнее восстановительные свойства.
Например, для F2 + 2ē ↔ 2F¯Е0 = 2,87 вольт, а для Na+ + 1ē ↔ Na0Е0 = -2,71 вольт (процесс всегда записывается для реакций восстановления).
Окислительно-восстановительная реакция представляет собой совокупность двух полуреакций, окисления и восстановления, и характеризуется электродвижущей силой (э.д.с.) ΔЕ0: ΔЕ0 = ΔЕ0ок – ΔЕ0восст , где Е0ок и ΔЕ0восст – стандартные потенциалы окислителя и восстановителя для данной реакции.
Э.д.с. реакции ΔЕ0 связана с изменением свободной энергии Гиббса ΔG и константой равновесия реакции К:
ΔG = – nF ΔЕ0 или ΔЕ = (RT/nF) lnK.
Э.д.с. реакции при нестандартных концентрациях ΔЕ равна: ΔЕ = ΔЕ0 – (RT/nF) × IgK или ΔЕ = ΔЕ0 – (0,059/n )lgK .
В случае равновесия ΔG = 0 и ΔЕ = 0, откуда ΔЕ = (0,059/n)lgK и К = 10nΔE/0,059.
Для самопроизвольного протекания реакции должны выполняться соотношения: ΔG < 0 или К >> 1, которым соответствует условие ΔЕ0 > 0. Поэтому для определения возможности протекания данной окислительно-восстановительной реакции необходимо вычислить значение ΔЕ0. Если ΔЕ0 > 0, реакция идет. Если ΔЕ0 < 0, реакция не идет.
Химические источники тока
Гальванические элементы – устройства, преобразующие энергию химической реакции в электрическую энергию.
Гальванический элемент Даниэля состоит из цинкового и медного электродов, погруженных в растворы ZnSO4 и CuSO4 соответственно. Растворы электролитов сообщаются через пористую перегородку. При этом на цинковом электроде идет окисление: Zn → Zn2+ + 2ē, а на медном электроде – восстановление: Cu2+ + 2ē → Cu. В целом идет реакция: Zn + CuSO4 = ZnSO4 + Cu.
Анод – электрод, на котором идет окисление. Катод – электрод, на котором идет восстановление. В гальванических элементах анод заряжен отрицательно, а катод – положительно. На схемах элементов металл и раствор отделены вертикальной чертой, а два раствора – двойной вертикальной чертой.
Так, для реакции Zn + CuSO4 = ZnSO4 + Cu схемой гальванического элемента является запись: (-)Zn | ZnSO4 || CuSO4 | Cu(+).
Электродвижущая сила (э.д.с.) реакции равна ΔЕ0 = Е0ок – Е0восст = Е0 (Cu2+/Cu) – Е0 (Zn2+/Zn) = 0,34 – (-0,76) = 1,10 В. Из-за потерь напряжение, создаваемое элементом, будет несколько меньше, чем ΔЕ0. Если концентрации растворов отличаются от стандартных, равных 1 моль/л, то Е0ок и Е0восст вычисляются по уравнению Нернста, а затем вычисляется э.д.с. соответствующего гальванического элемента.
Сухой элемент состоит их цинкового корпуса, пасты NH4Cl с крахмалом или мукой, смеси MnO2 с графитом и графитового электрода. В ходе его работы идет реакция: Zn + 2NH4Cl + 2MnO2 = Cl + 2MnOOH.
Схема элемента: (-)Zn | NH4Cl | MnO2, C(+). Э.д.с. элемента – 1,5 В.
Электронные представления об окислении и восстановлении. Химические реакции могут протекать без изменения или с изменением степени окисления элементов, например:

Если в первом примере (реакция нейтрализации) ни один из элементов не меняет степени окисления, то во втором - изменяется от +2 до 0 степень окисления цинка и от 0 до +2 степень окисления углерода.
Реакции, протекающие с изменением степени окисления элементов, называются окислительно-восстановительными.
Изменение степеней окисления произошло очевидно вследствие перехода двух электронов от углерода к цинку, что может быть выражено электронными уравнениями полуреакций окисления и восстановления, которые при сложении дают уравнение окислительно-восстановительной реакции:
восстановитель  окисление;
окисление;
окислитель  восстановление;
восстановление;

Элемент, отдающий электроны, называется восстановителем, в ходе реакции он окисляется, его степень окисления увеличивается.
Элемент, принимающий электроны, называется окислителем, в ходе реакции он восстанавливается, его степень окисления уменьшается.
Понятия окислитель и восстановитель распространяются также на простые и сложные вещества, содержащие соответствующие элементы. В приведенном примере восстановителем является простое вещество: углерод С, окислителем - сложное вещество: оксид цинка ZnO .
В общем случае окислительно-восстановительная реакция может быть обратимой, в результате восстановитель превращается в окислитель, а окислитель - в восстановитель:
восстановитель - ne ↔ окислитель
окислитель + ne ↔ восстановитель
Таким образом, окислительно-восстановительная реакция представляет собой неразрывное единство двух полуреакций - окисления и восстановления, причем количества электронов, отданных восстановителем и принятых окислителем равны.
Окислительно-восстановительные свойства простых и сложных веществ. Простые вещества - металлы, обладая небольшой электроотрицательностью, сравнительно легко теряют электроны, проявляя исключительно восстановительные свойства. Наиболее ярко они выражены у щелочных металлов. Для простых веществ - неметаллов с большой электроотрицательностью характерны окислительные свойства. Абсолютным окислителем является фтор, ярко выражены окислительные свойства также у кислорода (кроме реакции с фтором, где кислород играет роль восстановителя). Однако неметаллы со сравнительно небольшой электроотрицателъностью, например углерод, водород наряду с окислительными могут проявлять и восстановительные свойства, отдавая электроны более сильным окислителям.
Сложные вещества могут быть окислителями или восстановителями в зависимости от величины степени окисления элементов, входящих в их состав.
Если степень окисления элемента в данном соединении велика, он имеет возможность понизить ее, принимая электроны. Вещество в таком случае будет окислителем. Важнейшими окислителями являются: азотная кислота Н NO з и ее соли - нитраты, тетраoксид азота N 2 O 4 , соли хлорной кислоты НС1О 4 - перхлораты, перманганат калия КМпО 4 и др.
Если в состав соединения входит элемент с небольшой степенью окисления, он может ее повысить, отдавая электроны. Сложное вещество, содержащее такой элемент, будет проявлять восстановительные свойства. Важнейшими восстановителями являются аммиак N Н 3 , гидразин N 2 H 4 и его органические производные, углеводороды, спирты, амины и другие вещества.
Очевидно, если в состав соединения входит элемент с промежуточной степенью окисления, он может понизить ее, принимая электроны, или повысить, отдавая электроны. Понятия окислитель и восстановитель в этом случае становятся относительными: вещество в зависимости от свойств партнера по реакции будет проявлять либо окислительные, либо восстановительные свойства. Примером может служить пероксид водорода Н 2 О 2 , степень окисления кислорода в котором равна -1. Ее величина может уменьшиться до -2 путем присоединения одного электрона или увеличиться до 0 путем его отдачи. Поэтому при взаимодействии с энергичными восстановителями пероксид водорода ведет себя как окислитель, а в реакции с энергичными окислителями - как восстановитель.
Составление уравнений окислительно-восстановительных реакций.
Окислительно-восстановительные реакции часто выражается сложными уравнениями. Для подбора коэффициентов в них применяют два метода: метод электронных уравнений и метод электронно-ионных уравнений.
Метод электронных уравнений базируется на понятии степени окисления. Он носит универсальный характер и применим для всех типов окислительно-восстановительных реакций. Метод включает следующие операции:
1. Записывают схему реакции с указанием степени окисления элементов, например:
![]()
2. Определяют элементы, изменившие степень окисления. В данной реакции степень окисления изменили углерод и азот, у водорода и кислорода величина степени окисления осталась неизменной.
3. Составляют электронные уравнения полуреакций окисления и восстановления с соблюдением равенства масс и зарядов:

Числа электронов, отданных восстановителем и принятых окислителем должны быть равны, поэтому следует первое уравнение умножить на три, а второе - на четыре. Указанные множители являются коэффициентами для восстановителя С, окислителя HNO 3 и продуктов их превращений СО и NO :
3C + 4HNO 3 ® 3CO 2 + 4NO + Н 2 О ,
4. Коэффициенты для остальных веществ, состоящих из элементов с неизменной степенью окисления, находят из баланса соответствующих атомов в левой и правой частях уравнения. В рассмотренной реакции таким веществом является вода, перед формулой которой нужно поставить коэффициент два. Окончательное уравнение запишется в виде:
3C + 4HNO 3 ® 3CO 2 + 4NO + 2Н 2 О
Метод электронно-ионных уравнений применяют при составлении уравнений реакций, протекающих в растворах электролитов. В этом случае степень окисления не определяется, а процессы окисления и восстановления записываются для реальных ионов и молекул, находящихся в растворе.
С целью сохранения баланса масс используют частицы среды, в которой протекает реакция. В любых водных растворах это молекулы воды, в кислых - дополнительно ионы Н + и в щелочных - ионы ОН - .
Последовательность действий следующая:
1. Составляют ионную схему реакции, записывая сильные электролиты в виде ионов, газообразные, нерастворимые вещества и слабые электролиты в виде молекул:
С + Н + + NO 3 - ® CO 2 + NO + Н 2 О
2. 3аписывают электронно-ионные уравнения полуреакций окисления и восстановления.
В данной реакции в роли восстановителя выступает углерод С, который окисляясь превращается в диоксид углерода СО 2 . Для сохранения баланса масс в левую часть уравнения добавляют две молекулы Н 2 О, а в правую - четыре иона Н - . Баланс зарядов сохраняют, отнимая от левой части уравнения четыре электрона:
С + 2Н 2 О - 4е ® С O 2 + 4Н +
Окислителем служит ион NO 3 - , превращающийся в NO , Баланс масс обеспечивается в этом случае добавлением двух молекул H 2 O в правую часть уравнения и четырех ионов Н + в его левую часть. Поскольку суммарный заряд частиц в левой части уравнения равен плюс три, а в правой - нулю, к левой части необходимо добавить три электрона:
NO 3 - + 4Н + + 3е ® NO + H 2 O
3. Суммируют уравнения полуреакций, предварительно уравняв числа отданных и принятых электронов:

После сокращения подобных членов, получают ионное уравнение:
ЗС + 4H + + 4 NO 3 - ® ЗСО 2 + 4 NO + 2Н 2 О
4. Объединяют ионы в молекулы и получают итоговое молекулярное уравнение реакции:
3С + 4Н NO 3 ® 3СО 2 + 4 NO + 2Н 2 О
Сравнивая рассмотренные метода составления уравнений окислительно-восстановительных реакций, следует отметить, что оба они приводят к одинаковому конечному результату. Однако метод электронно-ионных уравнений более информативен, он оперирует не гипотетическими, а реальными ионами и молекулами, существующими в растворах электролитов. Особенно полезен он при описании электрохимических процессов.
5.2. Электрохимические системы.
Электродные потенциалы. Электрохимическими называются процессы взаимного превращения химической и электрической энергии. Эти превращения осуществляются в результате окислительно-восстановительных реакций, протекающих на границе раздела фаз между электронным и ионным проводниками. Электронный проводник, находящийся в контакте с ионным, называется электродом.
Рассмотрим электрод, состоящий из пластинки активного металла - цинка, погруженной в водный раствор сульфата цинка, диссоциирующего на ионы:
ZnSO 4 ↔ Zn 2+ SO 4 2-
Положительно заряженные катионы цинка, расположенные на поверхности пластинки, в результате взаимодействия с полярными молекулами воды отрываются от пластинки и переходят в раствор, электроны остаются в металле. Происходит процесс окисления:
Zn 0 – 2е ® Zn 2+
Одновременно протекает и обратный процесс: катионы цинка из раствора притягиваются поверхностью металла и входят в состав его кристаллической решетки. Идет процесс восстановления:
Zn 2+ +2е ® Zn 0
По мере увеличения концентрации катионов цинка в растворе скорость выхода ионов из металла уменьшается, а скорость их перехода в металл возрастает. Когда скорости этих процессов сравняются, на границе металл-электролит установится окислительно-восстановительное равновесие между металлом и его ионами, которое условились записывать как обратимый процесс восстановления:
![]()
При записи электрохимической схемы электрода его окисленную форму отделяют от восстановленной чертой: Zn +2 / Zn .
Поскольку цинк является активным металлом, равновесие процесса смещено влево, то есть в раствор переходит больше ионов, чем возвращается обратно. В результате цинковая пластинка приобретает отрицательный потенциал (рис. 5.1 а).
Те же процессы происходят и при погружении пластинки из малоактивного металла- меди в раствор сульфата меди, диссоциирующего на ионы:
Однако в этом случае металл посылает в раствор незначительное число катионов, преобладает процесс осаждения катионов на металле и равновесие смещено вправо:
![]()
Медный электрод С u 2+ /Сu приобретает положительный потенциал (рис. 5.1.).
Рисунок 5.1. Схема возникновения электродного потенциала
а) активного металла; б) малоактивного металла
Абсолютную величину электродного потенциала измерить невозможно, поэтому измеряют ее относительно потенциала электрода сравнения, в качестве которого используют стандартный водородный электрод (рис.5.2). Он представляет собой платиновую пластинку в водном растворе серной кислоты с концентрацией ионов водорода Сн + = 1 моль/л, омываемую водородом с давлением 101,3 кПа при температуре 293К.
Платина обладает способностью адсорбировать водород и на границе
Рисунок 5.2. Схема водородного электрода
раздела фаз устанавливается равновесиемежду молекулами и ионами водорода:
2Н + + 2е ↔ Н 2
Соответствующий электродный потенциал условно принимают за нуль, Е 0 2Н + / Н2 = 0.
Стандартным электродным потенциалом металла называют разность потенциалов между данным металлом, опущенным в раствор своей соли с концентрацией ионов металла С М n + =1 моль/л при температуре 293К и стандартным водородным электродом.
Стандартный электродный потенциал является мерой окислительно-восстановительной активности системы.
С увеличением величины стандартного электродного потенциала восстановительная активность системы уменьшается, а окислительная - растет.
Так, с ростом величины стандартного электродного потенциала металлов уменьшается восстановительная активность их атомов и растет окислительная активность ионов.
Сравнение электродных потенциалов полуреакций позволяет сделать вывод о направлении окислительно-восстановительного процесса.
Рассмотрим гетерогенную окислительно-восстановительную реакцию, протекающую при погружении цинковой пластинки в раствор сульфата меди, диссоциирующего на ионы (рис. 5.3а):
CuSO 4 ↔ Cu 2+ + SO 4 2-
Электродные потенциалы цинка и меди имеют следующие значения:
Zn 2+ + 2е ↔ Zn 0 ; E 0 = - 0,76 B
Cu 2+ + 2 e ↔ Cu 0 ; E 0 = +0,34 B
Как видно, стандартный электродный потенциал для второй системы выше, чем для первой. Следовательно, при контакте вторая система выступит в качестве окислителя, первая - в качестве восстановителя. Другими словами, вторая реакция пойдет слева направо, а первая - в противоположном направлении, то естъ цинк будет отдавать электроны ионам меди, вытесняя, таким образом, медь из раствора ее соли (рис. 5.3 а):

Электродный потенциал возникает не только в результате обмена ионами между металлом и раствором его соли. Любая окислительно-восстановительная полуреакция характеризуется определенным значением электродного потенциала, например:
СО 2 + 4Н + + 4е ↔ С + 2Н 2 О; Е° = +0,21 B ,
NO 3 - + 4Н + + 3 e ↔ NO + 2 H 2 ; E ° = +0,96 B
В этом случае окислительные свойства сильнее выражены у иона NO 3 - , поэтому этот ион будет окислять углерод, восстанавливаясь до оксида азота NO (см.5.1).
Величина электродного потенциала не является постоянной, она зависит от ряда факторов, в частности от соотношения окисленной и восстановленной форм вещества. Эта зависимость выражается уравнением Нернста, которое при стандартной температуре 293К записывается в виде:
(5.1),
где: Е - электродный потенциал при данных концентрациях окисленной С ок и восстановленной С восст форм вещества, моль/л,
Е° - стандартный электродный потенциал,
n - число переданных электронов.
Для металлических электродов в растворах солей восстановленной формой являются атомы металла, концентрация которых - величина постоянная С M = const . В этом случае уравнение Нернста приобретает вид:
(5.2)
где:
С м + n - концентрация ионов металла, моль/л;
n - заряд иона.
Химические источники электрического тока. В рассмотренных системах переход электронов от восстановителя к окислителю осуществляется хаотически, в результате химическая энергия превращается в тепловую.
Можно, однако, пространственно разделив процессы окисления и восстановления, получить направленное движение электронов - электрический ток. Устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую, называется химическим источником тока или гальваническим элементом.
Рисунок 5.3. Гетерогенный окислительно-восстановительный процесс:
а – пространственно неразделенный; в – пространственно разделенный
На рис.5.3 изображена схема гальванического элемента Даниэля - Якоби, состоящего из цинкового и медного электродов, помещенных в водные растворы сульфатов этих металлов. Растворы соединены электролитическим мостиком - трубкой, заполненной раствором электролита, например, хлорида калия. При замыкании электродов через нагрузку на цинковом электроде идет процесс окисления с выходом ионов Zn 2+ раствор; освободившиеся электроны переходят по внешней цепи на медный электрод, где восстанавливают ионы С u +2 поступающие из раствора сульфата меди.
Электрод, на котором идет процесс окисления, называется анодом, электрод, на котором протекает процесс восстановления, - катодом. В медно-цинковом элементе цинковый электрод является анодом, медный - катодом. В процессе работы элемента цинковый анод постепенно растворяется, на медном катоде осаждается медь. Таким образом, цинковый электрод является активным, его материал принимает непосредственное участие в окислительно-восстановительном процессе. Медный электрод играет пассивную роль проводника электронов, его материал в окислительно-восстановительном процессе не участвует.
Окислительно-восстановительный процесс, протекающий на электродах, нарушает ионное равновесие в растворах - у медного электрода образуется избыток ионов SO 4 2- , у цинкового - их недостаток. В результате во внутренней цепи возникает движение ионов SO 4 2- из раствора сульфата меди в раствор сульфата цинка.
Электрохимическая схема этого элемента может быть записана в виде:
где одна вертикальная черта означает границу между электронным и ионным проводниками, а две - границу между двумя ионными проводниками.
Электродвижущая сила (ЭДС) элемента при стандартных концентрациях ионов (1 моль/л) может быть вычислена как разность стандартных потенциалов катода и анода:
ЭДС = D Е° = Е 0 кат - Е 0 ан = Е 0 С u 2 +/ С u - Е 0 Zn 2 +/ Zn = +0,34 - (- 0,76) = 1,1 B .
Если концентрации ионов отличаются от стандартных, необходимо по формуле 5.2 вычислить потенциалы электродов при заданных концентрациях и затем взять их разность.
В принципе любая окислительно-восстановительная реакция может быть использована для получения электрической энергии при условии пространственного разделения процессов окисления и восстановления. Активными материалами электродов могут быть не только металлы, но и неметаллы, а также оксиды, гидроксиды и другие сложные вещества. Так, в случае реакции окисления углерода азотной кислотой (см. 5.1) электрический ток может быть получен, если в раствор азотной кислоты погрузить угольный и платиновый электроды и замкнуть их металлическим проводником. При этом активный угольный анод окисляется с образованием диоксида углерода С O 2 ,на пассивном платиновом катоде идет восстановление нитрат-ионов NO 3 - до оксида азота NO . Схема элемента может быть записана в виде:
ЭДС = D Е ° = Е ° кат - Е ° ан = Е °NO 3 - / NO - E°CO 2 / C = 0,96 - 0,21 = 0,75 В
Величина D Е° связана со стандартной энергией Гиббса реакции (D G °) соотношением:
D G °=- nF D E ° (5.3)
где n - число переданных в ходе реакции электронов, F - число Фарадея (96500Кл).
Уравнение 5.3 устанавливает связь между химической и электрической формами энергии. Оно позволяет по известному значению G рассчитать Е гальванического элемента и наоборот, зная Е рассчитать G .
Топливные элементы. Топливный элемент является разновидностью гальванического элемента, в котором электрическая энергия получается в результате окислительно-восстановительного процесса между компонентами топлива - горючим (восстановителем) и окислителем, непрерывно подводимыми к электродам извне. Горючим может служить водород, моноксид углерода, метан, спирты, а окислителем - кислород, воздух, пероксид водорода и другие вещества. Таким образом, в топливных элементах, в отличие от тепловых машин, химическая энергия топлива непосредственно превращается в электрическую, поэтому их КПД в 1,5 - 2,0 выше, чем у тепловых машин. Кроме того, они существенно меньше загрязняют окружающую среду.
Рисунок 5.4. Водородно-кислородный топливный элемент
В настоящее время практическое применение нашел водородно-кислородный топливный элемент (рис.5.4).
Он содержит два пористых металлических или угольных электрода с добавками катализатора. В качестве электролита используется водный 40 - 85% раствор гидроксида калия. Электрохимическая схема элемента:
![]()
Подаваемые к электродам газообразные водород и кислород диффундируют через электроды в направлении электролита, адсорбируются на поверхности пор и активируются катализатором. Это облегчает и ускоряет процессы окисления водорода на аноде и восстановление кислорода на катоде:
H 2 + 2 OH - - 2е ® 2 H 2 O
1/2О 2 + Н 2 О + 2е ® 2ОН -
Суммарное уравнение реакции:
Н 2 +1/2О 2 ® Н 2 О
Продукт реакции - парообразная вода отводится потоком водорода, который после отделения воды возвращается обратно в систему. Таким образом, осуществляется «холодное сжигание» водорода в кислороде с выделением энергии в электрической форме.
Аккумуляторы. Окислительно-восстановительные процессы, протекающие при работе гальванических элементов, могут иметь либо необратимый, либо обратимый характер. Соответственно химические источники тока могут быть однократного и многократного действия. Гальванические элементы многократного действия называются аккумуляторами. При работе аккумулятора в режиме источника тока самопроизвольно протекает окислительно-восстановительный процесс, приводящий к превращению химической энергии в электрическую (энергия Гиббса реакции отрицательна D G <0). Химический состав электродов при этом меняется, аккумулятор разряжается. Обратная реакция самопроизвольно не идет (D G >0). Однако разряженный аккумулятор можно зарядить от внешнего источника тока, напряжение которого превышает ЭДС элемента. При этом идет обратный процесс превращения электрической энергии в химическую и материал электродов регенерируется.
Окислительно-восстановительный процесс, протекающий при пропускании тока через электролит, называется электролизом.
В результате электролиза аккумулятор может вновь работать как источник тока. Число циклов заряд - разряд может достигать несколько сотен. В авиации находят применение свинцовый, серебряно-цинковый и кадмий-никелевый аккумуляторы.
Свинцовый (кислотный) аккумулятор в заряженном состоянии отвечает электрохимической схеме:
![]()
В режиме источника тока при разряде на отрицательном электроде происходит окисление свинца, а на положительном - восстановление диоксида свинца. При заряде идут обратные процессы: на отрицательном электроде - восстановление сульфата свинца, на положительном - его окисление:
В заряженном свинцовом аккумуляторе, в зависимости от его типа, концентрация серной кислоты составляет 27 - 30% масс. При разряде она cнижается, так как в электролит выделяется вода. Плотность электролита при этом также уменьшается. Это дает возможность, измеряя плотность электролита, контролировать степень разряда аккумулятора.
Кадмий-никелевый аккумулятор выполнен по схеме:
При разряде на отрицательном электроде Cd окисляется, на положительном - Ni (OH ) 3 частично восстанавливается. При заряде идут обратные процессы:
Кадмий-никелевые аккумуляторы стабильны в работе, требуют меньше ухода и отличаются большим сроком службы, чем свинцовые.
Серебряно-цинковый аккумулятор в заряженном состоянии соответствует схеме:
При его работе протекают обратимые реакции: на отрицательном электроде - окисление цинка, на положительном - восстановление оксида серебра:
Главным преимуществом серебряно-цинкового аккумулятора является его высокая энергоемкость; на единицу массы он дает в 4 - 6 раз больше энергии, чем рассмотренные типы аккумуляторов.
Коррозия металлов. Коррозия – это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. Наиболее опасным и наиболее распространенным видом коррозии металлов является электрохимическая коррозия, которая происходит при контакте металлов с растворами электролитов. Чаще всего она является следствием работы короткозамкнутых гальванических элементов, которые образуются, например, при контакте деталей из разнородных металлов.
Роль электролита в этом случае может выполнять тонкая пленка влаги, образующаяся при адсорбции на металлических поверхностях водяного пара из атмосферы. Так, при контакте деталей из меди и железа в присутствии воды образуется гальванический элемент (рис.5.5):
Рисунок 5.5. Схема электрохимической коррозии
Железо, как более активный металл, служит анодом и подвергается окислению, на медном же катоде восстанавливается с участие воды кислород воздуха:
Для защиты металлов от коррозии используют различные покрытия: металлические, неметаллические, лакокрасочные, полимерные.
Примерные вопросы для самооценки:
1. Какие реакции называют окислительно-восстановительными?
2. Что понимают под восстановителем, окислителем?
3. В чем смысл метода электронных уравнений?
4. В чем смысл метода электронно-ионных уравнений?
5. Какие процессы называют электрохимическими?
6. Что такое стандартный водородный электрод?
7. Что является мерой окислительно-восстановительной активности системы?
8. Какую зависимость выражает уравнение Нерста?
9. Что называется гальваническим элементом?
10. Что называется катодом, анодом?
11. Как протекают окислительно-восстановительные процессы в аккумуляторах?
12. Что такое электролиз?
13. Что такое электрохимическая коррозия?
Задачи к теме № 5
Задача № 5.1.
Методом электронного баланса составить уравнения окислительно-восстановительных реакций. Указать окислитель и восстановитель:
1. NH 3 +O 2 NO+H 2 O
2. HClO 3 ClO 2 + HClO 4 +H 2 O
3. AgNO 3 Ag+NO 2 +O 2
4. NH 4 NO 2 +H 2 O
5. H 2 O 2 +PbS PbSO 4 +H 2 O
6. (NH 4) 2 Cr 2 O 7 N 2 +Cr 2 O 3 +H 2 O
7. Ca 3 (PO 4) 2 +C+SiO 2 CaSiO 3 +P+CO
8. FeS +O 2 Fe 2 O 3 +SO 2
9. N 2 H 2 +O 2 N 2 +H 2 O
10. S+KOH K 2 SO 3 +K 2 S+H 2 O
Задача № 5.2.
Составить уравнения окислительно-восстановительных реакций:
1) методом электронного баланса;
2) ионно-электронным методом.
Указать окислитель и восстановитель.
1. P+NO 3 H 3 PO 4 +NO 2 +H 2 O
2. Zn+HNO 3 Zn(NO 3) 2 NO 2 +H 2 O
3. K 2 Cr 2 O 7 +H 2 S+H 2 SO 4 S+Cr 2 (SO 4) 3 +K 2 SO 4 +H 2 O
4. KMnO 4 +KNO 2 +H 2 O KNO 3 +MnO 2 +KOH
5. FeSO 4 +H 2 O 2 +H 2 SO 4 Fe 2 (SO 4) 3 +H 2 O
6. CrCl 3 +H 2 O 2 +NaOH Na 2 CrO 4 +NaCl+H 2 O
7. CrO 3 +KNO 3 +KOH K 2 CrO 4 +KNO 2 +H 2 O
8. PH 3 +KMnO 4 +H 2 SO 4 H 3 PO 4 +K 2 SO 4 +MnSO 4 +H 2 O
9. Si+NaOH+H 2 O Na 2 SiO 3 +H 2
10. HCl+KMnO 4 Ci 2 +MnCl 2 +KCl+H 2 O
Задача № 5.3.
Решение:
Электродный потенциал рассчитывается по формуле Нернста, которая для металлических и водородного электродов записывается в виде:
где Е – электродный потенциал,
n – заряд иона металла (водорода).
Уравнение диссоциации сульфата железа:
Fe 2 SO 4 2 Fe 3+ +3 SO 4 2-
показывает, что при диссоциации 0,05 моль Fe 2 (SO 4) 3 образуется 0,05 2=0,1 моль ионов Fe 3+ .
Следовательно С(Fe 3+ )=0,1 моль/л, n =3.
Из таблицы 3 имеем E 0 (Fe3+/Fe)=-0,04.
Задача № 5.4.
Задача № 5.5.
На сколько изменится потенциал цинкового электрода, если раствор соли цинка, в который он погружен разбавить в 10 раз.
Задача № 5.6.
Потенциал кадмиевого электрода в растворе его соли равен 0,52В. Рассчитать концентрацию ионов Сd + в растворе.
Задача № 5.7.
Задача № 5.8.
Вычислить рН раствора, в котором потенциал водородного электрода равен – 100 mB.
Задача № 5.9.
|
Уравнение реакции |
Концентрация ионов, С моль/л |
рН |
MnO 4 - +8H + +5 e Mn 2+ +4H 2 O |
C(MnO4-)=C(Mn2+)=1 |
ClO 3 - +6H + +6e Cl - +3H 2 O |
C(ClO 3 -)=C(Cl -)=0,1 |
Cr 2 O 7 2- +14H + +6e 2Cr 3 ++7H 2 O |
C(Cr 2 O 7 2-)=C(Cr 3+)=1 |
PbO 2+ 4H + +2e Pb 2 ++2H 2 O |
C(Pb 2+)=0,1 |
Решение 1:
Потенциал окислительно-восстановительного электрода Е рассчитывают по уравнению Нерста:
где Е 0 стандартный электродный потенциал;
n – число участвующих в реакции электронов;
С ок, С восст – произведения концентраций веществ, находящихся в окисленной и восстановленной формах соответственно.
В данной системе в окисленной форме находятся ионы Mn 4 - и H + , в восстановленной – ион Mn 2+ и молекула Н 2 О. В реакции принимает участие 5 электронов. Учитывая, что концентрация воды практически остается постоянной и входит в значение Е 0 , имеем:
По данным таблицы 3: Е 0 (MnO 4 - /Mn 2+)=+1,51В.
Подставляя числовые значения получим окончательно:
Задача № 5.10.
Написать уравнения электродных процессов, протекающих при работе гальванического элекмента. Вычислить ЭДС элемента при заданных концентрациях, С моль/л.
|
Схема элемента |
С, моль/л |
Zn/Zn 2+ //Pb 2+ /Pb |
C(Zn2 +)=0,2, C(Pb 2+)=0,04 |
Mn/Mn 2+ //Ni 2+ /Ni |
C(Mn 2+)=0,1, C(Ni 2+)=0,01 |
Fe/Fe 2+ //Cu 2+ /Cu |
C(Fe 2+)=1, C(Cu 2+)=0,5 |
H 2 /2H + //Ag + /Ag |
C(H +)=0,01, C(Ag +)=0,1 |
Ni/Ni 2+ (C 1)//Ni 2+ (C 2)/Ni |
C 1 (Ni 2+)=0,1, C 2 (Ni 2+)=0,01 |
Cu/Cu 2+ //Fe 3+ /Fe 2+ |
C(Cu 2+)=1, C(Fe 3+)=C(Fe 2+)=1 |
Решение 1:
На основании данных таблицы 3 можно заключить, что более активный металл цинк будет в данном элементе анодом, а менее активный металл свинец – катодом.
ЭДС гальванического элемента равна разности электродных потенциалов окислителя (катода) и восстановителя (анода):
Используя формулу Нерста, имеем:
Задача № 5.11.
Установить, в каком направлении возможно самопроизвольное протекание в стандартных условиях данной реакции. Рассчитайте величину константы равновесия реакции.
|
Уравнение реакции |
2С l - + 2Fe 3+ 2Fe 2+ +Cl 2 |
H 2 O 2 +HClO H + Cl+O 2 +H 2 O |
5H 2 O 2 +H + +2IO 3 I 2 +5O 2 +6H 2 O |
Sn 4+ +2I - Sn 2+ +I 2 |
Sn 4+ +H 2 S Sn 2+ +S+2H + |
H 2 S+4H 2 O 2 2H + +SO4 2- +4H 2 O |
Решение 1:
Для определения направления окислительно-восстановительной реакциинеобходимо найти ЭДС гальванического элемента, образованного из дпнного окислителя и восстановителя.
где Е 0 ок, Е 0 восст – стандартные потенциалы окислителя и восстановителя.
Возможна та реакция, для которой, так как в этом случае изменение энергии Гиббса – отрицательная величина.
где n - число участвующих в реакции электронов;
F – число Фарадея, равное 96480 Кл/моль.
В свою очередь, изменение энергии Гиббса связано с константой равновесия соотношением:
Следовательно,
откуда
, .
Стандартные электродные потенциалы равны (см. таблицу 3):
Cl 2 + 2e 2Cl - E 0 (Cl 2 /2Cl -)=1,36 B
Fe 3+ + e Fe 2+ E 0 (Fe 3+ /Fe 2+ =0,77 B
Поскольку Е 0 (С l 2 /2С l )> E 0 (Fe 3+ / Fe 2+ ) окислителем будет служить хлор, а восстановителем – ион Fe 2+ .
Уравнения электродных процессов:
Суммарное уравнение:
Cl 2+ 2Fe 2+ 2 Cl - + Fe 3+
Таким образом, рассматриваемая реакция будет протекать справа налево.
К=10 20
Задача №5.12.
Рассчитать величину потенциала окислительно-восстановительного электрода, полученного при погружении платиновой проволоки в водный раствор, содержащий одновременно две соли А и В с концентрациями С А и С В, моль/л при заданном значении водородного показателя рН.
|
С А |
С В |
рН |
Na 2 Cr 2 O 7 |
Cr 2 (SO 4) 3 |
0,2 |
4 |
2 |
NaClO 2 |
NaClO |
0,1 |
0,3 |
9 |
3 |
KClO 4 |
NaClO3 |
0,2 |
0,3 |
3 |
4 |
Na 2 SO 4 |
K 2 SO 3 |
0,05 |
0,08 |
10 |
5 |
CrCl 3 |
CrCl 2 |
0,2 |
0,8 |
1 |
6 |
NaNO 3 |
NaNO 2 |
0,01 |
0,09 |
9 |
7 |
Na 2 S 2 O 8 |
Na 2 SO 4 |
0,1 |
0,2 |
6 |
8 |
KMnO 4 |
K2MnO 4 |
0,3 |
0,6 |
8 |
9 |
Fe 2 (SO 4) 3 |
FeSO 4 |
1 |
3 |
2 |
10 |
Ce(SO 4) 2 |
Ce 2 (SO 4) 3 |
0,002 |
0,001 |
0,5 |
Решение 1:
Раствор, содержащий одновременно окисленную и восстановленную форму одного и того же элемента (в данном случае, хрома), называется окислительно-восстановительной системой. В общем виде уравнение окислительно-восстановительной реакции для окислительно-восстановительного электрода имеет вид:
Ох+ ne Red ,
где n – число электронов, участвующих в реакции, а Ох и Red – окисленная и восстановленная форма элемента. Для определения величины электродного потенциала такой системы следует воспользоваться уравнением Нерста:
Формально в данном случае степень окисления в электродном процессе изменяет хром
Cr 6+ + 3 e Cr 3+ ,
то есть окисленной формой будет Cr 6+ - содержащая форма, однако это не означает, что можно записать по логарифмом в уравнении Нерста величину активности Cr 6+ . Это связано с тем, что сама по себе частица С r 6+ в водном растворе не существует, она входит в состав более сложной частицы Cr 2 O 7 2- , поэтому понятие активности, то есть кажущейся концентрации несуществующих частиц Cr 6+ лишено смысла. Можно определить активность (или концентрацию) частиц Cr 2 O 7 2- , но тогда и уравнение электродного процесса следует записать с участием частиц Cr 2 O 7 2-
Cr 2 O 7 2- +…. Cr 3+ +…,
однако в этом случае в левой части присутствует кислород, а в правой его нет, поэтому необходимо дописать в правую часть частицы, содержащие О 2- . Ионов О 2- в водном растворе нет, однако кислород с такой степенью окисления входит в состав либо молекул Н 2 О, либо ионов ОН - . Поскольку по условию среда является кислой (рН<7), концентрация ионов ОН - в этом растворе крайне мала, значит следует записывать электродный процесс на с участием этих ионов, а с участием молекул Н 2 О
Cr 2 O 7 2- + 14Н+ + 6е 2С r 3+ + 7 H 2 O
Таким образом, в электродном процессе помимо ионов Cr 2 O 7 2- и С r 3+ участвуют и ионы Н + , поэтому их концентрация также будет влиять на величину электродного потенциала, то есть
По условию, концентрации К 2 Cr 2 O 7 и Cr 2 (SO 4 ) 3 составляют соответственно 0,1 и 0,2 моль/л. Поскольку эти соли являются сильными электролитами, то есть диссоциируют в растворе нацело, концентрация ионов Cr 2 O 7 2- и Cr 3+ составят 0,1 и 0,4 моль/л. При рН=2 концентрация ионов Н + равна С(Н +)=10 -рН =10 -2 , отсюда:
Ключевые понятия:
· реакция окисления;
· реакция восстановления;
· окислитель;
· восстановитель;
· уравнение окислительно-восстановительной реакции;
· электрохимическая система;
· стандартный водородный электрод;
· стандартный электродный потенциал;
· химический источник тока;
· катод;
· анод;
· топливный элемент;
· аккумулятор;
· электролиз;
· коррозия.
Цель: Изучение окислительно- восстановительных реакций
Литература
Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степени окисления атомов элементов. Степень окисления - это условный заряд атома в молекуле. Она вычисляется исходя из положения, что все связи между атомами ионные. Окислением называется процесс отдачи электронов, а восстановлением процесс принятия электронов. Окисление и восстановление взаимосвязаны. Окислителем называется вещество, атомы которого принимают электроны, при этом он восстанавливается. Восстановителем называется вещество, атомы которого отдают электроны, при этом он окисляется.
Все окислительно-восстановительные реакции классифицируют следующим образом:
1. Межмолекулярные реакции. Это реакции, в которых окислитель и восстановитель являются различными веществами.
где Mn+4 - окислитель, Cl-1 - восстановитель.
2. Реакции внутримолекулярного окисления. Это реакции, которые протекают с изменением степеней окисления атомов различных элементов одного и того же вещества.
где Mn+7 - окислитель, а O-2 - восстановитель.
3. Реакции диспропорционирования. В этих реакциях и окислителем и восстановителем является элемент, находящийся в промежуточной степени окисления в составе одного и того же вещества.
где Cl20 - окислитель и восстановитель.
О возможности того или иного вещества проявлять окислительные, восстановительные или двойственные свойства можно судить по степени окисления элементов, выполняющих эти функции.
Элементы в своей высшей степени окисления проявляют только окислительные свойства, а в низшей степени окисления проявляют только восстановительные свойства. Элементы, имеющие промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства. Основные окислители и восстановители приведены ниже.
|
Окислители |
Схемы реакций |
|
Простые вещества: Галогены Г2 |
(НГ и их соли) |
|
Кислород О2 |
(H2O, оксиды и их производные) |
|
Неметаллы (S,P,N2) |
(ЭНn и их соли) |
|
Сложные вещества: HCl, H2SO4 (разбавленные) и т. п. (кроме НNO3). |
|
|
(SO2, H2SO3 и её соли) (H2S и её соли) |
|
|
(N2O3, HNO2 и её соли) (NH3, NH4+ и соответствующие соли) |
|
|
Окислители |
Схемы реакций |
|
Катионы металлов высшей степени окисления (Fe+3, Sn+4, и т. п.) |
|
|
Восстановители |
Схемы реакций |
|
Простые вещества: металлы (Ме) |
|
|
Неметаллы (S,C,P,N2,…) |
|
|
H2S и её соли, Na2S2O3 |
|
|
НГ и их соли |
|
|
Катионы металлов в низших степенях окисления (Fe+2, Sn+2, Sb+3, Cr+3 и т.д.) |
|
|
HNO2 и её соли. |
(HNO3 или ее соли). |
|
H2SO3 и её соли. |
(H2SO4 или ее соли). |
Контрольные вопросы
1. Перечислите все виды химических реакций?
2. Какие реакции называются окислительно-восстановительными?
3. В чём разница окис.-восст. Реакций от других видов реакций?
4. Назовите виды окислительно-восстановительных реакций?
5. Какие окислители и восстановители вы знаете?
Лекция №12 . ЭЛЕКТРОЛИЗ РАСТВОРОВ. ЗАКОНЫ ФАРАДЕЯ. КОРРОЗИЯ МЕТАЛЛОВ
Цель: Дать знания студентам о электролизе растворов, законе Фарадея и о видах коррозии и методах её защиты.
Литература
1. Ахметова Н.С. Общая и неорганическая химия. Изд. «Химия», М. 1981 г.
2. Глинка Н.Л. Общая химия. Изд. «Химия», Ленинград, 1987г.
3. Некрасов В.Б. Основы общей химии. Изд. «Химия», М. 1971г
4. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. Изд. «Химия», М.1983г
5. Коржуков Н.Г. Неорганическая химия. Москва «МИСИС», 2001г
6. Савельев Г.Г., Смолова Л.М. Общая химия Изд. ТПУ. Томск 2003г.
7. Курнакова Н.С. Современные проблемы общей и неорганической химии. М. «Химия» М., 2004г.
Электролиз -- это окислительно-восстановительный процесс идущий под влиянием электрического тока у растворов или расплавов электролита.
Здесь окислительно-восстановительный процесс идет принудительно, вследствие превращения электрической энергии в химическую энергию.
При прохождении электрического тока через раствор или расплав электролита, положительные ионы раствора стремятся к отрицательному полюсу, а отрицательные ионы стремятся к положительному полюсу. В электродах ионы разряжаются превращаясь в нейтральные атомы.
По мере происхождения электронного тока через раствор или расплав электролита электроны переходят от анода к катоду. Появление избытка электронов на катоде и недостатка их на аноде вызывает упорядоченное движение ионов в растворе или расплаве. Избыточные электроны катода переходят положительно заряженным раствора электролита превращая их в нейтральные атомы отрицательно заряженные ионы электролита у анода, отдавая свои электроны аноду разряжаются. Таким образом, на катоде происходит процесс восстановления и на аноде процесс окисления.
Электроны с анода уходят во внешнюю цепь. В зависимости от природы анода источником этих электронов является сам анод или анионы из раствора или расплава, в этом случае анод нерастворимый. В качестве нерастворимого анода можно принять графит, Запятая, Au.
Электролиз водных растворов электролитов с нерастворимыми электродами.
При электролизе водных растворов электролитов действию тока не только подвергаются ионы электролита, но ионы Н и ОН воды, образовавшиеся при диссоциации.
Поэтому на катоде могут разрядиться два иона, положительных ион электролита и Н иона. Какой из ионов разрядился, определяется положением металла в ряду напряжений, а также от концентрации ионов в растворе.
1. У катода ионы металла стоящие в ряду напряжения до Ал включительно в водном растворе разряжаться не могут, вместо них разряжаются ионы водорода от воды, т.е. электроны от катода принимает сама вода это объясняется тем, что разница между электродами потенциальна очень велика.
Литий, барий, K, Na, Приблизительно, Мг, Ал, МС, Цинк, Вишнево-красный, Fe, Cd, Co, Никель, Sn, H2, Cu, Ag, Гектограмм, Запятая, Au.
2. При электролизе раствор солей металлов состоящие от Ал до H2 в ряду напряжения у катода разряжаются ионы этих металлов и частично разряжаются ионы Н воды. Откуда видно что восстанавливаются ионы металлов более активных чем водород. Это связано с тем, что в водных растворах катионы электролита и ион Н воды находятся в одинаковых условиях по отношению их концентрации.
3. При электролизе растворов солей металлов состоящих в ряду напряжения после Н2 у катода разряжаются только ионы этих металлов.
У анода -- в первую очередь разряжаются ионы остатков без кислородных кислот так как они легко теряют свой заряд чем ион ОН воды, а ионы остатков кислородных кислот не способны разряжаться у анода, а место них окисляются ионы ОН воды.
Электролиз водных растворов солей с растворимыми электродами.
В этом случае электролиза, закономерности, отличные в отношение катодного процесса при нерастворимом аноде, сохраняют свою силу.
Особенности анодного процесса заключается в том, что источником
электроном является электрод, из которого сделан анод, т.е. анод растворяется и переходит в раствор в виде иона Ме+n.
Например: разберем электролиз водного раствора CuSO4 с медным анодом.
CuSO4 = Сu ++ + SO4-2
В этом случае происходит перенос Сu с анода на катод.
К / Сu ++ + ОН-= Медь (О) 2 вторичный процесс
Электролиз с растворимым анодом широко используется для покрытия одних металлов другими.
Например: при никелировании предмета -- анодом служит Никель электрод, а катодом покрываемый предмет, в качестве электролита берут раствор соли никеля.
NiSO4 с Никель анодом и Fe (покрывающим материалом) - катод.
Н2O+NiSO4 = Никель ++ + SO4--
Покрытие одного металла с другим с помощью электролиза называется гальваностегией. Этим же методом пользуются при получении из черновой меди чистую медь.
CuO + С = медь + СО
Из черновой меди делают анод. В первую очередь с анода в раствор переходит Цинк, Sn.
Электролиз расплавов с нерастворимым электродом.
Металлы стоящие в ряду напряжения до Ал включительно получают электролизом расплавов их солей, т.к. самым сильным восстановителем является электрический ток.
Например: электролиз расплава NaC1.
NаС1 Nа + + Сl-
Получение Na.
Na можно получить из NaC1 и NaOH. Тпл NaCl = 805o С, Тпл NaOH = 400o С
По Тпл выгодно использовать NaOH, но он является дорогим сырьем чем NаС1.
NaOH=Nа + + ОН-
|
2OH--2e = 2H2O + O: O+O = O2 |
Законы электролиза
Количественные стороны электролиза впервые были изучены английским физиком М. Фарадеем, который установил следующие законы.
1. Закон Фарадея.
Весовое количество выделяемого при электролизе вещества пропорционально количеству протекшего через раствор электричества и совершенно не зависит от других факторов.
2. Закон Фарадея
При пропускании равные количества электричества из различных химических соединений на электродах выделяются эквивалентные количества веществ.
Для выделения одного грамм-эквивалента любого вещества необходимо затратить 96500 кулон электричества.
Закон Фарадея можно выразить также следующим уравнением:
m - масса выделяемого вещества, Э - эквивалент вещества, F - число Фарадея, Q - количество электричества.
Q = JJ-сила тока, А.
Продолжительность электролиза, сек.
Следующий опыт является наглядной иллюстрацией II закона Фарадея. Электрический ток, протекающий через растворы НСl, АgNО3, CuSO4, FePO4, SnC14. Растворы предварительно помещают в приборы, в которых по окончании опыта возможно определить количества выделявшегося веществ.
Через некоторое время, когда у электродов находится достаточное количество продуктов электролиза прекращают пропускании тока и производят измерения. Оказывается, что за время, в течении которого из раствора НС1 выделяется 1 г Н2, те 1 г последнего, из остальных растворов выделяются указанные количества металлов. Сопоставления количества выделявшего у катода веществ с атомными весами показывают что вещества выделяются в количестве равной их эквивалентам к такому же результату приводит измерения количество веществ выделявшего у анода. В 1 и 5 выделения по 35,5 г осмора, в 2, 3, 4, выделяется по 8 г кислорода.
Например: сколько выделится меди если через водный раствор
CuSO4 пропускать ток силой 2а в течении 2 часа.
2 час = 7200сек
Э = (Ав) / В: CuSO4 Cu+2 + SO4--
m = (31,8 * 2 * 7200) / 96500 = 4,74 г.
Поляризация при электролизе.
Окислительные и восстановительные процессы, протекающие под действием электрического тока, могут вызвать существенные изменения электродов. Если вести электролиз воды раствор СиС1 с нерастворенным электродом.
Сu Сl2 = Сu ++ + 2 Замкнутый
Хлор адсорбируется на поверхности электрода Запятая и образуется слой Замкнутый Таким образом раствор СиС12 будет непосредственно соприкасаться не с пластиной а Са и Замкнутый.
Если теперь удалить источник тока и соединить внешней цепью через гальванометр концы электродов, то гальванометр покажет наличие в цепи электрического тока -- тока электрохимической поляризации, его направление окажется обратным тому которое давал источник тока. ЭДС образовавшегося гальванического элемента равна разности потенциалов электродов.
Медь / CuCl2 / С12 (Запятая)
c12 / замкнутый = + 1,36 Медь ++ / медь = 0,34
Если исходить из нормальных электродных потенциалов,
то ЭДС = c12 / замкнутый- Медь ++ / медь = 1,02
и это ток поляризации препятствует электролизу. Чтобы электролиз продолжал идти с нужной интенсивностью, к электродам надо прикладывать напряжение источника тока несколько выше, чем ЭДС тока поляризации.
Наименьшая разность потенциалов, необходимая для непрерывного электролиза, называется потенциалом разложения.
Потенциал разложения электролита всегда больше чем ЭДС поляризации.
Разность между потенциалом разложения и ЭДС поляризации называется перенапряжением.
Перенапряжение зависит от следующих факторов:
1. от материала, из которого сделаны электроды;
2. от состояния поверхности электродов;
3. от агрегатного состояния веществ, выделившихся на электродах;
4. от плотности тока и от температуры раствора.
Аккумуляторы
Введение поляризации электродов используется на практике в приборах, служащих для накопления химической энергии, легко превращаемой в нужный момент в электрическую энергию. Такие приборы называются аккумуляторами.
Аккумуляторы различаются между собой химической природой электродов и электролита, а также конструкцией. Практическое применение имеют главным образом кислотные и щелочные аккумуляторы.
Кислотные (свинцовые) аккумуляторы.
Свинцовый аккумулятор состоит из решетчатых свинцовых пластин, заполненных пастой из окиси свинца PbO и погруженных в 25 - 30% раствор H2SO4. В результате взаимодействия PbO с раствором H2SO4 на поверхности Pb пластины образуется слой трудно растворимого PbSO4.
РbО+ H2SO4 = PbSO4+ Н2О
Чтобы зарядить аккумулятор, т.е. накопить в нем химическую энергию, надо одну из его свинцовых пластин соединить с отрицательным, а другую с положительным полюсом источника тока. Происходящие при этом реакции можно выразить отрицательным полюсом катода.
К PbSO4 + 2е = Pb + SO4--
+А PbSO4 - 2е + 2 Н2О = РbО2+ SO4-- + 4Н+
Как видно из уравнения на отрицательном полюсе ионы присоединяя по два электрона, превращается в металлический. На положительном полюсе окислительный процесс приводит к превращению PbO2.
Если сложить эти реакции, то общее выражение процесса примет
2 PbSO4+ Н2O = РbО2 + SO4-- + 4Н+
При заряде аккумулятора в реакцию вступает вода и образуется кислота.
Аккумуляторы заряжают до тех пор пока не начнется электролиз воды с энергичным выделением водорода на катоде и кислорода на аноде.
Итак при заряде аккумулятора электроды становятся химически различными и между ними появляется разность потенциалов.
Электрическая схема характеризующая полученных гальванический элемент, имеет вид.
Pb / H2SO4 / PbO2 (Pb) +
Если соединить пластину заряженного аккумулятора проводником, то от пластины покрытой свинцом к пластине покрытой PbO2 будут перемещаться электроны, т.е. появляется электрический ток, аккумулятор работает как гальванический элемент. На его электродах происходят следующие реакции.
Pb - 2е + SO4-2 = Pb S04
PbO2 + 2е = 4Н+ = SO4-2- = PbSO4+ 2Н2О
При разрядке расходуется H2SO4 и концентрация H2SO4 в растворе уменьшается. Уменьшение концентрация кислоты служит показателем степени разряженности аккумулятора.
ЭДС свинцового аккумулятора немного больше 2 В.
Щелочные аккумуляторы.
Из щелочных аккумуляторов наибольшее практическое применение нашли Fe - Ni, Cd - Ni, Ag - Zn аккумуляторы. В заряженном Fe - Ni аккумуляторе активной массой отрицательного электрода является порошкообразное железо, спрессованное с небольшим количеством окиси ртути, активная масса положительного электрода - Ni (ОН)3 с небольшой примесью графита. электролитом служит 23 % КОН.
При разрядке происходят следующие процессы
А(-)Fе - 2е = Fe
K (+)Ni(OH)3 + е = Ni (ОН)2
реакции протекающие при зарядке имеют обратное явление и общее уравнение заряд и разряд имеет общий вид
Fe + 2 Ni (ОН)3 Fe(ОН)2 + 2 Ni(ОН)2
ЭДС такого аккумулятора около 1,2 в.
Серебряно -- цинковый аккумулятор
схема этого аккумулятора следующая
(+) Ag2O/КОН/ Zn(-)
Ag - Zn аккумуляторы значительно превосходят рассмотренные выше кислотные и щелочные аккумуляторы по удельной энергии и удельной мощности.
Эти аккумуляторы отличаются весьма небольшим саморазрядом и возможностью использования их в широком интервале температуры - от 30 до 70 градусов Цельсия.
Использовать их в широком интервале температуры от - 30 до + 70 с.
В нем отрицательный электрод представляет собой прессованную смесь ZnO с порошком Zn, а положительный электрод представляет собой каркас из Ag проволоки спрессованной с Ag2O . Раствором электролита служит 39% КОН 1мл раствора ZnO .
Аg + ZnO + Zn (ОН)2 2 Zn+ Н2О + 2 Аg2О
При заряде
электрод (+) 2Аg + 2 ОН - 2е = Ag2O+ Н20
(-) ZnO + 2е = Zn
оксид цинка превращается в цинковую губку.
ZnO + КОН + Н2О = K
К+2е = Zn + КОН + 2ОН
КОРРОЗИЯ МЕТАЛЛОВ.
Большинство металлов, приходя в соприкосновение с окружающей средой, подвергаются с поверхности разрушение. Причиной этого является химическое взаимодействие металлов с находящимися в воздухе газами, с водой и растворенными в ней веществами. При этом в результате окислительных процессов образуется вещества, обладающие свойства, резко отличающимися от свойств исходного металла.
Всякий процесс химического разрушения металлов под действием окружающей среды называется коррозией.
Различают несколько форм проявления коррозии. Наиболее часто встречаются равномерная, местная и межкристаллитная.
Из них наиболее опасно межкристаллитная коррозия, она распространяется между кристаллитами, и может незаметно привести к поражению конструкции на большую глубину.
По механизму химических процессов различают два вида коррозии химическая и электрохимическая.
1. Химическая коррозия - это разрушение металла без возникновения в системе электрического тока (при непосредственном соприкосновении металла с окислителем).
Химическая коррозия подразделяется на:
а) газовая коррозия вызывается под воздействием сухих газов. Н:
O2 , SO2, С12,F2, Вr2,СО2 и др.
Она наблюдается в основном при высокотемпературной обработке металлов, в двигателях внутреннего сгорания и т.д.
б) жидкостная химическая коррозия - протекает под действием органических жидкостей без участия воды: производная нефти, бензин, крезол, бензол, толуол и др.
в) электрохимическая коррозия-это разрушения металла в среде электролита с возникновением внутри системы электрического тока.
Электрохимическая коррозия подразделяется на:
1. Атмосферная.
2. Почвенная.
3. Коррозия под действием блуждающих токов.
Также как для работы гальванического элемента для гальвано-коррозии необходимо наличие двух различных электродов и раствора электролита. Из этого можно утверждать, что чистые металлы теоретически вообще не должны подвергаться электрохимической коррозии. Если, например, рассмотреть коррозию железа с включением меди во влажном воздухе(Fe+Cu) при этом образуется гальванический элемент
химия реакция катализ раствор
А - Fe/Н2О/Cu + К
Fe - анод, Си - катод, и в результате коррозируется.
Эти электроны Fe2+ на
поверхности Сu(катоде) восстанавливают кислород воздуха
О2 +2Н2О+4е = 4ОН
Fe2+ + ОН- = Fе(ОН)2,
Железо во влажном воздухе быстро переходит в 3-х ионновое железо.
4Fe(OH)2 + О2 +2Н2О= 4Fe(OH)3
Из этого примера видно, что при образовании гальванического элемента коррозируется более активный металл.
Участок поверхности, с которой переходят ионы в раствор, т. е. где металл коррозирует, называется анодом, участок, на котором разряжаются катионы электролита, называется катодом.
Характер катодных процессов при коррозии определяется веществами, имеющимися в растворе. При сильно кислой среде восстанавливаются ионн-водороды:
2 Н+ + 2 С =Н2.
В атмосферной коррозии рН среды близка к нейтральной, и поэтому на катоде восстанавливается растворённый в воде кислород.
О2+2Н2О+4е=4ОН
Пластику чистого цинка погрузить в разбавленный раствор кислоты, то выделение водорода, действительно, почти не наблюдается. Отсутствие реакции можно объяснить тем что, ионы цинка, начинающие переходить в раствор, создают у поверхности пластины слой положительно заряженных гидрированных ионов.
Это слой является барьером, который препятствует ионам водорода подходить в плотную к цинковой пластине и получать от неё электроны и растворение цинка прекращается. Если коснуться к поверхности цинка каким то менее активным металлом (Cu) как в следствии образования гальванического элемента
А-Zn / К-ТА / Cu+K
начинается энергичное выделение водорода на поверхности менее активного метала
Эти электроны переходя к Сu ликвидируют у. поверхности Сu защитный барьер из её ионов, и ионн водорода беспрепятственно восстанавливаются
Металлы стоящие в ряду напряжения левее легко подвергаются коррозии. Чистые металлы, также Аu, Ag, Pt, не коррозируются. А следующие металлы: Mg, Al, Cu, Cr, Ni, при коррозии образуют плотную защитную окисную плёнку, что препятствует дальнейшей коррозии.
Почвенная коррозия-этот тип коррозии является сложной разновидностью коррозии металлов в почве. Здесь играют роль химические и физические свойства почв. Коррозия в этом случаи зависит от следующих факторов
1. Влажности и среды почвы.
2. От электро и воздухо проницаемости почвы.
3. От электродного потенциала металла в контакте с
почвой и др.
Коррозия под действием блуждающих токов.
Большую роль в процессах подземной коррозии играют блуждающие токи (токи посторонних источников)
В зоне К вблизи рельса восстанавливается кислород, растворенный во влаге грунта. В результате создается избыток ионов OH-.
Наличие этих ионов смещает равновесие, имеющееся у поверхности подземного металла, провода. Связывание ионов с ионами приводит к появлению в данном месте трубы повышенной концентрации избыточных электронов. Эти электроны начинают помещаться вдоль трубы. Одновременно на рельсе в зоне А протекает окислительный процесс. Металлы рельса разрушаются. Ионы металла переходят во влагу грунта. Этому способствуют ионы ОН-, образующиеся у поверхности трубы в зоне А под влиянием электронов, перешедших сюда из зоны К. Таким образом в зоне К коррозирует подземная труба, в зоне А - рельс.
Методы защиты металлов от коррозии.
Исходя из того, что наиболее распространенной является электрохимическая коррозия, различные методы защиты учитывают прежде всего этот тип коррозии.
Способы защиты металлов от коррозии многообразны, остановимся только на основных.
1. Изоляция металла от коррозионной среды.
Этот метод заключается в изоляции защищаемого металла от влаги, т.к. в отсутствии ее не возникает гальванический элемент, а значит и не будет коррозии.
Изолирующие покрытия могут быть самыми разнообразными: покрытия металлов с не металлическими веществами, т.е. маслом, лаком, красками.
2. Покрытие металлов с металлами. Различают два вида металлических покрытий, катодное и анодное. Примером анодного покрытия может служить покрытие Fe c Zn. В этом случаи защищающие металл Zn более активен, чем защищаемый Fe.
При нарушении целостности покрытия при доступе влаги возникает гальванический элемент А-Zn/H2О + O2/Fe, в котором анод Zn разрушается, а катод -- железо остается до тех пор, пока не будит разрушен весь защитный слой
Zn-2е =Zn
Zn+2 + 2ОН- = Zn (ОН)2
Однако защиту иначе называют протекторной защитой, т.е. протектор является анодом. Этот метод защиты применяется, например, для защиты от коррозии лопастей турбин подводных частей корабля в большинстве случаев в качестве протекторов применяет Zn.
Катодная защита. Покрытие из менее активного металла называется катодным. В этом случаи при нарушении целостности покрытия усиленно коррозирует защищаемый металл.
Контрольные вопросы
1. Какой процесс происходит на катоде и на аноде во время электролиза?
2. Какие вы знаете электроды?
3. Назовите виды аккумуляторов.
4. Что такое химическая коррозия? Виды коррозии?
5. Как надо бороться с коррозией?
— это источник тока, в котором химическая энергия активных веществ пространственно разделенных электродов в результате окислительно-восстановительных реакций превращается в электрическую энергию. Купить свинцовый аккумулятор в сск можно качественный. Можно быть уверенным в качестве аккумуляторных батарей, если приобретать их в проверенной фирме, которая имеет статус и много положительных отзывов среди знающих людей. В свинцовых аккумуляторах положительные электроды состоят из диоксида свинца Рb0 2 , отрицательные — из губчатого свинца. Электролитом является водный раствор серной кислоты H 2 SO 4 .
Основной токообразующий процесс в соответствии с общепринятой теорией двойной сульфатации в свинцовом аккумуляторе описывается следующей реакцией:
Рb + Рb0 2 + 2H 2 S0 4 2PbS0 4 + 2H 2 0, (1.1)
Реакция (1.1) является суммарной и определяется следующими процессами, протекающими на положительном и отрицательном электродах. Процесс на отрицательном электроде выражается, как:
Pb + HS0 4 PbSQ 4 + it + 2e, (1.2)
На положительном:
Pb0 2 +HSO 4 - +3H 3 + 2e PbSO 4 + 2H 2 O, (1.3)
Таким образом при разряде свинцовых аккумуляторов на обоих электродах образуется практически нерастворимый сульфат свинца вследствие восстановления диоксида свинца на положительном электроде и окисления свинца на отрицательном. При заряде, наоборот, происходит образование Рb02 на положительном электроде и губчатого свинца па отрицательном. Схематическое изображение основных процессов, протекающих в свинцовом аккумуляторе, представлено на рисунке 1.1.
Как видно, при разряде раствор электролита разбавляется. При длительных режимах разряда плотность электролита может снижаться до значения 1,02-1,03г/см3. Это свойственно аккумуляторам любых производителей и дистрибьюторов, но только если вы сможете .
Рисунок 1.1 Схематическое изображение основных окислительно-восстановительных процессов, протекающих в свинцовом аккумуляторе
Электродвижущая сила данной электрохимической системы описывается известным уравнением Нернста:
где: Е — стандартное значение э. д. с, a и — активности раствора серной кислоты и воды, v = 2,3 ,
R, T, z, F- известные термодинамические величины.
Значение Е° легко может быть вычислено по термодинамическим данным.
Е° = 2,041 В.
Таким образом, уравнение электродвижущей силы в свинцовом аккумуляторе:
показывает, что э. д. с. зависит от концентрации раствора серной кислоты.
При заряде свинцовых аккумуляторов кроме токообразующих протекают побочные процессы образования газов, вызванные разложением воды и снижающие коэффициент использования зарядного тока. На отрицательных электродах происходит выделение водорода, на положительных — кислорода. Если выделение водорода начинается при практически полностью заряженном аккумуляторе, то выделение кислорода начинается значительно раньше. Кроме того, при использовании положительных токоотводов из свинцово-сурьмяных сплавов на отрицательных электродах, вследствие электрического переноса сурьмы с положительных электродов на отрицательные, происходит образование токсичного сурьмянистого водорода SbH3 (стибина).
 Научно-исследовательский институт кораблестроения и вооружения вмф
Научно-исследовательский институт кораблестроения и вооружения вмф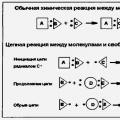 Благотворная роль активных форм кислорода
Благотворная роль активных форм кислорода Приглашаем к участию! Физическая химия. Конспект лекций
Приглашаем к участию! Физическая химия. Конспект лекций