Приглашаем к участию! Физическая химия. Конспект лекций
Теоретическая и математическая химия для школьников. Еремин В.В.

М.: 2007 - 392 с.
На школьном уровне показаны межпредметные связи химии с другими науками. Рассмотрены основные области применения элементарной математики и теоретической физики к химическим явлениям. Каждый раздел книги содержит подробный теоретический материал, разобранные задачи и задачи для самостоятельного решения. Ко всем задачам даны ответы. Книга предназначена для углубленного изучения химии в средней школе, а также для подготовки к химическим олимпиадам различного уровня - от школьных до международных. Она может быть полезна всем интересующимся химией и ее многочисленными приложениями.
Формат: pdf
Размер: 8,1 Мб
Смотреть, скачать: drive.google
ОГЛАВЛЕНИЕ
Предисловие 4
Глава 1. Элементарная математика в химии 5
§ 1. Роль математики в химии 5
§ 2. Расчеты и оценки 6
§ 3. Алгебра 12
§ 4. Геометрия 20
§ 5. Элементы математического анализа 26
§ 6. Элементы комбинаторики 35
§ 7. Компьютерная математика в химии 40
Литература 43
Глава 2. Строение атомов и молекул 45
§ 1. Происхождение атомов и молекул 45
§ 2. Строение ядер атомов. Ядерные реакции 50
§ 3. Элементарные понятия квантовой механики 63
§ 4. Электронные конфигурации атомов 90
§ 5. Химическая связь и строение молекул 120
Литература 143
Глава 3. Химическая термодинамика 145
§ 1. Тепловые эффекты химических реакций 147
§ 2. Второй закон термодинамики 160
§ 3. Фазовое равновесие и фазовые переходы 178
§ 4. Химическое равновесие 186
§ 5. Распределения по энергии и скорости 226
§ 6. Электрохимические цепи 232
§ 7. Термодинамические свойства растворов 250
Литература 262
Глава 4. Химическая кинетика 263
§ 1. Закон действующих масс 264
§ 2. Зависимость скорости реакции от температуры 276
§ 3. Сложные реакции 291
§ 4. Катализ 340
§ 5. Фотохимия 366
Литература 392
Перед вами необычная книга о химии. В ней довольно мало химических формул, зато
в изобилии встречаются математические символы, уравнения и графики функций.
Здесь можно найти множество физических понятий, например «квант», «фотон»,
«теплота». И все-таки на первом месте в книге стоит химия. Математические методы
и физические теории здесь играют только утилитарную роль: они помогают описывать
химические вещества и реакции между ними.
Основная задача книги - показать, что химия неотделима от математики и физики. У
химии нет своих собственных законов. Все законы химии, например периодический
или закон сохранения массы, имеют физическую природу. Основные теории химии
также родом из физики, это - квантовая механика, кинетика и термодинамика
(последние две употребляются со словом «химическая»); все они на элементарном
уровне рассмотрены в этой книге. И все-таки химия - самостоятельная наука.
Главное, что отличает ее от других наук - разнообразие изучаемых объектов:
только индивидуальных веществ известно более 20 миллионов, не считая
многочисленных смесей. Физика изучает то, что дала природа, а химия - то, что
создает сама, то есть новые вещества, которых в природе не существовало.
Современная химия самым тесным образом взаимодействует с другими областями
естествознания. Самое интересное в науке сегодня происходит на междисциплинарном
уровне, на границах между химией, физикой, математикой и биологией. Об этом наша
книга.
Предназначена она для школьников, имеющих склонность к естественным наукам. В
основе книги - олимпиадные задачи разного уровня, от областного до
международного. Многие задачи приведены с подробными решениями, ко всем
расчетным задачам даны ответы. Каждый параграф начинается с теоретического
материала, который может быть интересен и сам по себе, а не только в связи с
решением задач. Книгу можно использовать для дополнительных занятий по химии,
самостоятельной работы, подготовки к химическим олимпиадам. Она имеет яркий
физико-математический характер, но рассчитана все-таки на юных химиков - тех,
кто будет определять лицо химической науки через пару десятилетий.
Очень хочется, чтобы это были эрудированные и широко мыслящие люди, способные
применить в химии все лучшее, что создано дружественными науками. Для этого и
написана данная книга.
Общий рецепт подготовки к олимпиадам по химии - очень простой: читать хорошую литературу и много работать - решать задачи, анализировать готовые решения, изучать химические свойства веществ. Мы дадим вам список книг с короткими комментариями и ссылки на электронные ресурсы. Конечно, этот список - далеко не исчерпывающий и не универсальный, но все, что в нем есть - гарантированно высокого качества. Большинство книг можно купить в книжных магазинах, а некоторые букинистические книги можно скачать из сети.
Если говорить о конкретных олимпиадах, то лучший способ подготовки - решать задачи прошлых лет. В сети можно найти полные задания и решения практически любой сколько-нибудь серьезной олимпиады по химии за последние 5-7 лет. Однако такое обилие информации не всегда помогает, может не хватить опыта самостоятельной работы. Мы предлагаем несколько советов по эффективной работе с задачами и решениями:
- Возьмите полный комплект заданий, выделите достаточно времени (например, выходной день) и постарайтесь решить как можно больше задач. В любой задаче, даже если она не получается полностью, постарайтесь продвинуться как можно дальше и зафиксируйте вопрос, на который вы не смогли ответить.
- После этого можно обратиться к решениям. Разбирая каждую задачу, выпишите для себя в отдельную тетрадь:
- Новые уравнения реакций, которые вы узнали;
- Новые химические идеи, которые вы поняли из решения;
- Новые технические приемы решения (например, уравнение реакции в общем виде, способ выбора переменных, аргументированный подбор и т. д.);
- Ошибки, которые вы совершили при решении.
Такая подготовка займет достаточно много времени, но именно она является наиболее эффективной. Потом, листая заполненные тетради, вы легко освежите в памяти необходимую информацию. И это будет не просто поверхностное ознакомление с правильными решениями, а глубокое освоение нового материала.
Остается единственный вопрос: где взять столько времени? Ответ на это может быть такой: время есть всегда, просто мы не всегда им правильно пользуемся.
Успехов в подготовке и работе с литературой!
С чего начать:
Неорганическая химия
- Б. В. Некрасов «Основы общей химии» (в 2 томах, М.: Химия, 1973). Одна из лучших отечественных книг по химии, абсолютная классика. Энциклопедия интересной неорганической химии, лучшая книга по химии элементов. Книга двухуровневая. Начинающему химику лучше читать только крупный шрифт. Но самое интересное напечатано мелким шрифтом. В некоторых разделах книга немного наивна с современной точки зрения, но это не умаляет ее ценности для начинающих химиков. Книгу можно найти в букинистических магазинах или скачать из сети.
- Е. А. Еремина, О. Н. Рыжова «Справочник школьника по химии» (М.: изд-во МГУ, 2014). Книга написана по программе «МГУ - школе». Изначально она планировалась в помощь абитуриентам, поступающим в МГУ, но оказалась очень полезной и для подготовки к олимпиадам. В этой книге тщательно отобраны важнейшие реакции органических и неорганических веществ, а также дано простое описание основных физико-химических понятий.
- И. А. Леенсон «Химические элементы» (М.: АСТ, 2017). Подробный путеводитель по периодической таблице, своего рода энциклопедия элементов, составленная одним из лучших популяризаторов химии. Книга интересна и начинающим, и профессиональным химикам.
Органическая химия
- И. И. Грандберг. «Органическая химия» (4-е изд., М.: Дрофа, 2001). Число переизданий говорит само за себя. Это - учебник для студентов, однако написан настолько просто и понятно, что не вызовет трудностей и у школьников.
- В. М. Потапов. «Задачи и упражнения по органической химии» (3-е изд., перераб. и дополн., М.: Химия, 1989). Довольно простой, но очень грамотный задачник, в котором приведено очень много заданий. Можно скачать бесплатно в сети.
Физическая химия
- В. В. Еремин. «Теоретическая и математическая химия для школьников» (2-е изд., М.: МЦНМО, 2014). Одна из немногих книг по физической химии, доступных для школьников. Это - задачник, но в каждом разделе есть теоретическое введение. Есть также вводная глава по математике. Большим достоинством книги является то, что задачи разбиты на три уровня, поэтому ее можно использовать для подготовки не только к международной, но и к школьной олимпиаде.
Задачники
- В. В. Еремин, Н. Е. Кузьменко «Сборник задач и упражнений по химии. Школьный курс » (М.: Экзамен, 2008). Хороший сборник задач, по которому можно готовиться к олимпиадам начального уровня. Удачное сочетание расчетных, качественных задач и цепочек превращений. К каждому разделу дано краткое теоретическое введение, которое можно использовать как конспект. Книги нет в продаже.
- Н. Е. Кузьменко, В. В. Еремин, В. А. Попков «Начала химии» (1-15 изд., М.: Экзамен, 2000-2013; 16-е изд, перераб. и дополн., М.: Лаборатория знаний, 2016). Хотя на обложке написано «Учебник», это - пособие для поступающих в вузы. Оно выдержало более 15 изданий и стало очень популярным. В книге много задач и хорошо разобранных примеров.
- А. Н. Левкин, Н. Е. Кузнецова «Задачник по химии» (для 9, 10 и 11 класса отдельная книга, М.: Вентана-Граф). Хорошие сборники задач школьного уровня. Многие задачи имеют познавательный характер. Уровень сложности некоторых задач соответствует школьному или муниципальному этапу Всероссийской олимпиады школьников.
Чем продолжить:
Неорганическая химия
- Под редакцией Ю. Д. Третьякова «Неорганическая химия» (в 3 томах, М.: Академия, 2004-2007). Университетский учебник, написанный преподавателями МГУ. Многие разделы доступны и полезны для школьников, но в целом он довольно сложный и к нему лучше обращаться для решения отдельных вопросов, а не для систематической работы.
- Н. Я. Турова «Таблицы-схемы по неорганической химии» (М.: МЦНМО, 2009). Легендарный справочник по неорганической химии. Есть в сети.
- Н. Н. Гринвуд, А. М. Эрншо «Химия элементов» (в 2 томах, М.: Бином. Лаборатория знаний, 2015). Один из лучших иностранных учебников по неорганической химии. Прекрасное дополнение к трехтомнику под ред. Третьякова.
Органическая химия
- Дж. Марч «Органическая химия: реакции, механизмы и структура» (в 4 томах, М.: Мир, 1987). Классическая книга по органической химии, хорошо подходит продвинутым школьникам. Можно купить в букинистах или бесплатно скачать в сети. В 2019 году в издательстве "Лаборатория знаний" вышло 4-томное издание "Органическая химия Марча. Реакции, механизмы, строение".
- Н. А. Тюкавкина, Ю. И. Бауков «Биоорганическая химия» (3-е изд., М., Дрофа, 2004). Общепризнанный учебник для медицинских вузов. Для продвинутых школьников - одно из лучших изданий по биохимии.
Задачники
- А. З. Лисицын, А. А. Зейфман «Очень нестандартные задачи по химии» (М.: МЦНМО, 2015). Сборник содержит более 500 нестандартных задач по неорганической, органической и физической химии. Задачи разделены на несколько уровней сложности, ко всем задачам даны ответы и/или указания. Сборник предназначен, в первую очередь, для дополнительных занятий по химии в школе: подготовки к олимпиадам, школьных кружков, он будет интересен всем, кто связан с химией и интересуется красивыми и необычными химическими структурами и превращениями.
Популярные и научно-популярные книги по химии
- Энциклопедия для детей. Том 17. Химия (М.: Аванта+, 2000, 2007, 2010). Замечательная книга по химии для детей и взрослых. Очень интересные статьи, охватывающие все основные разделы химии, прекрасные иллюстрации, отличный русский язык. Книга хороша и для начинающих, и для тех, кто уже что-то знает. Эту книгу на полке должен иметь любой химик.
- М. Г. Воронков, А. Ю. Рулев «О химии и химиках и в шутку, и всерьез» (М.: Мнемозина, 2011). Коллекция интересных и забавных историй о химических открытиях и о химиках в жизни. Это - не сборник научных анекдотов, а хорошее пособие по истории химии, в котором представлены только тщательно проверенные факты. Эту книгу интересно будет читать - и школьникам, и их родителям.
- Краткий миг торжества (М.: Наука, 1989). Книга о том, как делались великие открытия - в химии, физике, биологии. Она для тех, кто собирается профессионально заниматься наукой и приносить пользу человечеству. Книга - букинистическая, в магазинах ее нет, но ее можно скачать из сети.
ещё 4 книги
- И. С. Дмитриев, К. М. Никитин «Дмитрий Менделеев. Автор великого закона» (М.: Аст-Пресс, 2013). Книга из серии «Путеводитель по истории России». Короткая, но очень содержательная и достоверная биография самого известного в мире ученого России - Д. И. Менделеева. Описаны не только выдающиеся достижения ученого, но и его поиски и неудачи в науке, общественной и личной жизни.
- Простая наука. Набор книг, содержащих описание простых и очень занимательных опытов по физике и химии. Великолепные книги для того, чтобы заинтересовать детей наукой.
- И. М. Титова «Химия и искусство. 10-11 классы» (учебное пособие, М.: Вентана-Граф, 2007). Книга для людей, которые хотят получить широкое образование. Очень интересно показано взаимодействие науки и искусства - двух принципиально разных способов познания мира. Прекрасный пример того, как химия проявляет себя в далеких от науки областях.
- В. В. Еремин «Математика в химии» (М.: МЦНМО, 2011). Книга для школьников с физико-математическим складом ума. Рассказывается о том, как математика используется для решения химических задач. Обсуждаются ограничения, накладываемые законами химии на математические уравнения.
Олимпиады и сайты для подготовки
- по всем предметам.
- http://www.chem.msu.ru/rus/olimp/ - информационные материалы об олимпиадах: Московской, Всероссийской, Менделеевской, международной. Приведены задачи теоретических и экспериментальных туров, подробные решения, списки победителей и фотографии.
ещё 4 сайта
- Олимпиада «Ломоносов» по всем предметам. Требует регистрации.
- Материалы Всесибирской открытой олимпиады по химии .
- http://chem.dist.mosolymp.ru/ - система дистанционного обучения, направлена, в первую очередь, для подготовки к олимпиадам всех уровней - от школьных до международной. Содержит огромное количество задач, сгруппированных как по темам, так и по олимпиадам. По всем основным разделам химии приведен теоретический материал и разобраны решения типовых задач. Система бесплатная, но требует минимальной регистрации.
Интернет-ресурсы
- Научно-популярный проект «Элементы большой науки » (физика, химия, математика, астрономия, науки о жизни, науки о Земле). Новости науки, книги, научно-популярные статьи, лекции, энциклопедии.
- Научно-популярный журнала «Потенциал ». Журнал издаётся с 2005 года, раздел «Химия» - с 2011 года. В ней можно найти учебники по общей и неорганической химии, органической химии, мультимедиа-материалы, задачи химических олимпиад с решениями, задачи вступительных экзаменов для абитуриентов, материалы для преподавателей по психологии и педагогике, яркие тематические коллекции видеороликов и интерактивных 3D иллюстраций.
Но это не единственная наука, над популяризацией которой сегодня трудятся разработчики. И, конечно, их внимание не прошло мимо химии – интереснейшей науки о строении веществ, которая обычно вызывает у детей ужас перед непонятными элементами и формулами. Но, кажется, дело, как всегда, в подходе. Возможно, если разнообразить изучение таблицы Менделеева использованием различных игр и познакомить детей с понятием химической валентности с помощью красочного и понятного приложения, то и сам предмет не будет им казаться скучным или недоступным. Так что предлагаем вашему вниманию подборку приложений и игр для изучения химии.
Приложение для знакомства с химическими элементами, о котором однажды английский писатель и актёр Стивен Фрай отозвался следующим образом: «Ради этого приложения стоит купить iPad!». The Elements – это своеобразная база данных основных химических элементов, представленных в виде высококлассных 3D-моделей. Приложение основано на книге «Элементы» Теодора Грея, автора рубрики Gray Matter в журнале Popular Science Magazine , но возможности The Elements выходят далеко за пределы печатного издания.

Для каждого элемента подобран пример, который представлен в виде вращающейся 3D-модели (например, оловянный солдатик – для олова, слиток золота для золота и т.д.), которую можно самостоятельно запускать, переворачивать, увеличивать – в общем, исследовать со всех сторон. Рядом с каждым элементом представлена колонка данных и фактов, детально рассказывающих о его особенностях. Разработчики так характеризуют свой продукт:
The Elements не является приложением-справкой; это богатая и увлекательная история любви к периодической таблице, пересказанная в словах и картинках и позволяющая вам, как никогда ранее, испытать красоту и величество кирпичиков, из которых состоит наша Вселенная.
Многократно признанная одной из лучших программ для изучения химии, The Elements стоит всего лишь $4,99. Приложение можно скачать на iTunes . К сожалению, видео-обзор доступен только на английском, но даже визуального ряда достаточно, чтобы понять, насколько хороша эта программа.
В этом бесплатном приложении вы найдёте трёхмерные модели различных веществ. В Molecules есть несколько режимов визуализации, которые позволяют пользователям вращать модели, изменять масштаб молекулы, увеличивать/уменьшать размер и т.д. Само приложение обладает весьма приличной базой молекулярных моделей, но в то же время у пользователя есть возможность загружать примеры со специализированных сайтов международных хранилищ биологических молекул и их трехмерных моделей. Для этого необходимо в строке поиска ввести название вещества (Water, Gold, Insulin и т.д.). Конечно же, о каждой молекуле и молекулярном соединении здесь представлена исчерпывающая информация: полное название молекулярной структуры (а помните ли вы, что чаще всего вещества называются сокращённо, а полное название обычно известно только специалистам?), количество и виды аминокислот в случае белков, нуклеотидные последовательности для ДНК и РНК, имена исследователей соединения и многое другое. Приложение доступно на iTunes .

Созданное профессором химии из Мичигана, это приложение помогает понять пользователям принцип соединения молекул. Геймплей состоит из пяти уровней, на каждом из которых игроку необходимо составлять 2D-точечные структуры Льюиса . Тот, кто справился с заданием, будет вознаграждён превращением 2D-структуры в 3D-модель. Кроме того, в конце каждого уровня приложение выдаст вам философский риторический вопрос об устройстве Вселенной и её веществ, так что даже если не удастся постигнуть валентность, философия химии станет вам немного ближе. Скачать Chemical Valence можно в в App Store за $0,99.

Это своеобразная виртуальная химическая лаборатория в вашем мобильном устройстве. Здесь можно проводить опыты с различными веществами и наблюдать самые неожиданные реакции. Как вы понимаете, в виртуальном пространстве можно экспериментировать даже со взрывчатыми и радиоактивными веществами. Результаты опытов моделируются в реальном времени, при этом программа учитывает кучу параметров: состав воздуха, температуру окружающей среды, массу и объёмы смешиваемых веществ и т.д. Чтобы облегчить задачу начинающему химику, в приложении доступна база основных реакций по каждому веществу из таблицы Менделеева. Впрочем, можно «химичить» и открывать свои собственные реакции. Лаборатория Chemist доступна на iTunes , её цена - $4,99. Но есть и бесплатная ознакомительная версия.
Думаете, ещё одна химическая лаборатория? Не угадали! Chem Lab – это забавный тест, который проверит ваше знание базовых химических формул. Пользователю предлагается выполнить поочерёдно 5 заданий (перетянуть в пробирку нужные элементы для получения газа или соединить подходящие вещества и т.д.). В конце экспериментов показываются требуемые результаты по каждому заданию и сравниваются с вашими достижениями. Будьте осторожны – при неудачной реакции может что-нибудь взорваться или загореться. Конечно, работа в приложении безопасна, но взрыв как минимум говорит о том, что в реальности не стоит повторять подобный опыт. Приложение есть в App Store и стоит всего лишь $0,99.

Talking Ben the Dog – игра для самых маленьких. Говорящий пёс Бен – профессор химии на пенсии, который порядком подустал от жизни. Всё, что он делает – ест, пьёт и читает газеты. Можно пытаться расшевелить его, а можно просто нажать на кнопочку «Химия» и отправить старого профессора в лабораторию, чтобы проводить с ним простейшие химические опыты (смешать две жидкости и наблюдать за реакцией). Ничего особо познавательного, зато ребёнок как минимум узнает, что смешивание двух веществ может привести к неожиданной реакции. Кажется, неплохое начало для рассказа ребёнку о химии как науке. Приложение бесплатно доступно в iTunes и в Google Play .

Ещё один инструмент для изучения химии, который позволяет знакомиться с активностью элементов, изучать окислительно-восстановительные реакции, решать задачи по химии, получать конечные продукты реакции и уравнивать коэффициенты. В приложении есть описание реакций более полутора тысяч химических соединений. Интерфейс приложения предельно прост, впрочем, как и работа в нём: для реакции достаточно выбрать из таблицы необходимые элементы и соединить их. Приложение можно скачать в Google Play бесплатно.

Приложение-игра для изучения химии. Теперь не нужно заставлять вашего ребёнка зубрить химические элементы, достаточно установить ему Elements Quiz , где таблица Менделеева изучается в простой игровой форме. Основные правила игры – искать в таблице предлагаемые программой химические элементы. Что может быть проще? Зато ребёнок в процессе такого поиска постепенно запоминает название элемента, его символ и место в таблице – те основы, которые необходимы для дальнейшего успешного изучения предмета. Для более продвинутых пользователей в приложение встроены викторины, с которыми не так-то легко справиться. Кроме того, приложение связано с Википедией, так что всегда можно получить дополнительную информацию о том или ином элементе в бесплатной энциклопедии.

Это приложение, которое позволяет без лишнего труда рисовать формулы органических соединений. Но, как отмечают пользователи, в программе невозможно описывать и изображать полноценные реакции, так что MolPrime+ можно пока использовать только в качестве редактора формул. Кстати, своими достижениями в приложении легко делиться с друзьями через твиттер и электронную почту, так что можно соревноваться в мастерстве. MolPrime+ легко скачать с
Федеральное агентство по образованию
УГТУ - УПИ
Кафедра «Теория металлургических процессов»
Л.А. Жукова, А.А. Жуков
ФИЗИЧЕСКАЯ ХИМИЯ
Учебное электронное текстовое издание Подготовлено кафедрой «Теория металлургических процессов»
Конспект лекций по дисциплине «Физическая химия» для студентов направлений 150100 – Металлургия, 150600 – Материаловедение и технологии материалов
Екатеринбург
Раздел 1. Введение и основные термины…………… |
…………….………………………… |
|||||
Лекция 1………………… |
…………………………… |
…………………………… |
||||
Раздел 2. Применение первого закона термодинамики к расчету тепловых эффектов |
||||||
процессов……………………………… |
……………………………………………………… |
|||||
Лекция 2……………………………… |
…………………………………………………… |
|||||
Раздел 3. Применение второго закона термодинамики к определению направления процессов |
||||||
и условий равновесия…………………………………………………………………………………… |
||||||
Лекция 3…………………… |
…………………………………………………………… |
|||||
Лекция 4………… |
………………………………………………………………………… |
|||||
Лекция 5…… |
……………………………………………………………………………… |
|||||
Раздел 4. Термодинамика растворов…………… |
……………………………………………….44 |
|||||
Лекция 6…………………………………………………………………………………… |
||||||
Лекция 7……… |
…………………………………………………………………………… |
|||||
Лекция 8…… |
…………………………………………………………………………… |
|||||
Раздел 5. Фазовые равновесия и диаграммы состояния……… |
…………………………..……59 |
|||||
Лекция 9……………………………………………………… |
…………………………… |
|||||
Лекция 10………………………………………………………………………………… |
||||||
Лекция 11…………………………………………………………………………………… |
||||||
Лекция 12………………………………………………………………………………… |
||||||
Раздел 6. Поверхностные явления……………………………………………………………… |
||||||
Лекция 13………………………………………………………………………………… |
||||||
Лекция 14………………………………………………………………………………… |
||||||
Раздел 7. Кинетика гомогенных химических реакций………………… |
...………………… |
|||||
Лекция 15…………………………………………………………………………… |
||||||
Раздел 8. Кинетика гетерогенных химических реакций……………………………………… |
||||||
Лекция 16…………………………………………… |
………………………………… |
|||||
Лекция 17……………………………………………………………………………… |
||||||
Раздел 9. Строение и свойства жидких и аморфных металлов……………………………….147 |
||||||
Лекция 18………………………………………………………………………………… |
||||||
Раздел 1. Введение и основные термины
Из самого названия дисциплины следует, что она является пограничной наукой между химией и физикой. Основная задача физической химии – изучение взаимосвязи разнообразных физических и химических явлений. Поскольку всякое реальное явление сложно, выделение в нем отдельных сторон – физической или химической – достаточно условно. Поэтому порой бывает трудно провести границу между вопросами, изучаемыми физической химией, и отдельными разделами физики и химии. Как наука физическая химия начала складываться во второй половине XIX-го столетия, хотя название и общее определение содержания физической химии впервые дано М.В. Ломоносовым (1752 г.): «Физическая химия – наука, которая должна на основании положений и опытов физических объяснить причину того, что происходит через химические операции в сложных телах».
Физическая химия занимается многосторонним исследованием химических процессов
и сопутствующих им физических явлений, используя теоретические и экспериментальные методы обеих наук, а также свои собственные. Это дает возможность предсказывать ход химического процесса и его результат, и, следовательно, управлять им с целью получения оптимального результата. Область приложения физической химии охватывает все вопросы химических и фазовых превращений, влияния физических параметров на химические процессы, химического состава – на физические свойства. На основании многостороннего исследования различных свойств веществ и характеристик разнообразных процессов с их участием физическая химия решает две важнейшие задачи – устанавливает возможность протекания процесса и его скорость, определяет факторы, позволяющие управлять им.
Металлургия издавна опирается на достижения физической химии, позволившей разработать теорию процессов, протекающих в металлургических агрегатах. Обосновывая возможность различных процессов в заданных условиях, научный подход позволяет выявить условия наиболее полного их протекания, рассчитать скорости этих процессов, учесть количество поглощаемого или выделяемого при их протекании тепла и в результате оптимизировать технологические режимы получения высококачественного металла.
Производство металлов и сплавов – сложный и многостадийный процесс, на каждом этапе которого, включая жидкое состояние, формируются необходимая структура и требуемые свойства будущего конструкционного материала. Методы физической химии используются при обосновании химического состава сплава с заданными свойствами и определении путей его получения, оптимизации процессов, протекающих при его кристаллизации, определении скорости охлаждения слитка, способствующей формированию заданного фазового состава и структуры и при анализе многих других процессов в металлургии. Таким образом, физическая химия – это теоретическая основа получения металлов, сплавов и других материалов с заданными свойствами.
В настоящее время физическая химия представляет собой самостоятельную дисциплину с собственными методами исследования и является теоретической базой ряда прикладных дисциплин.
Физическая химия играет ведущую роль в формировании научного мировоззрения специалиста-металлурга, позволяя с самых общих позиций анализировать и прогнозировать течение процессов получения и обработки металлов и сплавов.
Целью изучения физической химии является ознакомление студентов с основными закономерностями этой научной дисциплины и их следствиями, некоторыми теоретическими
и экспериментальными методами исследования параметров равновесного состояния систем и кинетики протекающих процессов, выработка умений и навыков физико-химического анализа, необходимых для углубленного изучения металлургических процессов и технологий в специальных курсах.
Многообразие изучаемых физической химией явлений привело к выделению внутри
нее ряда разделов, из которых к основным можно отнести следующие.
Химическая термодинамика занимается рассмотрением энергетических балансов, вопросами химических и фазовых равновесий, а также выяснением направления протекания процессов в системах, где отсутствует равновесие.
Строение вещества включает изучение строения атомов, молекул и их взаимодействие в различных агрегатных состояниях вещества.
Теория растворов ставит целью объяснение и предсказание свойств растворов и их компонентов по свойствам чистых веществ, из которых составлен раствор.
Химическая кинетика изучает скорость и механизм химических реакций, их зависимость от условий протекания.
Поверхностные явления рассматривают специфические свойств поверхностных слоев жидкостей и твердых тел и их влияние на характеристики системы в целом.
Электрохимия изучает химические процессы, в которых участвуют заряженные частицы – ионы.
Между перечисленными разделами нет четких границ. При изучении любого явления приходится использовать представления из различных разделов.
Исследования в области физической химии опираются на три основных метода, каждому из которых отвечает свой круг понятий, законов и экспериментальных способов исследования.
Методы физической химии
Термодинамический метод . Все полученные с его помощью понятия и законы формулируются как результат описания опыта, без проникновения в молекулярный механизм процессов. В силу этого данный метод формален, что несколько ограничивает область его применения. Однако это же и облегчает практические расчеты.
Статистический метод. В основу положено рассмотрение тел как больших ансамблей частиц, что позволяет обосновать понятия и законы термодинамики и расширить круг описываемых явлений. Этот метод связывает макроскопические свойства веществ с микроскопическими свойствами молекул.
Молекулярно-кинетический метод. Позволяет описать свойства веществ и характеристики процессов с их участием, в том числе скорость, на основе законов движения и взаимодействия составляющих эти вещества частиц.
Природа изучаемых физической химией явлений сложна, поэтому их теоретическое описание, несмотря на неуклонное совершенствование теоретических и экспериментальных методик исследования, нельзя считать исчерпывающим. Всестороннее осмысление сути явлений идет по пути создания модельных представлений с постепенным их усложнением и детализацией по мере накопления новых экспериментальных фактов. Любая модель – это более или менее упрощенный, заведомо идеализированный образ реальности. Наиболее известными простейшими абстракциями, широко используемыми в физической химии, являются модели идеального газа, идеального кристалла, идеального раствора и др. Математические выражения, описывающие явления и процессы на основе простейших моделей, не содержат трудно определяемых величин, что упрощает вычисления. Как правило, расчеты на их основе не дают удовлетворительного согласия с экспериментально измеренными значениями свойств реальных систем. Однако даже такое сопоставление полезно. Оно позволяет по характеру и величине отклонений теоретических предсказаний от экспериментальных данных выявить неучтенные в идеализированной модели особенности реального объекта и ввести дополнительные параметры в более совершенные варианты модельной теории.
Основные понятия и определения
Базовым разделом физической химии является химическая термодинамика. Вводимый в ее рамках понятийный аппарат используется и в других разделах физической химии
Термодинамическая система – это тело или совокупность тел, выделенная из окружающего пространства посредством воображаемой или реальной границы раздела. Масса термодинамической системы неизменна, и взаимодействие ее с окружающей средой осуществляется только посредством обмена энергией в виде теплоты и работы. В случае обмена системы со средой веществом, она называется открытой. Мы будем рассматривать только такие термодинамические системы, которые обмениваются с окружающей средой энергией, но не обменивающиеся веществом (закрытые), называя их просто «система».
Энергия – это характеристика движения материи, как с количественной, так и с качественной стороны, т.е. мера этого движения. Любая система обладает энергией, причем формы ее многообразны, как и формы движения материи.
Система называется замкнутой , или изолированной , если она не обменивается энергией с окружающей средой ни в форме теплоты, ни в форме работы. Если обмен энергией происходит только в форме работы, то систему называют адиабатически замкнутой . Система называется гомогенной , если каждое ее свойство имеет в различных частях системы одно и то же значение или непрерывно изменяется от точки к точке. Система гетерогенна , если она состоит из нескольких частей, отделенных друг от друга физическими границами раздела, при переходе через которые свойства и структура могут изменяться скачком. Гомогенная часть системы, отделенная от остальных частей физической границей раздела, называется фазой . Примером гетерогенной системы может служить жидкость с паром над ней, находящиеся в закрытом сосуде. Эта система состоит их двух частей (фаз), при переходе через границу между которыми скачком изменяется, например, плотность.
Совокупность всех физических и химических свойств системы характеризует ее состояние . Изменение каких-либо свойств приводит к изменению ее состояния. При этом не все свойства системы являются независимыми. Некоторые из них можно выразить через другие. Например, состояние идеального газа можно задать тремя его свойствами: температурой T , объемом V и давлением P . Достаточно выбрать два из них, чтобы определить третий из известного уравнения состояния идеального газа – уравнения Менделеева-Клапейрона:
где R – универсальная газовая постоянная (R = 8,314 Дж/(моль× К)), n – количество молей газа.
Однако для большинства реальных систем общие уравнения состояния f(P,V,T) = 0 неизвестны, либо слишком сложны и недостаточно точны, что вынуждает использовать частные взаимосвязи отдельных свойств при постоянстве других.
Обычно за независимые переменные принимают те, значения которых в заданных условиях легче определить и изменить. Очень часто таковыми является температура и давление. В многокомпонентных системах к ним добавляются концентрации компонентов.
Различают свойства экстенсивные , т.е. зависящие от количества вещества, или массы системы (например, объем), и интенсивные , не зависящие от массы (например, температура). Многие интенсивные свойства легко получаются из экстенсивных. Так, мольный (или молярный) объем V m , являющийся интенсивным свойством, может быть получен делением общего объема системы (экстенсивное свойство) на число молей составляющих ее веществ. Плотность – масса единицы объема вещества – также интенсивное свойство. В термодинамике в основном оперируют мольными свойствами, т.к. их величины в состоянии равновесия одинаковы для всей системы и для любой ее части.
Независимые интенсивными свойства системы называют параметрами состояния . Другие свойства рассматривают как функции этих параметров.
Значение любого свойства системы не зависит от тех состояний, в которых она находилась ранее, т.е. не зависит от термодинамического пути, по которому система пришла в данное состояние. Всякое изменение, происходящее в системе, и связанное с изменением ее свойств, называется процессом . Таким образом, изменение свойства не зависит от пути процесса, а определяется только начальным и конечным состояниями системы. В
дальнейшем будем использовать для отображения конечного изменения свойства греческую букву (например, V ), а для бесконечно малого изменения этого свойства – латинские буквы d или (в частных производных).
Процесс, в котором система, выйдя из начального состояния и претерпев ряд изменений, возвращается в него, называется круговым . Очевидно, что изменения свойств системы в круговом процессе равны нулю. Процессы, происходящие при постоянной температуре (Т = const ), называются изотермическими , при постоянном давлении (P = const ) – изобарными, или изобарическими, при постоянном объеме системы (V = const ) –
изохорными, или изохорическими . Процессы, в ходе которых обмен энергией между системой и окружающей средой происходит только в форме работы, называют
адиабатическими.
Состояние системы, в котором все ее параметры в любой точке приняли постоянные значения и не изменяются во времени, называется равновесным . Процесс, при котором система проходит ряд равновесных состояний, называется равновесным процессом . Им может быть только бесконечно медленный процесс. Понятие «равновесный» в данном случае совпадает с понятием «обратимый». Обратимым называется такой термодинамический процесс, который допускает возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Любой равновесный процесс является обратимым и, наоборот, в ходе обратимого процесса система проходит через ряд равновесных состояний. После протекания необратимого процесса система не может самостоятельно, т.е. без внешнего воздействия, вернуться в исходное состояние. Все реальные, самопроизвольно протекающие, процессы необратимы и могут лишь в той или иной степени приближаться к понятию обратимого процесса.
Как отмечалось выше, термодинамическая система может обмениваться с окружающей средой энергией в двух формах: работы (макрофизическая форма) и теплоты (микрофизическая форма).
Работой называется количественная мера такого вида передачи движения (энергии), которая осуществляется путем перемещения конечных масс, т.е. системы в целом или ее частей под действием каких-либо сил.
Наиболее часто используемыми единицами измерения энергии и работы, в частности, в термодинамике являются джоуль (Дж) в системе СИ и внесистемная единица – калория (1
кал = 4,18 Дж).
В качестве примера процесса, сопровождающегося совершением работы, рассмотрим расширение газа, находящегося в цилиндре под поршнем, на который действует давление Р (рисунок 1).
Если газ под поршнем (движущимся без трения) расширяется от состояния с объемом V 1 до состояния с объемом V 2 , он совершает работу А против внешнего давления. Сила F , с которой газ действует на поршень
F = PS,
где S – площадь сечения цилиндра. Бесконечно малая работа δA, совершаемая при подъеме
Рисунок 1 – Совершение работы газом, находящимся под давлением, в процессе расширения
поршня на высоту dh , составляет
δ A = F dh = PS dh,
δ A = P dV.
Для конечного изменения объема газа, проинтегрировав полученное уравнение, получим:
A = ∫ PdV .
Рассмотренный пример можно проиллюстрировать графически для двух различных путей (a и b ) перехода системы из состояния 1 в состояние 2 (рисунок 2).
Рисунок 2 – Различие величины работы, совершаемой газом, расширяющимся от объема V 1 до объема V 2 , в процессах, протекающих по пути a и по пути b

Поскольку работа численно равна площади под кривой, являющейся графиком подынтегральной функции (P ), очевидно, что A a A b , хотя начальное и конечное состояния системы в обоих случаях, а также изменения свойств (P и V ), одни и те же.
Следовательно, работа зависит от пути процесса, а значит, не является свойством системы. Работа есть характеристика процесса. Поэтому в отличие от изменений свойств (, d и ) для работы и ее бесконечно малого количества приняты обозначения A и δ A соответственно.
Если газ расширяется при неизменном внешнем давлении (P = const ), то, как показано на рисунке 3, работа вычисляется умножением давления на изменение объема в результате перехода системы из начального состояния в конечное.
3 – Работа расширения газа в |
||
изобарическом процессе |
A = P(V2 – V1 )
Теплотой называется количественная мера такого вида передачи движения (энергии), которая осуществляется путем хаотического столкновения молекул двух соприкасающихся тел.
Теплота, как и работа, не является свойством системы, а есть характеристика процесса, и зависит от его пути. Поэтому нельзя говорить о запасе теплоты в системе. Обозначение теплоты – Q или для бесконечно малого ее количества – δ Q . Система может, как поглощать, так и выделять теплоту в связи с протеканием в ней процессов. Поглощение теплоты, условно считающейся при этом положительной (Q > 0), происходит в эндотермических процессах. Выделение системой теплоты, учитываемой со знаком «минус» (Q < 0), связано с протеканием экзотермических процессов (рисунок 4). Работа, совершаемая системой, рассматривается как положительная (A > 0). Работа, совершаемая над системой под действием внешних сил, считается отрицательной (A < 0).
A < 0 |
Термодинамическ
Q > 0 |
|
Эндо термические |
Экзо термические |
процессы |
процессы |
Рисунок 4 – Правило знаков, принятое в термодинамике для теплоты и работы
В качестве одной из важнейших величин в термодинамике рассматривается внутренняя энергия (U ) системы, являющаяся ее свойством. Она характеризует запас энергии системы, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов, энергию движения электронов, внутриядерную энергию. Во внутреннюю энергию не входят кинетическая энергия движения системы в целом и потенциальная энергия ее положения.
Внутренняя энергия является функцией температуры и объема системы. Зависимость
U от температуры обусловлена зависимостью от нее кинетической энергии движения молекул. Влияние объема, занимаемого системой, на величину внутренней энергии связано с тем, что потенциальная энергия взаимодействия молекул зависит от расстояний между ними.
Абсолютное значение внутренней энергии системы в настоящее время не может быть рассчитано или измерено, поскольку отсутствуют сведения о величине внутриядерной энергии. Однако можно рассчитывать изменения внутренней энергии в различных процессах:
U = U2 – U1 .
Раздел 2. Применение первого закона термодинамики к расчету тепловых эффектов процессов
Первый закон термодинамики
Этот закон – частный случай общего закона сохранения энергии применительно к термическим явлениям. Он не доказывается теоретически, а является результатом обобщения опытных фактов. Справедливость его подтверждается тем, что ни одно из следствий закона не противоречит опыту. Формулируется он следующим образом.
Первый закон : в любом процессе увеличение внутренней энергии системы равно количеству сообщенной системе теплоты за вычетом количества работы, совершенной системой.
Математической записью первого закона термодинамики служит выражение
если совершаемая системой работа связана только с ее расширением. В общем же случае, когда работа может производиться не только против внешнего давления, но также против электрических, магнитных и других сил, следует записать
du = δ Q – PdV – δ A′ ,
где величину δA ′ называют «полезной» работой. Будем далее учитывать δA ′ только там, где это необходимо.
Примеры применения первого закона к различным процессам
1 Круговой процесс (U = const ) . Очевидно, что в результате такого процесса dU = 0, значит, δQ = δA, или Q = A. В круговом процессе вся работа совершается системой за счет подведения к ней теплоты.
2 Изотермический процесс (T = const ). Для упрощения вывода рассмотрим применение уравнения dU = δQ T – PdV к процессу, протекающему в идеальном газе. В этом случае внутренняя энергия системы не зависит от объема, поэтому U = f (T ). При постоянстве температуры dU = 0. Следовательно, все подводимое к системе тепло, расходуется на совершение ею работы:
δ Q = δ A = PdV.
Вся работа с учетом уравнения состояния идеального газа PV = nRT равна
A = V 2 |
PdV = V 2 |
dV = nRT ln |
|||||
Изохорический процесс (V = const ). Поскольку dV = 0, то |
|||||||
dU = δ QV – |
δ A = δ QV – PdV = δ QV , |
||||||
или dU = δ QV . |
|||||||
Вся теплота, подводимая к системе, идет на увеличение внутренней энергии: Q V = U . |
|||||||
Адиабатический процесс (δ Q = 0). Уравнение dU = δQ – δA преобразуется к виду dU = |
|||||||
δA, или δA = – dU . Система совершает работу за счет убыли своей внутренней энергии. |
|||||||
Изобарический процесс (P = const ). Представим уравнение первого закона dU = δQ P – PdV |
|||||||
δ QP = dU + PdV, |
|||||||
где, используя свойства дифференциала, проведем следующие преобразования:
δ QP = dU + d(PV) = d(U + PV).
Величину в скобках U + PV обозначают буквой H и называют энтальпией системы. Тогда
δ QP = dH; Q = H = H2 – H1 .
Таким образом, теплота, получаемая системой в изобарическом процессе, расходуется на приращение энтальпии. Энтальпия является свойством, или функцией состояния системы, и ее изменение не зависит от пути процесса, т.к. изменения всех трех величин U , P и V определяются только начальным и конечным состояниями системы. Абсолютная величина энтальпии, как и внутренней энергии, не может быть определена. На основе экспериментальных данных определяют лишь изменения энтальпии Н рассматриваемого вещества при изменении внешних условий или Н рассматриваемой системы при протекании в ней процесса.
Мы видим, что в двух частных случаях, а именно при V = const и P = const , теплота, получаемая системой, идет на увеличение величин функций состояния, соответственно U
 Научно-исследовательский институт кораблестроения и вооружения вмф
Научно-исследовательский институт кораблестроения и вооружения вмф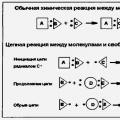 Благотворная роль активных форм кислорода
Благотворная роль активных форм кислорода Приглашаем к участию! Физическая химия. Конспект лекций
Приглашаем к участию! Физическая химия. Конспект лекций