Номенклатура стереохимическая. Систематическая номенклатура органических соединений, Systematic Nomenclature of Organic Chemistry: A Directory to Comprehension and Application of its Basic Principles
И В. Прелогом в 1966 году .
Правила Кана - Ингольда - Прелога отличаются от других химических номенклатур, поскольку ориентированы на решение специфической задачи - описание абсолютной конфигурации стереоизомеров.
Энциклопедичный YouTube
1 / 3
Номенклатура энантиомеров по системе Кана-Ингольда-Прелога
Название по R/S-номенклатуре (системе Кана-Ингольда-Прелога), пример 2
Конформации циклогексана
Субтитры
Теперь, опираясь на уже полученные знания, если мы хотим дать название этой молекуле, сначала нужно найти самую длинную углеродную цепь. У нас есть двухуглеродная цепь, и все связи одинарные, поэтому мы имеем дело с этаном. Давайте потом запишем всё вместе. С одним из углеродов у нас есть, (давайте обозначим его как 1-ый углерод, а это будет 2-ой углерод), у нас есть бром и фтор. Поэтому мы можем назвать его 1-бром, и мы пишем бром перед фтором потому что «б» идёт перед «ф» в алфавитном порядке. 1-бром-1-фтор, и теперь мы имеем дело с этаном. У нас есть двухуглеродная цепь с одинарными связями - фторэтан. Это название молекулы. Я просто хотел повторить материал предыдущих видео, в которых мы разбирали органическую номенклатуру. Теперь мы уже знаем, основываясь на нескольких предыдущих видео, что это также хиральный углерод, и если мы сделаем его зеркальное отражение, у нас получится энантиомер для этой молекулы, и они будут энантиомерами друг для друга. Итак, как выглядит зеркальное отражение для 1-бром-1-фторэтан? Вот здесь у нас будет углерод. Давайте будем рисовать теми же цветами. Наверху у нас по-прежнему будет бром. Метильная группа, которая прикрепляется к углероду, теперь будет с левой стороны, CH3. Фтор, как и прежде, будет позади углерода, а водород будет по-прежнему как бы торчать из рисунка, но теперь в правую сторону. Это водород. Как мы помним, мы назвали это 1-бром-1-фторэтан, и эту молекулу мы также назовём 1-бром 1-фторэтан, но это две в корне разные молекулы. Несмотря на то, что они состоят из одинаковых молекул; у них одинаковая молекулярная формула; одинаковое устройство, то есть этот углерод соединён с водородом, фтором и бромом; и этот углерод соединён с теми же элементами; этот углерод соединён с углеродом и тремя водородами; также как и этот; оба они стереоизомеры. Это стереоизомеры, и они являются зеркальным отражением друг друга, поэтому они ещё и энантиомеры. На самом деле они, во-первых, по-разному поляризуют свет, и у них совершенно разные химические свойства, как в химической, так и в биологической системе. Поэтому не очень хорошо, что мы даём одинаковые названия для них. в этом виде мы сосредоточимся на том как их различать. Итак, как мы обозначаем различия между ними? Система наименования, которую мы будем использовать здесь называется правилом Кана-Ингольда-Прелога, но это другой Кан, это не я. Он пишется как Кан, а не Хан. Правило Кана-Ингольда-Прелога это способ провести различие между этим энантиомером, который мы сейчас называем 1-бром-1-фторэтан, и вот этим энантиомером, 1-бром-1-фторэтан. Это довольно просто. Самая сложная часть - это представить вращение молекулы в нужную сторону и выяснить, является ли эта молекула левосторонней или правосторонней. Сейчас мы разберёмся в этом шаг за шагом. Первое, что мы делаем, согласно правилу Кана-Ингольда-Прелога, это выявляем хиральную молекулу. Здесь это довольно очевидно. Вот здесь у нас углерод. Фокусируемся на левой картинке, с которой мы начали. Он соединён с 3 разными группами. Теперь нам нужно распределить группы по атомному числу. Если мы посмотрим сюда, то из брома, водорода, фтора и углерода, который напрямую связан с этим углеродом, какое самое большое атомное число? Вот бром - давайте отметим более тёмным цветом. Число брома - 35, у фтора - 9, у углерода - 6, и, наконец, у водорода - 1. То есть среди них, самое больше число у брома. Присвоим ему № 1. После него идёт фтор. Это № 2. № 3 это углерод. И самое маленькое число у водорода, поэтому он будет под № 4. Теперь мы пронумеровали их, и следующий шаг- это расположить молекулу так, чтобы группа с наименьшим атомным числом оказалась за изображением. Расположить её позади молекулы. Сейчас самое наименьшее число у водорода. У брома наибольшее, у водорода наименьшее, поэтому нам нужно расположить его позади молекулы. На рисунке сейчас он расположен перед ней. А нам нужно расположить его позади молекулы, и это самая сложная часть - правильно представить это себе. Мы помним, что фтор находится сзади; это правая сторона изображения; эта часть выступает перед изображением. Нам нужно сделать вращение. Вы можете представить, что мы вращаем молекулу в этом направлении и… (давайте нарисуем заново). Здесь у нас будет углерод. И раз это направление вращения, мы повернули его примерно на 1/3 вокруг себя, Это около 120 градусов. Теперь водород находится на месте фтора. Вот здесь находится водород. Фтор теперь находится на месте этой метильной группы. Вот фтор. Пунктир показывает то, что сзади. А это- спереди. И метильная группа теперь вместо водорода. Она теперь выступает перед изображением. Она будет слева и снаружи. Вот метильная группа, выступающая перед изображением, снаружи и слева. Вот здесь будет наша метильная группа. Всё, что мы сделали - просто повернули изображение на 120 градусов. Мы заставили это уйти назад, а это первый шаг после того, как мы выявили хиральный углерод и распределили элементы по их атомному числу. Конечно же, бром будет по-прежнему наверху. Теперь, когда мы поместили молекулу с наименьшим атомным числом назад, давайте попробуем взглянуть на распределение остальных 3. У нас есть 4 молекулы. Мы смотрим на наибольшую, Это бром, № 1. № 2 - это фтор,№ 2, и затем № 3 - это метильная группа. У нас есть углерод, соединённый с этим углеродом, вот это у нас № 3. И согласно правилу Кана-Ингольда-Прелога, нам буквально нужно пройтись от № 1 до № 2 и № 3? В данном случае, пойдём в этом направлении. Переходя от № 1 к № 2 и № 3, мы следуем по часовой стрелке. Пока что оставим без внимания водород. Он просто остаётся сзади. Первым шагом было сориентировать его назад как самую маленькую молекулу. И у нас остаются 3 больших, и мы определили направление, в котором нужно двигаться от № 1 к 2 и № 3, не так ли? В данном случае это направление по часовой стрелке. Если мы будем двигаться по часовой стрелке, тогда наша молекула называется правосторонней, или мы можем использовать латинское слово «правый», которое звучит как rectus. Поэтому теперь мы можем назвать эту молекулу не просто 1-бром-1-фторэтан, но добавить R, R - от слова rectus. Можно думать, что это от английского right (правый),но мы увидим, что для левой стороны используется S, от слова sinister, поэтому буква R всё-таки из латыни. И это у нас (R)-1-бром-1-фторэтан Вот он. Можно догадаться, что вот этот должен быть наоборот, он должен вращаться против часовой стрелки. Давайте быстро это сделаем. Идея та же самая. Нам известен самый большой элемент. Это бром № 1. Он самый большой по атомному числу. Фтор это № 2. Углерод это № 3. Водород № 4. Что нам нужно сделать, так это поместить водород назад, поэтому нам придётся повернуть его назад, туда, где сейчас фтор. Если нам придётся перерисовать эту молекулу, то здесь у нас остаётся углерод. Наверху, по-прежнему, будет бром. Но мы собираемся переместить назад водород, поэтому водород теперь там, где был фтор. Вот наш водород. Метильная группа, углерод с 3 водородами, теперь переместится сюда, где раньше был водород. Теперь она будет выступать перед изображением, так как мы повернули её в этом направлении, и вот наша метильная группа здесь. А фтор теперь перемещается туда, где была метильная группа, и вот тут у нас фтор. Теперь, используя правило Кана-Ингольда-Прелога, мы определяем, что это № 1, Это № 2, только по атомному числу, это № 3. Мы идём от № 1 через № 2 к № 3. Вот в этом направлении. Против часовой стрелки. Иначе говоря, мы идём влево, или мы можем использовать латинское слово которое звучит как sinister. Латинское слово sinister в оригинале обозначает «лево». В современном английком слово "sinister" означает - "зловещий". Но ничего общего с латынью это не имеет. Мы будем использовать его просто, как обозначение левого. Итак, у нас левый вариант молекулы. Мы назовём этот вариант, Этот энантиомер 1-бром-1-фторэтан. Обозначим его S, S от слова sinister, то есть левый, или направленный против часовой стрелки: (S)-1-бром-1-фторэтан. Теперь мы можем различать эти названия. Мы знаем, что это две различные конфигурации. И вот что обозначают S и R, и если нам нужно из этого сделать это, то придётся буквально рассоединить и снова соединить разные группы. То есть придётся на самом деле разорвать связи. И на самом деле придётся поменять местами эти группы определённым образом, чтобы из этого энантиомера получить вот этот. Потому что у них различные конфигурации, и в основе своей они - разные молекулы, стереоизомеры,энантиомеры. Любое из этих названий им подходит… Subtitles by the Amara.org community
Определение старшинства
В современной стереохимической номенклатуре ИЮПАК конфигурации двойных связей, стереоцентров, а также других элементов хиральности присваивают, исходя из взаимного расположения заместителей (лигандов) при данных элементах. Правила Кана - Ингольда - Прелога устанавливают старшинство заместителей, согласно следующим взаимоподчинённым положениям .
- Атом с большим атомным номером старше атома с меньшим атомным номером . Сравнение заместителей проводят по атому, который непосредственно связан со стереоцентром или двойной связью. Чем выше атомный номер этого атома, тем заместитель старше. Если первый атом у заместителей одинаков, сравнение проводят по атомам, удалённым от стереоцентра (двойной связи) на расстояние двух связей (т. н. атомам второго слоя). Для этого эти атомы для каждого заместителя выписывают в виде списка в порядке уменьшения атомного номера и сравнивают эти списки построчно. Старшим считается тот заместитель, в пользу которого будет первое различие. Если старшинство заместителей не удаётся определить по атомам второго слоя, сравнение проводят по атомам третьего слоя и т. д. до первого различия.
- Атом с большей атомной массой старше атома с меньшей атомной массой . Данное правило обычно применяется к изотопам, так как их невозможно различить по атомному номеру.
- Секцис -заместители старше сектранс -заместителей . Данное правило применяется к заместителям, содержащим двойные связи либо плоские четырёхкоординированные фрагменты.
- Диастереомерные заместители с подобными (англ. like ) обозначениями старше диастереомерных заместителей с неподобными (англ. unlike ) обозначениями . К первым относятся заместители с обозначениями RR , SS , MM , PP , секциссекцис , сектранссектранс , Rсекцис , Sсектранс , Mсекцис и RM , SP . Ко вторым относятся заместители с обозначениями RS , MP , RP , SM , секциссектранс , Rсектранс , Sсекцис , Pсекцис и Mсектранс .
- Заместитель с обозначением R или М старше заместителя с обозначением S или P .
Правила применяются последовательно друг за другом, если при помощи предыдущего невозможно определить старшинство заместителей. Точные формулировки правил 4 и 5 в настоящее время обсуждаются .
Примеры использования
В R /S -номенклатуре
Присвоение стереоцентру конфигурации R или S проводится на основании взаимного расположения заместителей (лигандов) вокруг стереоцентра. При этом в начале определяют их старшинство по правилам Кана - Ингольда - Прелога, затем трёхмерное изображение молекулы располагают так, чтобы младший заместитель располагался за плоскостью изображения, после чего определяют направление уменьшения старшинства оставшихся заместителей. Если старшинство уменьшается по часовой стрелке, то конфигурацию стереоцентра обозначают R (лат. rectus - правый). В противоположном случае конфигурацию обозначают S (лат. sinister - левый)
В E /Z -номенклатуре
В номенклатуре топных сторон
Основная статья: Топность
Правила Кана - Ингольда - Прелога используются также для обозначения сторон плоских тригональных молекул, например, кетонов . Например, стороны ацетона идентичны, поскольку атака нуклеофила с обеих сторон плоской молекулы приводит к единственному продукту. Если нуклеофил атакует бутанон-2, то стороны бутанона-2 неидентичны (энантиотопны), поскольку при атаке на разные стороны образуются энантиомерные продукты. Если кетон является хиральным, то присоединение к противоположным сторонам приведёт к образованию диастереомерных продуктов, поэтому такие стороны называются диастереотопными.
Для обозначения топных сторон пользуются обозначениями re и si , которые соответственно отражают направление уменьшения старшинства заместителей при тригональном атоме углерода карбонильной группы . Например, на иллюстрации молекула ацетофенона видна с re -стороны.
Примечания
- . Проверено 5 февраля 2013. Архивировано 14 февраля 2013 года.
- Cahn R. S., Ingold C., Prelog V. Specification of Molecular Chirality (англ.) // Angew. Chem. Int. Ed. - 1966. - Vol. 5 , no. 4 . - P. 385–415 . - DOI :10.1002/anie.196603851 .
- Preferred IUPAC Names. Chapter 9 . Проверено 5 февраля 2013.
Изомерия структурная и геометрическая.
Алкенами, этиленовыми углеводородами или олефинами (маслообразующими) называют углеводороды, в состав молекул которых входят как минимум два углеродных атома, соединенные друг с другом двумя связями. Эти атомы находятся в состоянии sp 2 -гибридизации.
Алкены образуют гомологический ряд с общей формулой С n Н 2n.
Первым членом гомологического ряда является этилен имеющий молекулярную формулу С 2 Н 4 и структурную формулу СН 2 =СН 2 . В силу особенности sp 2 -гибридизации молекула этилена имеет плоскостное строение. Наличие π-связи исключает возможность свободного вращения вокруг углерод-углеродной связи. Поэтому связи атомов углерода, затраченные на соединение с другими атомами или группами жестко расположены в одной плоскости под углом 120 0 друг к другу. Жесткое строение системы двойной связи в молекулах алкенов вызывает определенные особенности в их строении.
Строение молекул алкенов предполагает существование трех видов изомерии:
1. Изомерия углеродного скелета в радикалах с числом углеродных атомов больше двух.
2. Изомерия положения двойной связи. Например:
3. Геометрическая или цис –, транс -изомерия
Геометрическими изомерами называются пространственные или стереоизомеры различающиеся положением заместителей относительно двойной связи. В силу отсутствия возможности вращения вокруг двойной связи - заместители могут располагаться либо по одну сторону двойной связи, либо по разные стороны. Например:

Номенклатура, Е, Z-номенклатура.
Для алкенов также действуют три номенклатуры: тривиальная, рациональная и систематическая.
Тривиальные названия:
По рациональной номенклатуре алкан рассматривается как производное этилена. При этом если заместители присоединены к разным углеродным атомам двойной связи, то олефин называют симметричным и обозначают символом «симм- », если заместители присоединены к одному углеродному атому двойной связи, то олефин называют несимметричным и обозначают символом «несимм -». Например:
Названия олефинов по систематической номенклатуре образуют из названия алкана, имеющего аналогичное строение, заменяя суффикс «ан» на «ен». За главную цепь принимают самую длинную цепь, содержащую двойную связь. Нумерацию углеродных атомов начинают с того конца цепи, к которому ближе двойная связь. Например:
Выбрать самую длинную (главную) цепь, содержащую двойную связь;
Определиться со старшинством групп;
Пронумеровать главную цепь, придавая двойной связи наименьший из номеров локантов;
Перечислить префиксы;
Составить полное название соединения.
Например:

При составлении названий радикал –СН=СН называют «винил».
Для обозначения геометрических изомеров применяют две номенклатуры:
цис -, транс - и Е-, Z-
В соответствии с цис -, транс -номенклатурой геометрические изомеры, в которых заместители расположены по одну сторону относительно двойной связи называются с цис -изомерами.
Геометрические изомеры, в которых заместители расположены по разные стороны относительно двойной связи, называются транс -изомерами.
Если в качестве заместителей выступают углеводородные радикалы, то преимущество при определении конфигурации алкена имеют радикалы с более длинной углеродной цепью (конфигурация определяется относительно радикала с большей цепью). Например:

Часто цис -, транс -номенклатура не позволяет однозначно определить геометрические изомеры. Более совершенной в этом отношении является Е-, Z- номенклатура.
Е-Изомеры – это такие геометрические изомеры, в которых старшие заместители у углеродных атомов двойной связи находятся по разные стороны относительно двойной связи (от немецкого слова «entgegen» - напротив).
Z- Изомеры это такие геометрические изомеры, в которых старшие заместители у углеродных атомов двойной связи находятся по одну сторону относительно двойной связи (от немецкого слова «zusamen» - вместе).
Обозначение Е- и Z- ставят перед названием соединения по номенклатуре ИЮПАК и заключают в скобки (обозначение цис - и транс- в скобки не заключается). Например:

Старшинство заместителей определяется атомным номером элемента, атом которого связан с атомом углерода двойной связи, а при одном и том же элементе – атомными номерами элементов, следующих по цепи заместителя. Ряд заместителей в порядке возрастания старшинства:
Способы получения.
Промышленные способы.
1. Первые четыре члена ряда олефинов получают в промышленности крекингом нефтяных дистиллятов.
2. Некоторые олефины, например 1-бутен и 2-бутен, а также пентены нормального и изомерного строения, получают дегидрогенизацией соответствующих предельных углеводородов. Процесс ведут с использованием гетерогенного катализатора на основе триоксида хрома и при температуре до 450 0 С:

Лабораторные способы.
Наиболее распространенными лабораторными способами получения олефинов являются дегидратация спиртов (отщепление воды от спиртов) и дегидрогалогенирование галогенпроизводных алканов (отщепление галогеноводородов от галогеналканов). Обе эти реакции подчиняются правилу Зайцева:
При дегидратации спиртов и дегидрогалогенировании галогеналканов протон отщепляется преимущественно от наименее гидрогенизированного (имеющего меньшее число атомов водорода) атома углерода (1875г.).
Такое направление протекания этих реакций элиминирования объясняют повышенной термодинамической стабильностью образующегося олефина. Чем больше заместителей, тем больше возможностей для сверсопряжения. Тем выше степень делокализации электронов, находящихся на π-связи. Соответственно выше термодинамическая стабильность. Стереоселективность определяется большей устойчивостью транс -изомера.
1. Дегидратация спиртов (элиминирование).
Отщепление воды от спирта проводят в газовой и жидкой фазах. В обоих случаях реакцию проводят при высокой температуре в присутствии водоотнимающего средства. В жидкой фазе используют серную или фосфорную кислоты, а в газовой фазе используют оксид фосфора (V), оксид алюминия, оксид тория или соли алюминия. Например:
Механизм элиминирования в жидкой фазе включает две стадии. На первой образуется эфир из кислоты и спирта и на второй стадии распад эфира приводит к образованию олефина:

2. Дегидрогалогенироване галогеналканов.
Отщепление галогенводородов от галогеналканов проводят с использованием спиртового раствора едкого калия (КОН), реже используют NaОН:
3. Дегалогенироване вицинальных дигалогеналканов.
Олефины получают путем отщепления галогенов от дигалогенпроизводных с атомами галогена у соседних (или вицинальных) углеродных атомов. Элиминирование проводят в спиртовом или уксуснокислом растворе действием цинковой пыли:
4. Гидрирование ацетиленовых углеводородов и алкадиенов.
В некоторых случая по ходу синтеза легче получить ацетиленовый углеводород, чем алкен. Ацетиленовые углеводороды сравнительно легко превращаются в алкены частичным гидрированием. Водород к π-электронной системе без катализатора не присоединяется. В случае получения алкенов из алкинов используют два варианта каталитической реакции: в газовой фазе на катализаторах гидрирования (платина, палладий, никель)отравленных свинцом (PbO) и в жидкой фазе натрием в жидком аммиаке. При этом образуются алкены различной конфигурации:

Гидрирование 1,3-диенов приводит к образованию смеси, изомерных по положению двойной связи, алкенов:
Физические свойства.
При нормальных условиях первые четыре члена гомологического ряда этиленовых углеводородов – газы. Олефины с числом углеродных атомов от 5-ти до 17–ти - жидкости. Далее идут твердые тела.
Олефины с нормальной цепью углеродных атомов кипят при более высокой температуре, чем их изомеры с развевленной цепью. Терминальные олефины (с концевой двойной связью) кипят при более низкой температуре, чем их изомеры с расположением двойной связи внутри цепи. транс -Изомеры плавятся при более высокой температуре, чем цис -изомеры. цис -Изомеры обычно кипят при более высокой температуре, чем транс -изомеры.
Плотность олефинов меньше единицы, но больше, чем плотность соответствующих парафинов. В гомологическом ряду плотность увеличивается.
Растворимость олефинов в воде мала, но выше, чем у парафинов.
Химические свойства.
Главным структурным элементом, определяющим химические свойства олефинов, является двойная связь, включающая одну σ- и одну π-связь. Атомы углерода двойной связи пребывают в состоянии sp 2 -гибридизации. Сравнение статических факторов, в частности длины и энергии связи показывает, что двойная связь короче и прочнее ординарной связи:
Энергия двойной связи 607.1 кДж/моль, что больше энергии ординарной связи – 349,6 кДж/моль. Однако две ординарные связи по энергии превосходят одну двойную связь на 92.1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
Из этого следует, что для олефинов наиболее характерны реакции присоединения. Но некоторым видам олефинов свойственны реакции замещения. Наиболее легко замещается водород у α-углеродного атома по отношению к двойной связи. Так назыываемое аллильное положение. Образующийся, при гомолитическом разрыве связи радикал способен взаимодействовать с электронами π-связи, что обеспечивает его высокую стабильность и соответственно высокую реакционную способность.
Поскольку π-связь представляет собой облако отрицательного заряда расположенное над и под плоскостью молекулы, то олефины должны быть склонны к взаимодействию с частицами, несущими положительный заряд. Реагентами, несущими положительный заряд являются электрофилы.
5.1. Электрофильное присоединение
Электрофильным присоединением (Аd Е) называют реакции присоединения, в которых в скоростьлимитирующей стадии атакующей частицей является электрофил.
Механизм электрофильного присоединения включает три стадии.
Например, присоединение бромистого водорода к этилену с образованием бромистого этила в среде четыреххлористого углерода:

Механизм:
1. На первой стадии образуется так называемый π-комплекс:

Особенностью π-комплекса является то, что атомы углерода двойной связи находятся в состоянии sp 2 -гибридизации.
2. Образование промежуточного карбкатиона. Эта стадия является медленной (скоростьлимитирующей):

На этой стадии один из атомов углерода двойной связи переходит в состояние sp 3 -гибридизации. Другой остается в состоянии sp 2 -гибридизации и приобретает вакантную р-орбиталь.
3. На третьей стадии бромид-ион, образовавшийся на второй стадии, быстро присоединяется к карбкатиону:
Аналогичный механизм можно привести для реакции электрофильного присоединения брома к этилену с образованием 1,2-дибромэтана в среде четыреххлористого углерода.
1. Образование π-комплекса:

2. Образование циклического бромониевого иона:

Циклический бромониевый ион более стабилен, чем открытый этил-катион. Причина такой стабильности в том, что в циклическом бромониевом ионе все атомы имеют по восемь электронов на внешнем электронном уровне. В то время как в этил-катионе у атома углерода, несущего положительный заряд имеется только шесть электронов. Образование бромониевого иона связано с гетеролитическим разрывом связи Br- Br и отщеплением бромид-иона.
3. Присоединение бромид-иона к циклическому бромониевому иону:

Поскольку одна сторона исходного алкена экранирована в бромониевом ионе положительно заряженным атомом брома, то бромид-ион может атаковать бромониевый ион только с противоположной стороны. При этом трехчленный цикл раскрывается, а бромид-ион образует ковалентную связь с атомом углерода. Продуктом присоединения является вицинальный дибромид.
Доказательством представленного механизма, предусматривающего атаку бромониевого иона бромид-ионом с тыльной стороны, является образование транс -1,2-дибромциклогексана по реакции циклогексена с бромом:

Правило Марковникова.
Взаимодействие галогеноводородов с несимметричными алкенам по механизму электрофильного присоединения приводит к образованию продуктов строго определенного строения. Так по реакции 2-метил-2-бутена с бромистым водородом преимущественно образуется 2-бром-2-метилбутан:
Строение, образующегося продукта в случае реакции электрофильного присоединения к несимметричным алкенам подчиняется правилу Марковникова:
При присоединении галогенводорода к несимметричному алкену протон реагента преимущественно присоединяется к наиболее гидрогенизированному (имеющему большее число атомов водорода) атому углерода (1869г.).
Объяснение данному направлению хода реакции заключается в том, что образующиеся на второй стадии механизма электрофильного присоединения карбкатионы формируют ряд стабильности, аналогичный ряду стабильности радикалов:
Метил-катион <первичный <вторичный <третичный.
В соответствии с рядом стабильности продукт присоединения галогенид-иона к третичному углеродному атому будет более предпочтительным, чем присоединение ко вторичному.
По механизму электрофильного присоединения в соответствии с правилом Марковникова к олефинам присоединяются:
галогеноводороды; галогены, вода, гипогалогенитные кислоты:

В случае присоединения гипогалогенитных кислот в роли электрофильной частицы выступает ион галоида (кроме фтора), поскольку электроотрицательность хлора, брома и йода меньше, чем у кислорода.
Радикальные реакции.
Радикальное присоединение.
Присоединение галогенов к двойной связи может протекать как по ионному (атака электрофильной частицей), так и по радикальному механизму.
При радикальном присоединении атомы галогенов,образующиеся в результате распада молекул под действием квантов света, присоединяются к наиболее доступному из атомов углерода с образованием наиболее стабильного из возможных радикалов:
Легче образуется и более стабилен радикал (1). В этом радикале неспаренный электрон сопряжен с пять связями С-Н. Для радикала (2) возможно сопряжение только с одной связью С-Н. Первичный углеродный атом более доступен атакующей частице, чем вторичный. Радикал (1) далее реагирует с молекулой галогена с образованием продукта и генерацией нового радикала брома, что обеспечивает рост цепи радикального механизма:
В представленном механизме атакующей частицей является радикал брома. Если радикалы брома генерировать в условиях присоединения галогенводородов, то на первой стадии также будет происходить атака бромом, поскольку радикал брома более устойчив, чем радикал водорода. На этом принципе основано присоединение бромистого водорода к несимметричным алкенам по Карашу – против правила Марковникова. Стадия зарождения цепи в этом случае обеспечивается введением перекисей, что при записи уравнения реакции обозначается символом «ROOR» над стрелкой (формула четырехлористого углерода означает, что реакция протекает по ионному механизму, в соответствии с правилом Марковникова):
Объяснение этому факту дает механизм реакции. Поскольку пероксид легко распадается на два оксидных радикала, что составляет стадию зарождения цепи, то дальнейший рост цепи связан с образованием радикала (или атома) брома:
На следующей стадии радикал брома присоединяется к олефину. При этом возможно образование двух радикалов:
Из двух возможных радикалов (1) и (2) первый более устойчивый и быстрее образуется. Поэтому первый радикал способствует дальнейшему росту цепи:
Реакция протекает как радикально-цепной процесс при низких температурах (-80 0 С)
Радикальное замещение.
Взаимодействие гомологов этилена с галогенами (хлор, бром) при высоких температурах, свыше 400 0 С, ведет только к замещению атома водорода в аллильном положении на галоген и называется аллильным замещением. Двойная связь при этом в конечном продукте сохраняется:

Реакция протекает как цепной процесс радикального замещения (S R). Высокая температура способствует гомолизу молекул хлора и образованию радикалов.
Гидрирование.
Алкены непосредственно молекулярный водород не присоединяют, Эту реакцию можно провести только в присутствии гетерогенных катализаторов, например, платина, палладий, никель, или гомогенных, например, комплексная соль родия. Обычно в лабораториях и в промышленности для присоединения водорода по двойной связи используют гетерогенные катализаторы:
Термодинамически эта реакция весьма выгодна:

Поскольку при гидрировании с использованием гетерогенного катализатора необходимо адсорбировать олефин на поверхности катализатора по двойной связи. Соответственно олефины гидрируются тем легче, чем меньше заместителей у двойной связи – правило Лебедева.
Окисление.
Существует два основных направления (типа) в окислении олефинов:
1. с сохранением углеродного скелета – это эпоксидирование и гидроксилирование;
2. с разрывом двойной углерод – углеродной связи – это озонолиз и исчерпывающее окисление алкенов.
В зависимости от типа используют различные окислители.
Эпоксидирование
Эпоксидированием называется образование эпоксида – трехчленного циклического простого эфира. Кислородом воздуха в присуствии серебрянного катализатора этилен эпоксидируется в окись этилена:
Остальные олефины эпоксидируются действием пероксикарбоновых кислот или просто надкислот (реакция Прилежаева). Пероксикарбоновые кислоты содержат перекисную структуру «О-О», которая отдает один атом кислорода двойной связи:
Гидроксилирование
Разбавленный (5-10%) раствор перманганата калия (реакция Вагнера) с олефинами образуют цис -гликоли или цис -1,2-диол:
Похожая информация.
Основные этапы процедуры наименования абсолютной конфигурации рассмотрим на примере энантиомеров бромфторхлорметана (12) и (13).
Первым этапом
является определение порядка старшинства заместителей при асимметрическом атоме.
Старшинство изотопов данного элемента возрастает с увеличением их массового числа.
В соответствии с этим, имеем следующий порядок старшинства заместителей в молекулах бромфторхлорметанов:
Br > CI> F> Н
Самый старший заместитель обозначим буквой а, следующий по старшинству - буквой b и т.д. (то есть, при переходе а b c d старшинство убывает):

Второй этап . Располагаем молекулу таким образом, чтобы самый младший заместитель был удален от наблюдателя (при этом он будет заслонен атомом углерода) и рассматриваем молекулу вдоль оси связи углерода с младшим заместителем:

Третий этап . Определяем, в каком направлении ПАДАЕТ старшинство заместителей, находящихся в нашем поле зрения. Если падение старшинства происходит по часовой стрелке, обозначаем буквой R (от латинского "rectus"правый). Если старшинство падает против часовой стрелки, то конфигурацию обозначаембуквой S(от латинского "sinister"-левый).

Существует также мнемоническое правило, в соответствии с которым падение старшинства заместителей в R-изомере происходит в том же направлении, в котором пишется верхняя часть буквы R, а в S-изомере - в том же направлении, в котором пишется верхняя часть буквы S:
Теперь мы можем написать полные названия энантиомеров, которые однозначно говорят об их абсолютной конфигурации:
Следует подчеркнуть, что обозначение конфигурации стерзоизомера как R или S зависит от порядка старшинства всех четырех заместителей при асимметрическом атоме. Так, в изображенных ниже молекулах пространственное расположение атомов F, CI и Вг относительно группы X одинаково:
Однако, обозначение абсолютной конфигурации этих молекул может оказаться одинаковым или разным. Это определяется природой конкретной группы X.

В ряде химических реакция пространственное расположение заместителей у асимметричеекого атома углерода может измениться, например:

В молекулах (16) и (17) пространственное расположение атомов Н, D (дейтерий) и F относительно заместителей X и Z зеркально противоположно:

Поэтому говорят, что в данной реакции произошло обращение конфигурации .
Обозначение абсолютной конфигурации, определенное по системе Кана-Ингольда-Прелога, при переходе от (16) к (17) может измениться или остаться прежним. Это зависит от конкретных групп X и Z, влияющих на порядок старшинства заместителей при асимметрическом атоме, например:

В приведенных примерах нельзя говорить об обращении абсолютной конфигурации , поскольку исходное соединение и продукт реакции не являются изомерами (см. выше, стр.20). В то же время, превращение одного энантиомера в другой - это обращение абсолютной конфигурации:

VI.Молекулы с двумя асимметрическими атомами.
Диастереомеры.
Если в молекуле есть несколько асимметрических атомов, появляются особенности в построении проекций Фишера, а также новый тип взаимоотношений между стереоизомерами, которого нет в случае молекул с одним
асимметрическим атомом.
Рассмотрим принцип построения проекций Фишера для одного из стереоизомеров 2-бром-З-хлорбутана.

Запись в скобках (2S,3S) означает, что атом углерода с номером 2 имеет S-конфигурацию. То же относится к атому углерода с номером 3. Нумерация атсмов в молекуле производится в соответствии с правилами ИЮПАК для наименования органических соединений.
Асимметрическими атомами в этой молекуле являются атомы углерода С(2) и С(3). Поскольку данная молекула может существовать в различных конформациях относительно центральной связи С-С, необходимо условиться, для какой конформации мы будем строить проекциюФишера. Следует запомнить, что проекция Фишера строится только для заслоненной конформации
, причем такой, в которой атомы С, составляющие углеродную цепочку молекулы, располагаются в одной плоскости.
Переведем изображенную выше молекулу в заслоненную конформацию и развернем ее таким образом, чтобы углеродная цепочка была расположена вертикально. Полученная при этом клиновидная проекция соответствует такому расположению молекулы, при котором все связи С-С находятся в плоскости чертежа:

Повернем всю молекулу на 90°относительно центральной связи С-С, не изменяя ее конформацию так, чтобы CН 3 -группы ушли под плоскость чертежа. При этом атомы Br, CI и связанные с С(2) и С(3) атомы водорода окажутся над плоскостью чертежа. Спроектируем ориентированную таким образом молекулу на плоскость чертежа (атомы, находящиеся под плоскостью проектируем вверх; атомы, расположенные над плоскостью - вниз) аналогично тому, как мы делали это в случае молекулы с одним асимметрическим атомом:

В полученной таким образом проекции подразумевается, что лишь центральная связь С-С лежит в плоскости чертежа. Связи С(2)-CН 3 и C(3)-CН 3 направлены от нас. Связи атомов С(2) и С(3) с атомами Н, Вr и CI направлены к нам. Атомы С(2) и С(3) подразумеваются в точках пересечения вертикальной и горизонтальных линий. Естественно, что при пользовании полученной проекцией необходимо соблюдать изложенные выше правила (см.правила).
Для молекул о несколькими асимметрическими атомами число стереоизомеров равно в общэм случае 2 n , где n - число асимметрических атомов. Следовательно, для 2-бром-З-хлорбутана должны существовать 2 2 - 4 стереоизомера. Изобразим их с помощью проекций Фишера.

Эти стереоизомеры можно подразделить на две группы: А и Б. Изомеры А (I и П) связаны операцией отражения в зеркальной плоскости - это энантиомеры (антиподы). То же самое относится к изомерам группы Б: Ш и IV - также энантиомеры.
Если же мы сравним любой из стереоизомеров группы А с любым стереоизомером группы Б, то обнаружим, что они не являются зеркальными антиподами.
Таким образом, I и Ш - диастереомеры. Аналогично, диастереомерами являются по отношению друг к другу I и IV, II и III, II и IV.


Могут реализоваться случаи, когда число изомеров меньше предсказываемого формулой 2 n . Такие случаи встречаются, когда окружение центров хиральности создается одним и тем же набором атомов (или групп атомов), например, в молекулах 2,3-дибромбутанов:

(*Молекулы V и VI хиральны, поскольку в них отсутствуют элементы симметрии группы S n . Однако, и в V и в VI есть простая поворотная ось симметрии С 2 , проходящая через середину центральной связи С -С, перпендикулярная плоскости чертежа. На этом примере видно, что хиральные молекулы не обязательно асимметричны).
Нетрудно видеть, что проекции VII и VII " изображают одно и то же соединение: эти проекции полностью совмещаются друг с другом при повороте на 180° в плоскости чертежа. В молекуле VII легко обнаруживается плоскость симметрии, перпендикулярная центральной С-С-связи и проходящая через ее середину. В данном случае в молекуле есть асимметричекие атомы, но в целом молекула ахиральна. Соединения, состоящие из таких молекул, называются мезо-формами . Мезо-форма не способна вращать плоскость поляризации света, то есть она оптически неактивна.
Согласно определению, любой из энантиомеров (V) и (VI) и мезо-форма являются по отношению друг и другу диастереомерами.
Как известно, физические свойства энантиомеров идентичны (за исключением отношения к плоскополяризованному свету). Иначе обстоит делос диастереомерами, поскольку они не являются зеркальными антиподами. Их физические свойства отличаются так же, как свойства структурных изомеров. Ниже это показано на примере винных кислот.
VII Относительная конфигурация. Эритро-трео-обозначения .
В отличие от понятия "абсолютная конфигурация", термин "относительная конфигурация" используется, по крайней мере, в двух аспектах. Так, под относительной конфигурацией понимается структура соединения, определенная по отношению к некоторой "ключевой" модели путем химических переходов. Таким путем в свое время была определена конфигурация асимметрических атомов в молекулах углеводов по отношению к глицериновому альдегиду. При этом рассуждали примерно так: "Если (+)-глицериновый альдегид имеет изображенную ниже конфигурацию, то связанный с ним химическими превращениями углевод имеет такую-то конфигурацию асимметрических атомов".

Позже, когда был разработан рентгенографический метод определения абсолютной конфигурации, было показано, что в данном случае догадка о том, что (+)-глцериновый альдегид имеет изображенную конфигурацию, верна. Следовательно, верно и отнесение конфигураций асимметрических атомов в углеводах.
Термин "относительная конфигурация" имеет и другое значение. Его используют при сравнении диастереомеров по различиям во взаимном расположении выбранных групп внутри каждого диастереомера. Именно в этом плане об относительной конфигурации говорится в номенклатурных правилах ИЮПАК по химии. Рассмотрим два способа обозначения относительной конфигурации (взаимного расположения групп внутри молекулы) диастереомеров с асимметрическими атомами [существуют диастереомеры без асимметрических атомов, например, цис-и транс-алкены (см. ниже, стр. 52)] на примере стереоизомеров 2-бром-3-хлорбутана (1)-(1V).
В первом варианте используются конфигурационные дескрипторы эритро- и трео-. При этом сравнивают расположение одинаковых заместителей при двух асимметрических атомах в проекции Фишера. Стереоизомеры, в которых одинаковые заместители при асимметрических атомах углерода расположены по одну сторону от вертикальной линии, называют эритро-изомерами . Если такие группы находятся по разнне стороны от вертикальной линии, то говорят о трео-изомерах . В соединениях (I) -(IV) такими реперными -группами являются атомы водорода, и эти соединения получают следующие названия:

Отсюда видно, что обозначение относительной конфигурации у энантиомеров совпадает, а у диастереомеров - различается. Это важно, поскольку и в настоящее время установление абсолютной конфигурации энантиомеров - задача непростая. В то же время, различить диастереомеры достаточно легко, например, с помощью спектров ЯМР. При этом фраза "Из спектра следует, что в результате реакции получается эритро-2-бром-3-хлорбутан" означает, что речь идет об одном из энантиомеров: (I) или (II) [либо о рацемате, состояшем из (I)и (П)] (о каком именно - неизвестно), но не о соединениях (Ш) или (IV). Аналогично, фраза "Мы имеем дело с трео-2-бром-3-хлорбутаном" означает, что имеются в виду соединения (Ш) и (IV), но не (I) или (П).
Запомнить эти обозначения можно, например, так. В эритро-изомере одинаковые заместители "смотрят" в одну сторону, как и элементы буквы "а".
Приставки эритро- и трео- происходят от названий углеводов: треозы и эритрозы. В случае соединений с болтшим числом асимметрических атомов применяют другие стереохимические дескрипторы, такжне происходящие от названий углеводов (рибо-, ликсо-, глюко- и т.п.).
В другой варианте обозначения относительной конфигурации испольмуют символы R* и S* При этом асимметрический атом, имеющий наименьший номер (в соответствии с правилами номенклатуры ИЮПАК), независимо от его абсолютной конфигурации, получает дескриптор R*. В случае соединений (I) - (IV) - это атом углерода, связанный с бромом. Второму асимметрическому атому в данной молекуле также придается дескриптор R*, если обозначения абсолютной конфигурации обоих асимметрических атомов совпадают (оба R или оба S).Так следует поступить в случае молекул (Ш) и (IV). Если же абсолютная конфигурация асиммотрических атомов в молекуле имеет разное обозначение (молекулы I и II), то второй асимметрический атом получает дескриптор S*
Эта система обоэначения относительной конфигурации, по существу, эквивалентна в эритро-трео-системе обозначений: у энантиомеров обозначения совпадают, а у диастереомеров - различаются. Разумеется, если у асимметрических атомов нет одинаковых заместителей, то относительную конфигурацию можно обозначить только с помощью дескрипторов R* и S*
VIII Методы Разделения энантиомеров .
Природные вещества, молекулы которых хиральны, являются индивидуальнымиэнантиомерами. Если же хиральный центр возникает в процессе химическойреакции, проводимой в колбе или промышленном реакторе,получается рацемат, содержащий равные количества двух энантиомеров. При этом возникает проблема разделения энантиомеров с целью получения каждого из них в индивидуальном состоянии. Для этого используют специальные приемы, называемые методами расщепления рацематов .
Метод Пастера.
Л.Пастер в 1848 г. обнаружил, что из водных растворов натриево-аммониевой соли виноградной кислоты (рацемат (+)- и (-)-винных кислот) при определенных условиях выпадают кристаллы двух типов, отличающиеся друг от друга как предмет и его зеркальное отображение. Пастер разделил эти кристаллы с помощью микроскопа и пинцета и получил в чистом виде соли (+)-винной кислоты и (-)-винной кислоты. Такой метод расщепления рацематов, основанный на самопроизвольной кристаллизации энантиомеров в двух различных кристаллических модификациях, получил название "метод Пастера". Однако, этот метод удается применить далеко не всегда. В настоящее время известно около 300 пар энантиомеров, способных к такой "самопроизвольной кристаллизации" в виде кристаллов разной формы. Поэтому были разработаны другие методы, позволяющие разделять энантиомеры.
НОМЕНКЛАТУРА СТЕРЕОХИМИЧЕСКАЯ
(от лат. по-menclatura - перечень, список), предназначена для обозначения пространств. строения хим. соединений. Общий принцип Н. с. (правила , раздел Е) состоит в том, что пространств. строение соед. обозначают префиксами, добавляемыми к назв., не изменяя этих назв. и нумерации в них (хотя иногда стереохим. особенности могут определять выбор между возможными альтернативными способами нумерации и выбор главной цепи).
В основе большинства стереохим. обозначений лежит правило последовательности, к-рое однозначно устанавливает старшинство заместителей. Старшими считаются те из них, у к-рых с рассматриваемым хиральным (см. Хираль-ность
)элементом (напр., асимметрич. атомом, двойной связью, циклом) непосредственно связан с большим атомным номером (см. табл.). Если эти атомы одинаковы по старшинству, то рассматривают "второй слой", в к-рый входят атомы, связанные с атомами "первого слоя", и т. д., до появления первого различия; номера атомов, связанных двойной связью, при определении старшинства удваивают. Наиб. общий подход к обозначению конфигурации энан-тиомеров - использование R,S
-системы. Обозначение R(от лат. rectus-правый) получает тот из энантиомеров, в к-ром при рассмотрении модели со стороны, противоположной младшему заместителю, старшинство остальных заместителей падает по часовой стрелке. Падение старшинства против часовой стрелки соответствует S-обозначению (от лат. sinister-левый) (рис. 1).
Возрастание старшинства заместителей при хиральном центре:

Рис.
1. Схема для определения старшинства заместителей в органических соединениях.

Для углеводов, a-гидроксикислот, a-аминокислот широко используют также D,L-систему, основанную на сравнении конфигурации рассматриваемого асимметрич. центра с конфигурацией соответствующего энантиомера глицеринового альдегида. При рассмотрении проекционных Фишера фор
мул
расположение групп ОН или NH 2 слева обозначается символом L (от лат. laevus- левый), справа-символом D (от лат. dexter-правый):


Рис.2. Диэдральный угол.

Для обозначения конформаций молекулы указывают величину диэдрального (двугранного) угла j между двумя старшими заместителями при связи СЧС (рис. 2), к-рый отсчитывают по часовой стрелке и выражают в условных единицах (одна единица равна 60°), либо используют словесные обозначения расположения старших заместителей в ф-лах Ньюмена (рис. 3).


Рис. 3. Обозначения конформеров бутана (звездочкой
отмечены рекомендуемые правилами ИЮПАК).
Лит.: Номенклатурные правила ИЮПАК по химии, т.3, полутом 2, М., 1983, с. 5-118; Ногради М., Стереохимия. Основные понятия и приложение, пер. с англ., М., 1984. В. М. Потапов, М. А. Федоровская.
Химическая энциклопедия. - М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Смотреть что такое "НОМЕНКЛАТУРА СТЕРЕОХИМИЧЕСКАЯ" в других словарях:
Раздел стереохимии, изучающий конформации молекул, их взаимопревращения и зависимость физ. и хим. св в от конформац. характеристик. Конформации молекулы разл. пространств. формы молекулы, возникающие при изменении относит. ориентации отдельных ее … Химическая энциклопедия
Не следует путать с термином «Изомерия атомных ядер». Изомерия (от izos равный и meros доля, часть греч., ср. изо), существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по… … Википедия
Не следует путать с термином «Изомерия атомных ядер». Изомерия (от izos равный и meros доля, часть греч., ср. изо), существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по… … Википедия
Не следует путать с термином «Изомерия атомных ядер». Изомерия (от izos равный и meros доля, часть греч., ср. изо), существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по… … Википедия
Не следует путать с термином «Изомерия атомных ядер». Изомерия (от izos равный и meros доля, часть греч., ср. изо), существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по… … Википедия
Не следует путать с термином «Изомерия атомных ядер». Изомерия (от izos равный и meros доля, часть греч., ср. изо), существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по… … Википедия
Не следует путать с термином «Изомерия атомных ядер». Изомерия (от izos равный и meros доля, часть греч., ср. изо), существование соединений (главным образом органических), одинаковых по элементному составу и молекулярной массе, но различных по… … Википедия
- (греч. anti приставка, означающая противоположность; греч. syn приставка, означающая совместность), приставки, обозначающие: 1) гео метрич. изомеры с двойной связью =NЧ и ЧN=NЧ. Напр., в изомерах бензальдоксима син указывает на сближенность… … Химическая энциклопедия
- (от изо... и греч. meros доля, часть), существование соединений (гл. обр. органических), одинаковых по составу и мол. массе, но различных по физ. и хим. св вам. Такие соед. наз. изомерами. В итоге полемики Ю. Либиха и Ф. Вёлера было установлено… … Химическая энциклопедия
Система Фишера в свое время позволила создать логичную и непротиворечивую стереохимическую систематику большого числа природных соединений, ведущих свое происхождение от аминокислот и сахаров. Относительная конфигурация энантиомеров в этой системе определялась путем химической корреляции, т.е. путем перехода от данной молекулы к D- или L-глицериновому альдегиду через последовательность химических реакций, не затрагивающих асимметрический атом углерода (подробнее см.раздел 8.5). Вместе с тем, если молекула, конфигурацию которой требовалось установить, по своей структуре очень сильно отличалась от глицеринового альдегида, скоррелировать ее конфигурацию с конфигурацией глицеринового альдегида химическим путем было бы очень обременительно. Кроме того, отнесение конфигурации к D - или L - ряду не всегда было однозначно. Например, D-глицериновый альдегид, в принципе, можно превратить в глицериновую кислоту, затем действием диазометана - в метиловый эфир, и далее селективным окислением первичной спиртовой функции и этерификацией диазоэтаном в метиловоэтиловый эфир гидроксималоновой кислоты (XXV). Все эти реакции не затрагивают хиральный центр и поэтому можно сказать, что диэфир XXV относится к D - ряду.
Если же первую этерификацию проводить диазоэтаном, а вторую диазометаном, то получится диэфир XXVI, который по той же причине также следует отнести к D-ряду. На самом же деле соединения XXV и XXVI представляют собой энантиомеры; т.е. одни относятся к D- а другие к L- ряду. Таким образом, отнесение зависит от того, какую из сложноэфирных групп, CO 2 Et или CO 2 Me, признать "главной".
Указанные ограничения фишеровской системы, а также тот факт, что в 1951 г. появился рентгеноструктурный метод определения истинного расположения групп вокруг хирального центра, привели к соэданию в 1966 году новой, более строгой и непротиворечивой системы описания стереоизомеров, известной под названием R,S-номенклатуры Кана-Ингольда-Прелога (КИП) или правил последовательного старшинства. Эта система в настоящее время практически вытеснила D,L- систему Фишера (последняя, однако, все еще употребляется для углеводов и аминокислот). В системе КИП к обычному химическому названию прибавляются специальные дескрипторы R- или S-, строго и однозначно определяющие абсолютную конфигурацию.
Возьмем соединение типа Xabcd, содержащее один асимметрический центр Х. Чтобы установить его конфигурацию, четыре заместителя у атома Х следует пронумеровать и расположить в ряд в порядке уменьшения старшинства (см. ниже), т.е. 1>2>3>4. Заместители рассматриваются наблюдателем со стороны наиболее удаленной от самого младшего заместителя (обозначенного номером 4). Если при этом направление убывания старшинства 1 2 3 совпадает с движением по часовой стрелке, то конфигурацию данного асимметрического центра обозначают символом R (от латинского rectus - правый) а если против часовой стрелки - символом S (sinister - левый).

Приведем несколько правил последовательного старшинства, достаточных для рассмотрения подавляющего большинства хиральных соединений.
1) Предпочтение по
старшинству отдается атомам с более
высокими атомными номерами. Если номера
одинаковы (в случае изотопов), то более
старшим считается атом с наибольшей
атомной массой. Самый младший "заместитель"
- неподеленная электронная пара. Таким
образом, старшинство возрастает в ряду:
неподеленная пара < H < D < T < Li < B
< C < N < O < F < Si < P

2) Если с асимметрическим атомом непосредственно связано два, три или все четыре одинаковых атома, порядок устанавливается по атомам второго пояса, которые связаны уже не с хиральным центром, а с теми атомами, которые имели одинаковое старшинство. Например, в молекуле XXVII по первому атому групп СН 2 ОН и (СН 3) 2 СН установить старшинство не удается, однако предпочтение отдается СН 2 ОН, так как атомный номер кислорода больше, чем углерода. Группа СН 2 ОН старше, несмотря на то, что в ней с атомом углерода связан лишь один атом кислорода, а в группе СН(СН 3) 2 - два атома углерода. Если и вторые атомы в группе одинаковы, порядок определяется по атомам третьего пояса и т.д.

Если и такая процедура не привела к построению однозначной иерархии, ее продолжают на все более возрастающих расстояниях от центрального атома, пока, наконец, не встретится различия и все четыре заместителя все-таки получат свое старшинство. При этом любое предпочтение, приобретаемое тем или иным заместителем на одной из стадий согласования старшинства считается окончательным и на последующих стадиях переоценке не подлежит. Если в молекуле встречаются точки разветвления, процедуру установления старшинства следует продолжать вдоль молекулярной цепи наибольшего старшинства. При установлении старшинства того или иного центрального атома решающее значение имеет число связанных с ним других атомов высшего старшинства. Например, CCl 3 > CHCl 2 > CH 2 Cl.
3) Формально принимается, что валентность всех атомов, кроме водорода, равна 4. Если истинная валентность атома меньше (например, у кислорода, азота, серы), то считается, что у этого атома имеется 4-n (где n - настоящая валентность) так называемых фантом-заместителей , которым приписывается нулевой порядковый номер и отводится последнее место в перечне заместителей. В соответствии с этим группы с двойными и тройными связями представляются так, как если бы они были расщеплены на две или три простые связи. Например, при представлении двойной связи С=С каждый атом рассматривается как связанный с двумя атомами углерода, причем считается, что второй из этих атомов углерода имеет три фантом-заместителя. В качестве примера рассмотрим представления групп -СН=СН 2 , -СНО, -СООН, -ССН и -С 6 Н 5 . Эти представления выглядят следующим образом.

Первые атомы во всех этих группах связаны соответственно с (Н,С,С), (Н,О,О), (О,О,О), (С,С,С) и (С,С,С). Этой информации достаточно, чтобы группу СООН поставить на первом месте (самая старшая), группу СНО на втором, а группу -СН=СН 2 - на последнем (пятом) месте, поскольку наличие хотя бы одного атома кислорода предподчтительнее наличия даже трех атомов углерода. Чтобы сделать вывод об относительном старшинстве групп ССН и -С 6 Н 5 нужно пойти дальше по цепи. Группа С 6 Н 5 имеет два атома углерода типа (С,С,С), связанные с (С,С,Н), а третий атом относится к типу (О,О,О). Группа ССН имеет только одну группировку (С,С,Н), но две группировки (О,О,О). Следовательно, С 6 Н 5 старше, чем ССН, т.е. по порядку старшинства пять указанных групп займут ряд: СООН> СНО> С 6 Н 5 > ССН> СН=СН 2 .
Старшинство наиболее часто встречающихся заместителей можно определить по табл. 8-2, в которой условный номер означает большее старшинство.
Таблица 8.2.
Старшинство некоторых групп по Кану-Ингольду-Прелогу
|
Условный номер |
Условный номер |
||
|
Аллил, СНСН=СН 2 |
Меркапто, SH | ||
|
Амино, NH 2 |
Метил, H 3 | ||
|
Аммонио, NH 3 + |
Метиламино, NHCH 3 | ||
|
Ацетил, COCH 3 |
Метилсульфинил, SOCH 3 | ||
|
Ацетиламино, NHCOCH 3 |
Метилсульфинилокси,OSOCH 3 | ||
|
Ацетокси, OCOCH 3 |
Метилсульфонил, SO 2 CH 3 | ||
|
Бензил, CH 2 C 6 H 5 |
Метилсульфонилокси,OSO 2 CH 3 | ||
|
Бензилокси, OCH 2 C 6 H 5 |
Метилтио,SCH 3 | ||
|
Бензоил, COC 6 H 5 |
Метокси,OCH 3 | ||
|
Бензоиламино, NHCOC 6 H 5 |
Метилкарбонил, COOCH 3 | ||
|
Бензоилокси, OCOC 6 H 5 |
Неопентил, CH 2 C(CH 3) 3 | ||
|
Бензоилоксикарбонил-амино, NHCOOCH 2 C 6 H 5 |
Нитро, NO 2 | ||
|
Бром, Br |
Нитрозо, NO | ||
|
втор-Бутил, CH(CH 3)CH 3 CH 3 |
м-нитрофенил,
| ||
|
н-Бутил, CH 2 CH 2 CH 2 CH 3 |
о-нитрофенил,
| ||
|
трет-Бутил, C(CH 3) 3 |
п-нитрофенил,
| ||
|
трет-Бутоксикарбонил, COOC(CH 3) 3 |
Пентил, C 5 H 11 | ||
|
Винил, CH 2 = CH 2 |
Пропенил, CH=CHCH 3 | ||
|
Водород, H |
Пропил, CH 2 CH 2 CH 3 | ||
|
н-Гексил, C 6 H 13 |
Пропинил, CCCH 3 | ||
|
Гидрокси, OH |
Пропаргил, CH 2 CCH | ||
|
Гликозилокси |
Сульфо, SO 3 H | ||
|
Диметиламино, N(CH 3) 2 |
м-Толил,
| ||
|
2,4-Динитрофенил,
|
о-Толил,
| ||
|
3,5-Динитрофенил,
|
п-Толил,
| ||
|
Диэтиламино, N(C 2 H 5) 2 |
Триметиламмонио,
| ||
|
Изобутил, CH 2 CH(CH 3) 2 |
Тритил, C(C 6 H 5) 3 | ||
|
Изопентил, CH 2 CH 2 CH(CH 3) 2 |
Фенил, C 6 H 5 | ||
|
Изопропенил, CH(CH 3)=CH 2 |
Фенилазо, N=NCC 6 H 5 | ||
|
Изопропил, CH(CH 3) 2 |
Фениламино, NHC 6 H 5 | ||
|
Фенокси, OC 6 H 5 | |||
|
Карбоксил, COOH |
Формил, CHO | ||
|
2,6-Ксилил,
|
Формилокси, OCHO | ||
|
3,5-Ксилил,
| |||
|
Хлор, Cl | |||
|
Циклогексил, C 6 H 11 | |||
|
Этил, CH 2 CH 3 | |||
|
Этиламино, NHC 2 H 5 | |||
|
Этинил, CCH | |||
|
Этокси, OC 2 H 5 | |||
|
Этоксикарбонил, COOC 2 H 5 |
Правила последовательного старшинства были специально задуманы так, чтобы оказаться в максимально близком соответствии с ранней систематикой Фишера, так как по счастливой случайности оказалось, что D-глицериновый альдегид имеет действительно такую конфигурацию, которая ему произвольно была приписана вначале. В результате большинство D-центров и, что очень важно, сам глицериновый альдегид, имеют (R)-конфигурацию, а L-стереоизомеры обычно принадлежат к (S)-ряду.

Одним из исключений является L-цистеин, который принадлежит к (R)-ряду, так сера по правилам старшинства предпочтительнее кислорода. В ситеме КИП генетическое родство между молекулами во внимание не принимается. Эта система может применяться только к соединениям с известной абсолютной конфигурацией. Если конфигурация неизвестна, то соединение приходится обязательно характеризовать знаком его вращения.
Правила последовательного старшинства применимы также и к описанию геометрических изомеров непредельных соединений. Заместители у каждого конца кратной связи при установлении старшинства должны рассматриваться отдельно. Если заместители, имеющие более высокое старшинство, расположены с одной и той же стороны двойной связи, соединению присваивают префикс Z - (от немецкого zusammen - вместе), а если по разные стороны, то префикс Е (entgegen - напротив). (Z, Е) - Номенклатура алкенов рассмтривалась в гл.5. Ниже приведены примеры отнесения структур с использованием (Z, Е) - обозначений.

Последний пример показывает, что преимущественное право включения в главную цепь имеет звено с Z - конфигурацией. (R,S) - Обозначения могут быть применены и для соединений с аксиальной хиральностью. Для отнесения конфигурации изображают проекцию Ньюмена на плоскость, перпендикулярную хиральной оси, и далее применяют дополнительное правило, согласно которому заместители на конце оси, ближайшей к наблюдателю, рассматриваются как имеющие более высокое старшинство, чем заместители на дальнем конце оси. Тогда конфигурацию молекулы определяют направлением обхода заместителей по или против часовой стрелки в обычном порядке убывания старшинства от первого ко второму и затем третьему лиганду. Ниже это проиллюстрировано для 1,3 - аллендикарбоновой и 2,2 - иодиддифенил-6,6-дикарбоновой кислот.

Правило последовательного старшинства разработаны также для планарно и спирально хиральных молекул.
При изображении соединений с помощью фишеровских проекций можно легко определить конфигурацию без построения пространственных моделей. Формулу надо записать так, чтобы младший заместитель находился внизу; если при этом остальные заместители в порядке уменьшения старшинства располагаются по часовой стрелке, соединение относят к (R) - ряду, а если против часовой - то к (S) -ряду, например:

Если младшая группа не находится внизу, то следует поменять ее местами с нижней группой, но следует помнить, что при этом происходит обращение конфигурации.











 Научно-исследовательский институт кораблестроения и вооружения вмф
Научно-исследовательский институт кораблестроения и вооружения вмф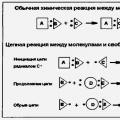 Благотворная роль активных форм кислорода
Благотворная роль активных форм кислорода Приглашаем к участию! Физическая химия. Конспект лекций
Приглашаем к участию! Физическая химия. Конспект лекций