Энергетический профиль течения реакции. Вывод уравнения аррениуса Урок с использованием информационных технологий
Равновесие процесса перехода одной фазы в другую без изменения химического состава называется фазовым равновесием. Примерами фазового равновесия могут быть следующие процессы:
испарение
![]()
Для фазового равновесия соблюдается принцип Ле Шателье.
При повышении температуры равновесие смещается в сторону эндотермического процесса, например, плавления и испарения. С увеличением давления равновесие смещается в сторону процессов, при которых газ или пар превращаются в жидкое или твёрдое состояние.
Правило фаз.
Сформулировано Дж. Гиббсом. Число степеней свободы C , фазФ , независимых компонентовК и внешних условийн , влияющих на равновесие, взаимосвязаны соотношением:
C + Ф = К + н
2.4. Механизм химической реакций. Цепные реакции. Фотохимические процессы. Гомогенный и гетерогенный катализ. Автокатализ. Ферментативный катализ. Каталитические яды. Колебательные реакции.
Энергия активации. Энергетический профиль реакции.
Реакции происходят в результате непосредственного столкновения молекул. Однако не все столкновения приводят к химическому взаимодействию. Образованию новых веществ способствуют только молекулы, обладающие достаточным запасом энергии. Такие молекулы называются активными молекулами.
Та минимальная энергия, достаточная для начала химической реакции называется энергией активации и выражается в ккал или кДж. Чем меньше энергия активации, тем быстрее идет реакция.
В реакциях, где энергия активации больше, чем 150 кДж при t=25°С скорость очень мала или практически эти реакции не протекают. В реакциях, где энергия активации меньше 60 кДж, скорость очень большая (взрыв).
Величина энергии активации Еа зависит от природы реагирующих элементов и служит характеристикой каждой реакции.

Энергетическая диаграмма хода реакции с образованием
активированного комплекса.
Чтобы реагирующие вещества А и В образовали продукты реакции С и Д они должны преодолеть энергетический барьер МL. На это затрачивается энергия активации Еа. При этом в ходе реакции из частиц реализующих веществ, образуется промежуточная неустойчивая группировка - активированный комплекс (рис.2.6).
Этот комплекс распадается с образованием конечных продуктов, причем выделяется такое количество энергии, которое позволяет конечным продуктам спуститься до уровня средней энергии конечных продуктов.
Т.о. изменение продуктов можно выразить в виде схем для эндотермической и экзотермической реакции (рис.2.7, 2.8).


схема протекания
экзотермической реакции
схема протекания
эндотермической реакции
О бычно
реакции между веществами с прочными
ковалентными связями характеризуются
большими значениями Еа и идут медленно.
Это относится ко многим взаимодействиям,
как
бычно
реакции между веществами с прочными
ковалентными связями характеризуются
большими значениями Еа и идут медленно.
Это относится ко многим взаимодействиям,
как
скорость которых при стандартных условиях равна 0.
М алыми
значениями Еа и очень большими
скоростями характеризуются ионные
взаимодействия в растворах
алыми
значениями Еа и очень большими
скоростями характеризуются ионные
взаимодействия в растворах
Константа скорости реакции k в уравнении (72) есть функция температуры; повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Вант-Гоффом, сформулировавшим следующее эмпирическое (т.е. на основе экспериментальных данных) правило: При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент Вант-Гоффа (γ). Математически правило Вант-Гоффа можно записать следующим образом:
Правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
Взаимодействие частиц осуществляется при их столкновениях; однако не каждое столкновение приводит к химическому взаимодействию частиц. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации. Энергия активации Е А – необходимый избыток энергии (по сравнению со средней энергией реагирующих веществ), которым должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции
А ––> В
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом :
А ––> K # ––> B
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер (Рис.26). Энергия активации реакции равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е" А выше, нежели энергия активации прямой реакции E A . Для эндотермической реакции наблюдается обратное соотношение между Е" А и Е" А. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции – тепловой эффект реакции (DU на Рис 26.).
Рис. 26 . Энергетический профиль химической реакции. E исх – средняя энергия частиц исходных веществ, E прод – средняя энергия частиц продуктов реакции.
Поскольку температура - мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (Рис.27):
Рис.27.
Распределение частиц по энергии. Здесь n Е /N
– доля частиц, обладающих энергией E
; E 1
T 1 , E 2
- средняя энергия частиц при температуре T 2 , E 3
- средняя энергия частиц при температуре T 3 ;
(T 1 Зависимость константы скорости от температуры описывается уравнением Аррениуса: Здесь A
– предэкспоненциальный множитель. Из уравнения (58) нетрудно показать его физический смысл: величина А
равна константе скорости реакции при температуре, стремящейся к бесконечности. Прологарифмируем соотношение (88): Как видно из последнего выражения, логарифм константы скорости линейно зависит от обратной температуры (Рис.28); величину энергии активации E A
и логарифм предэкспоненциального множителя A
можно определить графически (соответственно тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат). Рис.28.
Зависимость логарифма константы скорости химической реакции от обратной температуры. Зная энергию активации реакции и константу скорости при какой-либо температуре T 1
, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T 2
. ВЛИЯНИЕ ТЕМПЕРАТУРЫ. ЭНЕРГИЯ АКТИВАЦИИ
Влияние температуры на скорость реакции отражено в правиле Вант-Гоффа. С увеличением температуры на каждые 10 К скорость химической реакции возрастает в 2-4 раза: где γ - температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 10 К; υ 1 , υ 2 - скорости реакции при температуре Т 1 и Т 2 соответственно. Для обычных химических реакций у = 2-4, а для ферментативных реакций температурный коэффициент может достигать значений у = 7-9. Именно поэтому колебания температуры тела человека в пределах даже 1°С сильно сказываются на его самочувствии. Влияние температуры на скорость реакции связано с изменением константы скорости реакции, поэтому приведенное выше уравнение лучше представить так: Сильное влияние температуры на скорость химической реакции объясняет теория активных столкновений. Основные постулаты этой теории: Не каждое столкновение приводит к акту химического взаимодействия; К химическому взаимодействию приводят только та столкновения, в которых участвуют частицы, обладающие энергией, необходимой для данного взаимодействия (энергией активации); При соударении частицы должны быть определенным образом сориентированы относительно друг друга. Энергетический профиль течения реакции
Энергия активации реакции характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ. Энергия активации необходима для возникновения непрочного переходного комплекса [А∙∙∙В], который не является химическим соединением в подлинном смысле этого слова, так как в нем происходит перераспределение химических связей между взаимодействующими атомами. Такой промежуточный комплекс неустойчив вследствие его высокой энергии и может быстро распадаться, образуя продукты реакции D и F. Энергия активации зависит от природы реагирующих веществ и пути протекания реакции и не зависит от температуры, если с ее изменением не произошло изменения механизма реакции. Опытным путем установлено, что реакции с Е а < 50 кДж/моль при 298 К идут с высокой скоростью. Это характерно для реакций с участием радикалов или ионов. Если реакция имеет Е а > 100 кДж/моль, то ее скорость при 298 К неизмеримо мала. Источники активации реагирующих веществ могут быть различными: Термическая активация в результате подвода теплоты из окружающей среды; Действие различного рода излучений (свет, проникающая радиация); Действие быстрых частиц, возникающих при ядерном распаде или в электрическом разряде. При подводе энергии к системе происходит перераспределение этой энергии между частицами и увеличивается доля активных частиц, имеющих необходимую энергию для данного взаимодействия. Энергия активации является очень важной энергетической характеристикой реакции, которая связана с константой скорости реакции уравнением Аррениуса: где k - константа скорости реакции при температуре Т; А - предэкспоненциальный коэффициент (коэффициент Аррениуса), учитывающий частоту столкновения частиц, ориентированных определенным образом; е - основание натурального логарифма; Е а - энергия активации реакции, Дж/моль; R = 8,31 Дж/(моль К) - универсальная газовая постоянная. Из этого уравнения следует, что чем больше энергия активации, тем меньше будут константа и скорость химической реакции, так как в системе будет меньше число активных частиц. Если доля активных молекул превышает 10 −7 , то реакция идет практически мгновенно, а если эта доля меньше 10 −18 - реакция при данных условиях практически не идет. При повышении температуры реакции за счет увеличения энергии системы резко возрастает число активных частиц, и этим объясняется значительное повышение скорости реакции. Значение энергии активации реакции можно определить, измерив константы скорости этой реакции при двух разных температурах и используя следующее уравнение: где k 1 и k 2 - константы скорости реакции при температуре Т 1 и Т 2 . Высокая энергия активации делает практически невозможными многие реакции, которые, с точки зрения термодинамики, могли бы происходить. Очень многие из окружающих нас веществ находятся в термодинамически неустойчивом состоянии, и только наличие барьера активации препятствует их превращению в другие вещества. Исчезни энергия активации, тогда азот, кислород воздуха и вода океанов образовали бы азотную кислоту, все живые ткани разрушились бы вследствие реакций гидролиза и т. д. Эта химическая хаотизация невероятна из-за существования энергии активации - характернейшей черты любых химических превращений. Молекула любого вещества потому и существует, что изменения ее состояния связаны с преодолением энергетического барьера, т. е. с энергией активации на пути ее превращений. Теория столкновений позволяет установить математическое соотношение между скоростью реакции и частотой столкновений, а также вероятностью того, что энергия столкновения E превосходит минимальную энергию Еm, необходимую для осуществления реакции. Это соотношение имеет вид Скорость реакции = (Частота столкновений) (Вероятность того, что E > Em) Из этого соотношения можно вывести следующее уравнение: где к-константа скорости реакции; Р-стерический фактор, имеющий значение от 0 до 1 и соответствующий той части сталкивающихся молекул, которые имеют необходимую взаимную ориентацию при столкновении; Z-число столкновений, которое связано с частотой столкновений; Еа-энергия активации, соответствующая минимальной энергии столкновений, которую должны иметь реагирующие молекулы; Л-газовая постоянная; T-абсолютная температура. Два множителя, P и Z, можно объединить в одну постоянную А, которую называют предэкспоненциальным множителем или константой Аррениуса. В результате получается известное уравнение Аррениуса, с которым мы уже познакомились в предыдущем разделе: Теория переходного состояния рассматривает реагирующие молекулы как единую систему. Она подробно исследует изменения геометрического расположения атомов в этой системе по мере того, как в ней происходит превращение реагентов в продукты. Геометрическое положение атомов в такой молекулярной системе называется конфигурацией. По мере того, как конфигурация реагентов превращается в конфигурацию продуктов, происходит постепенное возрастание потенциальный энергии системы до тех пор, пока она не достигнет максимума. В момент достижения максимума энергии молекулы имеют критическую конфигурацию, которая называется переходным состоянием или активированным комплексом. Достичь этой критической конфигурации способны лишь те молекулы, которые обладают достаточной полной энергией. По мере того, как конфигурация этого переходного состояния превращается в конфигурацию продуктов, происходит уменьшение потенциальной энергии (рис. 9.12). Координата реакции на этих двух диаграммах представляет изменения в геометрическом расположении атомов реагирующих молекул, рассматриваемых как единая система, по мере того, как эта система испытывает превращение, начинающееся с конфигурации реагентов, переходящее в критическую конфигурацию и завершающееся конфигурацией продуктов. Если в реакции образуются интермедиаты, то возникновению каждого интермедиата соответствует минимум на графике зависимости потенциальной энергии от координаты реакции (рис. 9.13). Рис. 9.12. Энергетический профиль реакции - график зависимости потенциальной энергии от координаты реакции, а-для экзотермической реакции; б-для эндотермической реакции. Теория переходного состояния может использоваться для прогнозирования постоянных А и Ел в уравнении Аррениуса. Использование этой теории и современной вычислительной техники позволяет устанавливать точную картину протекания химических реакций на молекулярном уровне. Энергия активации - это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию (Е а, кДж/моль).
Энергия активации - это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию (Е а, кДж/моль).![]()

ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ

 Научно-исследовательский институт кораблестроения и вооружения вмф
Научно-исследовательский институт кораблестроения и вооружения вмф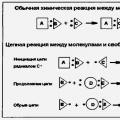 Благотворная роль активных форм кислорода
Благотворная роль активных форм кислорода Приглашаем к участию! Физическая химия. Конспект лекций
Приглашаем к участию! Физическая химия. Конспект лекций