Определение закона постоянства состава веществ. Закон постоянства состава: формулировка, примеры, значение
Одно и то же химическое соединение имеет постоянный состав, вне зависимости от места и способа получения образца. К такому выводу одним из первых пришел основатель современной химии, французский ученый А. де Лавуазье. Он сумел определить состав воды, воздуха, считал, что частицы входят в состав веществ в определенных пропорциях. Позже другим химиком из Франции Ж. Л. Прустом был сформулирован закон постоянства состава. Оба исследователя немало сил приложили, чтобы отстоять свои идеи в споре с научным сообществом.
Взгляды на строение вещества на рубеже XVIII и XIX веков
Химические элементы, соединяясь друг с другом в разных соотношениях, образуют множество веществ. Каждое из них характеризуется определенным набором атомов и соотношением их масс. Но до конца XVIII столетия многие ученые считали иначе. Проблема для них заключалась в неточности количественных методик. К тому же позиции атомно-молекулярных воззрений в то время были зыбкими, господствовала теория флогистона — мифического элемента. В установление количественного состава вещества значительный вклад внесли:
- А. де Лавуазье;
- М. В. Ломоносов;
- Ж. Л. Пруст;
- Д. Дальтон.
Заслуга Ж. Л. Пруста заключается в том, что он усовершенствовал количественные методы Лавуазье, строго им следовал. Ученый предложил закон постоянства состава, сохранения соотношений элементов в образцах соединений. Работу в этом направлении Пруст начал еще в конце XVIII века, но признание его труды получили только в 1808 году. примерно в это же время ввел представление об атомах и массах этих частиц, кратных соотношениях.
Биография Ж. Л. Пруста

Ученый, предложивший закон постоянства состава, появился на свет 26 сентября 1754 года на западе Франции. Отец Жозефа Луи был аптекарем в городе Анже. Он и приобщил сына к опытам с Юноша продолжил обучение в Париже, где познакомился с Лавуазье и его научными идеями. В 1776 году Пруст опубликовал свои первые серьезные труды в области химии. С 1799 по 1806 год ученый руководил лабораторией в Мадриде. Во Францию Пруст вернулся в 1806 году. После краткого пребывания в Париже Жозеф Луи отправился в родные места. В 1808-1816 годах получили признание его труды в области изучения состава веществ, в том числе глюкозы. В 1817-м он вышел в отставку и жил в одиночестве до конца своих дней (1826). Пруст был одним из выдающихся ученых своего времени, Рыцарем Почетного легиона, членом наук Неаполя.
Закон постоянства состава. Примеры
Ж. Л. Пруст открыл глюкозу, прославился блестящей победой в научной полемике с соотечественником Бертолле, причиной которой стал закон постоянства состава. Формулировка, предложенная Прустом, гласит: когда несколько элементов образуют химически чистый образец, то он состоит из одних и тех же атомов. Отношения их масс и числа также носят постоянный характер. Примеры:
- Хлорид натрия (NaCl) можно получить при взаимодействии соляной кислоты с гидроксидом натрия. Второй способ — обработка соляной кислотой В двух разных химических реакциях получаем соединение, формула которого NaCl. И в первом, и во втором случае вещество содержит 39,33% натрия и 60,66% хлора.
- Кислород (химический знак O) при образовании соединяется с одним и тем же количеством водорода (H). Если взаимодействует 1,11 г водорода с 8,89 г кислорода, то образуется 10 г воды (H 2 O). Увеличение количества одного из веществ приводит к такому же результату. Не прореагируют атомы того элемента, которого взяли в избытке. Масса воды в этом опыте остается такой же - 10 г, состав ее молекул отражает формула H 2 O.

Значение открытия постоянства состава
В начале XIX века в теоретической химии утвердились законы, которые соединяют вещества, описывают их соотношения. Изучали качественные и количественные характеристики многие ученые, предложившие универсальные формулировки. Основополагающими были идеи М. В. Ломоносова о сохранении массы в химических превращениях. Установленный Ж. Л. Прустом закон постоянства состава также имеет большое значение для науки и практики. На основании этой закономерности формулу воды записывают только в виде H 2 O, а состав серной кислоты - H 2 SO 4 . Но закон Пруста не имеет такого всеобъемлющего характера, как учение Ломоносова. Поэтому его формулировку уточнили после открытия изотопов. Так называют атомы одного и того же элемента, имеющие разную массу. Соотношение частиц в составе образца является постоянной величиной, но только при условии неизменного изотопного состава. Например, массовый состав водорода и кислорода в обычной и отличается. Вторая жидкость содержит изотоп водорода — дейтерий. Масса тяжелой воды больше, чем обычной.
Современные взгляды на состав вещества

В соответствии с формулировкой Пруста соотношение масс атомов, составляющих определенное вещество, носит постоянный характер, не зависит от способа получения образца. В начале XX столетия при изучении сплавов металлов были открыты соединения с переменным составом. В этом случае единице веса одного химического элемента могут соответствовать различные массы другого элемента. Например, в соединениях таллия с висмутом на единицу массы первого приходится от 1,2 до 1,8 единицы веса второго элемента. Такие примеры можно найти среди интерметаллических веществ, оксидов, соединений серы, азота, углерода, водорода с металлами. Следовательно, законы, открытые Прустом и Дальтоном, справедливы полностью только в отношении тех веществ, что имеют молекулярное строение. К ним относятся многие кислоты, оксиды, гидриды. Качественная и количественная структура подобных соединений является постоянной. Например, состав воды в атмосфере, Мировом океане, ледниках и живых организмах отражает формула H 2 O.
Один из основных законов химии, открытый в 1799 г. Ж. Л. Прустом; согласно этому закону определённое химически чистое соединение независимо от способа его получения состоит из одних и тех же хим. элементов, имеющих постоянные состав и свойства,… … Большая политехническая энциклопедия
закон постоянства состава - pastoviųjų santykių dėsnis statusas T sritis fizika atitikmenys: angl. law of constant proportions; law of definite composition vok. Gesetz der konstanten Gewichtsverhältnisse, n; Gesetz der konstanten Proportionen, n; Gesetz der konstanten… … Fizikos terminų žodynas
закон постоянства состава - закон паёв … Cловарь химических синонимов I
ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Большой Энциклопедический словарь
ПОСТОЯНСТВА СОСТАВА ЗАКОН: каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причем отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических… … Энциклопедический словарь
В каждом определенном хим. соед., независимо от способа его получения, соотношения масс составляющих элементов постоянны. Сформулирован в нач. 19 в. Ж. Прустом: Соединение есть привилегированный продукт, которому природа дала постоянный состав.… … Химическая энциклопедия
Один из основных законов химии: каждое определённое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны, а относительные количества их атомов выражаются… … Большая советская энциклопедия
Один из осн. законов химии, заключающийся в том, что каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же хим. элементов, соединённых друг с другом в одних и тех же отношениях (по массе). П. с. з. был установлен… … Большой энциклопедический политехнический словарь
Каждое химическое соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллических соединений может быть и… … Энциклопедический словарь
Каждое хим. соединение, независимо от способа его получения, состоит из одних и тех же элементов, причём отношения их масс постоянны. Строго применим к газообразным и жидким соединениям. Состав кристаллич. соед. может быть и неременным (см.… … Естествознание. Энциклопедический словарь
Химия относится к разряду точных наук, и наряду с математикой и физикой устанавливает закономерности существования и развития материи, состоящей из атомов и молекул. Все процессы, протекающие как в живых организмах, так и среди объектов неживой природы, имеют в своей основе явления превращения массы и энергии. вещества, изучению которого будет посвящена эта статья, и лежит в основе протекания процессов в неорганическом и органическом мире.
Атомно-молекулярное учение
Чтобы понять суть законов, управляющих материальной действительностью, нужно иметь представление о том, из чего она состоит. По словам великого российского ученого М. В. Ломоносова «Во тьме должны пребывать физики и, особенно, химики, не зная внутреннего частиц строения». Именно он в 1741 году, сначала теоретически, а затем и подтвердив опытами, открыл законы химии, служащие основой для изучения живой и неживой материи, а именно: все вещества состоят из атомов, способных образовывать молекулы. Все эти частицы находятся в непрерывном движении.

Открытия и ошибки Дж. Дальтона
Спустя 50 лет идеи Ломоносова стал развивать английский ученый Дж. Дальтон. Ученый выполнил важнейшие расчеты по определению атомных масс химических элементов. Это послужило главным доказательством таких предположений: массу молекулы и вещества можно вычислить, зная атомный вес частиц, входящих в её состав. Как Ломоносов, так и Дальтон считали, что, независимо от способа получения, молекула соединения всегда будет иметь неизменный количественный и качественный состав. Первоначально именно в таком виде был сформулирован закон постоянства состава вещества. Признавая огромный вклад Дальтона в развитие науки, нельзя умолчать о досадных ошибках: отрицании молекулярного строения простых веществ, таких как кислород, азот, водород. Ученый считал, что молекулы есть только у сложных Учитывая огромный авторитет Дальтона в научных кругах, его заблуждения негативно повлияли на развитие химии.

Как взвешивают атомы и молекулы
Открытие такого химического постулата, как закон постоянства состава вещества, стало возможным благодаря представлению о сохранении массы веществ, вступивших в реакцию и образовавшихся после нее. Кроме Дальтона, измерение атомных масс проводил И. Берцелиус, составивший таблицу атомных весов химических элементов и предложивший современное их обозначение в виде латинских букв. В настоящее время массу атомов и молекул определяют с помощью Результаты, полученные в данных исследованиях, подтверждают существующие законы химии. Ранее ученые использовали такой прибор, как масс-спектрометр, но усложненная методика взвешивания явилась серьёзным недостатком в спектрометрии.

Почему так важен закон сохранения массы веществ
Сформулированный М. В. Ломоносовым выше названный химический постулат доказывает тот факт, что во время реакции атомы, входящие в состав реагентов и продуктов, никуда не исчезают и не появляются из ничего. Их количество сохраняется без изменения до и после Так как масса атомов константна, данный факт логически приводит к закону сохранения массы и энергии. Более того, ученый декларировал эту закономерность, как всеобщий принцип природы, подтверждающий взаимопревращение энергии и постоянство состава вещества.
Идеи Ж. Пруста как подтверждение атомно-молекулярной теории
Обратимся к открытию такого постулата, как закон постоянства состава. Химия конца 18 - начала 19 века - наука, в рамках которой велись научные споры между двумя французскими учеными, Ж. Прустом и К. Бертолле. Первый утверждал, что состав веществ, образовавшихся в результате химической реакции, зависит главным образом от природы реагентов. Бертолле был уверен, что на состав соединений - продуктов реакции влияет еще и относительное количество взаимодействующих между собой веществ. Большинство химиков в начале исследований поддержали идеи Пруста, который сформулировал их следующим образом: состав сложного соединения всегда постоянный и не завит от того, каким способом оно было получено. Однако дальнейшее исследование жидких и твердых растворов (сплавов) подтвердило мысли К. Бертолле. К этим веществам закон постоянства состава был неприменим. Более того, он не действует для соединений с ионными кристаллическими решетками. Состав этих веществ зависит от методов, которыми их добывают.
Каждое химическое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Эта формулировка характеризует закон постоянства состава вещества, предложенный Ж. Прустом в 1808 году. В качестве доказательств он приводит следующие образные примеры: малахит из Сибири имеет такой же состав, как и минерал, добытый в Испании; в мире есть только одно вещество киноварь, и не имеет значения, из какого месторождения она получена. Таким образом Пруст подчеркивал постоянство состава вещества, независимо от места и способа его добычи.
Не бывает правил без исключений
Из закона постоянства состава следует, что при образовании сложного соединения химические элементы соединяются друг с другом в определённых весовых соотношениях. Вскоре в химической науке появились сведения о существовании веществ, имеющих переменный состав, который зависел от способа получения. Русский ученый М. Курнаков предложил назвать эти соединения бертоллидами, например оксид титана, нитрид циркония.

У этих веществ на 1 весовую часть одного элемента приходится различное количество другого элемента. Так, в бинарном соединении висмута с галлием на одну весовую часть галлия приходится от 1,24 до 1,82 части висмута. Позже химики установили, что, кроме соединения металлов друг с другом, вещества, не подчиняющиеся закону постоянства состава, есть в таком как оксиды. Бертоллиды характерны также для сульфидов, карбидов, нитридов и гидридов.
Роль изотопов
Получив в свое распоряжение закон постоянства вещества, химия как точная наука смогла увязать весовую характеристику соединения с изотопным содержанием элементов, образующих его. Вспомним, что изотопами считают атомы одного химического элемента с одинаковыми протонными, но различными нуклонными числами. Учитывая наличие изотопов, понятно, что весовой состав соединения может быть переменным при условии постоянства элементов, входящих в это вещество. Если элемент увеличивает содержание какого-либо изотопа, то и весовой состав вещества тоже изменяется. Например, обычная вода содержит 11 % водорода, а тяжелая, образованная его изотопом (дейтерием), - 20 %.
Характеристика бертоллидов
Как мы уже выяснили ранее, законы сохранения в химии подтверждают основные положения атомно-молекулярной теории и являются абсолютно верными для веществ постоянного состава - дальтонидов. А бертоллиды имеют границы, в которых возможно изменение весовых частей элементов. Например, в оксиде четырёхвалентного титана на одну весовую часть металла приходится от 0,65 до 0,67 части кислорода. Вещества непостоянного состава не их кристаллические решетки состоят из атомов. Поэтому химические формулы соединений лишь отражают границы их состава. У различных веществ они разные. Температура также может влиять на интервалы изменения весового состава элементов. Если два химических элемента образуют между собой несколько веществ - бертоллидов, то для них также неприменим и закон кратных отношений.

Из всех вышеприведенных примеров сделаем вывод: теоретически в химии присутствуют две группы веществ: с постоянным и переменным составом. Наличие в природе этих соединений служит прекрасным подтверждением атомно-молекулярного учения. А вот сам закон постоянства состава уже не является доминирующим в химической науке. Зато он наглядно иллюстрирует историю её развития.
Уже к началу XIX в. накопилось много данных о составе отдельных веществ и их изменениях. Развитие техники количественных измерений и методов химического анализа позволило определять соотношения элементов в соединениях. Французский химик Ж. Пруст (1754–1826) после тщательнейших экспериментов с рядом веществ установил закон постоянства состава – один из основных законов химии.
Согласно закону постоянства состава, всякое чистое вещество, независимо от способов его получения и нахождения в природе, имеет постоянный качественный и количественный состав .
Это означает, что все соединения содержат элементы в строго определенных весовых пропорциях, независимо от способа получения, Так, например, сернистый газ, полученный сжиганием серы, или действием кислот на сульфиты, или любым другим способом, всегда содержит одну весовую часть серы и одну весовую часть кислорода.
Закон постоянства состава веществ был установлен в результате семилетнего спора между Прустом и его оппонентом, французским химиком К. Бертолле (1748–1822), утверждавшим, что состав соединений зависит от способа их получения.
Бертолле в результате анализа растворов, которые он считал химическими соединениями, сделал общий вывод о существовании химических соединений переменного состава. Получалось, что два элемента могут образовать непрерывный ряд соединений с изменяющимися свойствами и составом.
Пруст утверждал, что состав чистого вещества всегда один и тот же, любое химическое вещество имеет всегда одни и те же свойства, одинаковую температуру плавления, кипения, удельный вес. Пруст заявлял, что природа даже через посредство людей никогда не производит соединений иначе, как только по весу и мере. Одни и те же соединения имеют всегда тождественный состав. Внешний их вид может быть различен, но свойства – никогда. Нет разницы между окисью железа из южного полушария и из северного, хлористое серебро из Перу совершенно тождественно хлористому серебру из Сибири; во всем мире имеется только один хлористый натрий, одна селитра и т.д. Проделав в течение 1799–1887 гг. массу анализов, Пруст доказал справедливость своих выводов.
Дальнейшее развитие химии показало, что закон постоянства состава характеризует соединения с молекулярной структурой, состав же соединений с немолекулярной структурой (атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
В начале XX в. русский химик Курнаков, изучая сплавы металлов, открыл соединения переменного состава. В дальнейшем было выяснено, что соединения переменного состава встречаются также среди оксидов, соединений металлов с серой, азотом, углеродом, водородом а также – среди других неорганических веществ, имеющих кристаллическую структуру. Вещества переменного состава были названы бертоллидами , в отличие от соединений постоянного состава –дальтонидов . Для многих соединений переменного состава установлены пределы, в которых может изменяться их состав. Так, в диоксиде титанаTiO 2 на единицу массы титана может приходиться от0,65 до0,67 единиц массы кислорода, что соответствует формулеТi O 1,9 – 2,0 ( таб.4.1 ).
Таблица 4.1
|
ДАЛЬТОНИДЫ (вещества постоянного состава) примеры соединений |
БЕРТОЛЛИДЫ (вещества переменного состава) примеры соединений |
||||
|
H 2 O |
C Cl 4 |
CO 2 |
Ti O 1,9 – 2,0 |
V O 0,9 –1,3 |
|
Таким образом, закон постоянства состава, в отличие от закона сохранения массы вещества, не является столь всеобщим. Однако для своего времени закон постоянства состава имел фундаментальное значение. Он привел к мысли о существовании молекул и подтвердил неделимость атомов. В самом деле, почему в сернистом газе весовое отношение серы и кислорода всегда 1:1 , а не1,1:0,9 или0,95:1.05 ? Этот результат легко объяснить, если предположить, что атомы серы соединяются с определенным числом атомов кислорода и образуют частицы сернистого газа (эти частицы впоследствии были названы молекулами).
I. НОВЫЙ МАТЕРИАЛ
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г
Он писал: "От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь".
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа(II), мы смешивали железо
и серу в соотношении 7:4. . Если смешать их в другой пропорции, например 10:4, то
химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему
наблюдается такая закономерность? Известно, что в сульфиде железа(II) на каждый
один атом железа приходится один атом серы
(демонстрация кристаллической решетки, рис.). Следовательно,
для реакции нужно брать вещества в таких массовых соотношениях, чтобы
сохранялось соотношение атомов железа и серы (1:1). Поскольку численные
значения атомных масс
Fe, S и их относительных атомных масс A r
(Fe),
A r
(S) совпадают, можно записать:A r
(Fe):A r
(S)
= 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать
массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным
составом.
Рис. Кристаллическая решетка сульфида железа(II)
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые - бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н 2 О, НCl, ССl 4 , СO 2 . Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
II. На основе закона постоянства состава можно производить различные
расчёты.
Задача №1
В каких массовых отношениях соединяются химические элементы в серной кислоте,
химическая формула которой H 2 SO 4 ?
Решение:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H
2 SO
4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2: 32: 64 = 1: 16: 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо
взять 1 г - Н, 16 г - S и 32 г - О.
Задача №2
Водород соединяется с серой в массовых отношениях 1: 16. Используя данные об
относительных атомных массах этих элементов, выведите химическую формулу
сероводорода.
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле - х, а серы - у: Н
х S
у
m(H) : m(S) = хAr(H) : уAr(S)= х1: у32 = (2*1) : (1*32) = 2: 32 = 1: 16
Следовательно, формула сероводорода Н
2 S
Задача №3
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и
кислорода соответственно равны 2:1:2?
Решение:
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле - х, серы - у, а кислорода - z: Cu
x S
y O
z
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64: y32: z16 = (1*64) :
(1*32) : (4*16) = 64:32:64 = 2:1:2
III. РЕШИТЕ
ЗАДАЧИ
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H 2 CO 3 .
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1: 8?
№3. Углерод и кислород в углекислом газе соединяются
в массовых отношениях 3: 8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
 Система воинских званий в российской императорской армии
Система воинских званий в российской императорской армии Самая маленькая армия в мире Вооруженные силы Турции
Самая маленькая армия в мире Вооруженные силы Турции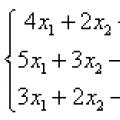 Метода гаусса: примеры решения слау
Метода гаусса: примеры решения слау