Uchuvchi vodorod birikmalari. Noorganik kimyo Uchuvchi vodorod birikmalari
Ikkilik birikmalar.
"Bi" ikkita degan ma'noni anglatadi. Ikkilik birikmalar ikkita CE atomlaridan iborat.
Oksidlar.
Ikki ChE dan tashkil topgan ikkilik birikmalar, ulardan biri kislorod oksidlanish holatida - 2 ("minus" ikki) deyiladi oksidlar.
Oksidlar - bu juda keng tarqalgan birikma turi er qobig'i va koinotda.
Oksidlarning nomlari sxema bo'yicha hosil bo'ladi:
Oksidning nomi = "oksid" + genitiv holatda elementning nomi + (oksidlanish darajasi - Rim raqami), agar o'zgaruvchan bo'lsa, doimiy bo'lsa, uni qo'ymang.
Oksidlarga misollar. Ba'zilar bor ahamiyatsiz (tarixiy) Ism.
1. H 2 O - vodorod oksidli suv
CO 2 - uglerod oksidi (IV) karbonat angidrid (karbonat angidrid)
CO - uglerod oksidi (II) uglerod oksidi (uglerod oksidi)
Na 2 O - natriy oksidi
Al 2 O 3 - alyuminiy oksidi alumina
CuO - mis (II) oksidi
FeO - temir (II) oksidi
Fe 2 O 3 - temir (III) oksidi gematit (qizil temir rudasi)
Cl 2 O 7 - xlor (VII) oksidi
Cl 2 O 5 - xlor (V) oksidi
Cl 2 O - xlor (I) oksidi
SO 2 - oltingugurt oksidi (IV) oltingugurt dioksidi
SO 3 - oltingugurt oksidi (VI)
CaO - kaltsiy oksidi so'nmagan ohak
SiO 2 - kremniy oksidi qumi (kremniy)
MnO - marganets (II) oksidi
N2O- nitrat oksidi (I) "kulgan gaz"
NO- azot oksidi (II)
N2O3- azot oksidi (III)
NO2-azot oksidi (IV) "tulki dumi"
N2O5 - azot oksidi (V)
Kimyoviy elementning oksidlanish darajasini hisobga olgan holda indekslarni formulaga joylashtiramiz:
Oksidlarni yozing, CE oksidlanish darajalarini joylashtiring. Nomi bo'yicha tuza olish oksid formulasi.
Boshqa ikkilik birikmalar.
Uchuvchi vodorod birikmalari.

Pastki qismida PSda "Uchuvchi vodorod birikmalari" gorizontal chiziq mavjud.
U erda formulalar keltirilgan: RH4 RH3 RH2 RH
Har bir formula o'z guruhiga tegishli.
Masalan, uchuvchi vodorod birikmasi N(azot) formulasini yozing.
Biz uni PSda topamiz va V guruh ostida qanday formula yozilganligini ko'ramiz.
RH3 bor. R o'rniga biz azot elementini almashtiramiz, bu chiqadi ammiak NH3.
"8" dan oldin azotga 3 ta elektron kerak bo'lganligi sababli, ularni uchta vodoroddan tortib oladi, azotning oksidlanish darajasi -3, vodorodniki esa +;
SiH4 - yoqimsiz hidli rangsiz silan gazi.
PH3 - chirigan baliq hidiga ega fosfin zaharli gaz
AsH 3 - sarimsoq hidli arsin zaharli gaz
H2S - vodorod sulfidi chirigan tuxumlarning hidiga ega zaharli gazdir
HCl - vodorod xlorid suvdagi eritmasi havoga chiqadigan o'tkir hidli gazga xlorid kislotasi deyiladi; U me'da shirasida kichik konsentratsiyalarda topiladi.
NH3 ammiak kuchli bezovta qiluvchi hidli gaz.
Uning suvdagi eritmasi deyiladi ammiak.
Metall gidridlar.
Uyda: 19-band, masalan. 3.4 yozma ravishda. Eslatmalardan formulalarni, ularning hosil bo'lishini, binar birikmalarning nomlarini bilish.

] uni molekulaning asosiy holati bilan bog'liq bo'lgan 0-0 o'tish zonasi sifatida talqin qildi. U bir xil elektron o'tishga 620 nm (0-1) va 520 nm (1-0) da zaifroq bantlarni bog'ladi. Nevin [42NEV, 45NEV] 568 va 620 nm (5677 va 6237 Å) da bantlarning aylanish va nozik tuzilishini tahlil qildi va 7 P - 7 S elektron o'tish turini aniqladi. Keyingi ishlarda [48NEV/DOY, 52NEV/CON, 57HAY/MCC] MnH va MnD ning 7 P - 7 S (A 7 P - X 7 S +) o'tishlarining yana bir nechta bantlarining aylanish va nozik tuzilishi tahlil qilindi.
Lazerli spektroskopiya usullari yuqori aniqlik marganets izotopida 55 Mn (I = 2,5) va 1 H protonda (I =) yadro spinining mavjudligi tufayli 0-0 A 7 P - X 7 S + diapazonidagi chiziqlarning yuqori nozik tuzilishini tahlil qilish imkonini berdi. 1/2) [ 90VAR/FIE, 91VAR/FIE, 92VAR/GRA, 2007GEN/STE].
IQ va binafsha rang spektrli hududlarda bir nechta MnH va MnD diapazonlarining aylanish va nozik tuzilishi [88BAL, 90BAL/LAU, 92BAL/LIN] da tahlil qilindi. Tasmalar umumiy pastki elektron holatga ega bo'lgan to'rtta kvintet o'tishga tegishli ekanligi aniqlandi: b 5 n i - a 5 S + , c 5 S + - a 5 S + , d 5 n i - a 5 S + va e 5. S + - a 5 S +.
Ishlarda MnH va MnD ning tebranish-aylanish spektri olindi. X 7 S + ning tuproqli elektron holatida tebranish o'tishlarining (1-0), (2-1), (3-2) aylanish va nozik tuzilishi tahlili o'tkazildi.
Past haroratli matritsadagi MnH va MnD spektrlari [78VAN/DEV, 86VAN/GAR, 86VAN/GAR2, 2003WAN/AND] da oʻrganilgan. Qattiq argon [78VAN/DEV, 2003WAN/AND], neon va vodorod [2003WAN/AND] tarkibidagi MnH va MnD ning tebranish chastotalari gaz fazasida DG 1/2 qiymatiga yaqin. Matritsa siljishining kattaligi (MnH ~ 11 sm -1 uchun argonda maksimal) nisbatan ionli aloqaga ega bo'lgan molekulalar uchun xosdir.
[78VAN/DEV] da olingan elektron paramagnit rezonans spektri asosiy holat 7 S simmetriyasini tasdiqladi. [78VAN/DEV] da olingan oʻta nozik tuzilma parametrlari elektron-yadroviy qoʻsh rezonans spektrini tahlil qilishda [86VAN/GAR, 86VAN/GAR2] da aniqlangan.
MnH- va MnD-anionlarining fotoelektron spektri [83STE/FEI] da olingan. Spektr neytral molekulaning asosiy holatiga o'tishlarni ham, T 0 = 1725±50 sm -1 va 11320±220 sm -1 energiya bilan qo'zg'alganlarni aniqlaydi. Birinchi qo'zg'alilgan holat uchun v = 0 dan v = 3 gacha tebranish progressiyasi kuzatildi va tebranish konstantalari w e = 1720±55 sm -1 va w e aniqlandi. x e = 70±25 sm -1. Qo'zg'atilgan holatlarning simmetriyasi aniqlanmagan, faqat nazariy tushunchalar asosida taxmin qilingan [83STE/FEI, 87MIL/FEI]; Keyinchalik elektron spektrdan [88BAL, 90BAL/LAU] olingan ma'lumotlar va nazariy hisoblar natijalari [89LAN/BAU] bir ma'noda fotoelektron spektridagi qo'zg'atilgan holatlar 5 S + va b 5 N i ekanligini ko'rsatdi.
MnH ning ab initio hisob-kitoblari ishlarda turli usullar yordamida amalga oshirildi [73BAG/SCH, 75BLI/KUN, 81DAS, 83WAL/BAU, 86CHO/LAN, 89LAN/BAU, 96FUJ/IWA, 2003WAN/AND, 2004RIN/05/ PET, 2006FUR/ PER, 2006KOS/MAT]. Barcha ishlarda asosiy holatning parametrlari olingan bo'lib, ular mualliflarning fikriga ko'ra, eksperimental ma'lumotlarga juda mos keladi.
Termodinamik funktsiyalarni hisoblash quyidagilarni o'z ichiga oladi: a) asosiy holat X 7 S + ; b) eksperimental kuzatilgan hayajonlangan holatlar; c) [89LAN/BAU] da hisoblangan d 5 D va B 7 S + holatlari; d) 40000 sm -1 gacha bo'lgan molekulaning boshqa bog'langan holatlarini hisobga olgan holda sintetik (hisoblangan) holatlar.
MnH va MnD ning asosiy holatining tebranish konstantalari [52NEV/CON, 57HAY/MCC] va juda yuqori aniqlik bilan [89URB/JON, 91URB/JON, 2005GOR/APP] da olingan. Jadvalda Mn.4 qiymatlari [2005GOR/APP] dan olingan.
MnH va MnD ning asosiy holatining aylanish konstantalari [42NEV, 45NEV, 48NEV/DOY, 52NEV/CON, 57HAY/MCC, 74PAC, 75KOV/PAC, 89URB/JON, 91URB/JON/ORGRAG0, 922Vda olingan. /APP, 2007GEN /STE]. B0 qiymatlaridagi farqlar 0,001 sm -1, B e - 0,002 sm -1 oralig'ida. Ular turli xil o'lchov aniqligi va turli xil ma'lumotlarni qayta ishlash usullari bilan bog'liq. Jadvalda Mn.4 qiymatlari [2005GOR/APP] dan olingan.
Kuzatilgan qo'zg'aluvchan holatlarning energiyalari quyidagicha olingan. Davlat uchun 5 S + qiymati T 0 [ 83STE/FEI ] dan olingan (matndagi yuqoriga qarang). Jadvaldagi boshqa kvintet davlatlar uchun. Mn.4 T 0 a 5 S + qiymatlari T = 9429,973 sm -1 va T = 11839,62 sm -1 [ 90BAL/LAU ], T 0 = 20880,56 sm -1 va T 0 = 22331.2 qiymatlarini qo'shish orqali olingan energiyalar Mn.4. sm -1 berilgan [92BAL/LIN]. Davlat uchun A 7 P [84HU/GER] dan T e qiymatini ko'rsatadi.
Davlat energiyasi d[89LAN/BAU] da hisoblangan 5 D 2000 sm -1 ga kamayadi, bu holatning tajriba va hisoblangan energiyasi oʻrtasidagi farqga toʻgʻri keladi. b 5 n i. B 7 S + ning energiyasi eksperimental energiyaga qo'shilishi bilan baholanadi A 7 P potentsial egri chiziqlar grafigida bu holatlarning energiya farqlari [89LAN/BAU].
MnH ning qo'zg'atilgan holatlarining tebranish va aylanish konstantalari termodinamik funktsiyalarni hisoblashda ishlatilmadi va ma'lumot uchun Mn.4-jadvalda keltirilgan. Tebranish konstantalari [ 83STE/FEI ] (a 5 S +), [ 90BAL/LAU ] () maʼlumotlariga koʻra berilgan. c 5 S +), [ 92BAL/LIN ] ( d 5 i, e 5 S +), [ 84HUY/GER ] ( A 7 N). Aylanish konstantalari [90BAL/LAU] maʼlumotlariga koʻra berilgan ( b 5 i, c 5 S +), [ 92BAL/LIN ] (a 5 S + , d 5 i, e 5 S +), [ 92VAR/GRA ] ( B 0 va D 0 A 7 P) va [ 84HUGH/GER ] (a 1 A 7 N).
Kuzatilmagan elektron holatlarning energiyalarini baholash uchun Mn + H - ion modeli ishlatilgan. Modelga ko'ra, 20000 sm -1 dan past bo'lgan molekulada allaqachon hisobga olingan holatlardan boshqa holatlar mavjud emas, ya'ni. tajribada kuzatilgan va/yoki hisoblangan holatlar [89LAN/BAU]. 20000 sm -1 dan yuqori model uchta ionli konfiguratsiyaga mansub ko'p sonli qo'shimcha elektron holatlarni bashorat qiladi: Mn + (3d 5 4s)H - , Mn + (3d 5 4p)H - va Mn + (3d 6)H - . Bu davlatlar [2006KOS/MAT] da hisoblangan davlatlar bilan yaxshi taqqoslanadi. Model bo'yicha taxmin qilingan holatlarning energiyalari qisman aniqroqdir, chunki ular eksperimental ma'lumotlarni hisobga oladi. 20000 sm -1 dan yuqori baholangan holatlarning ko'pligi tufayli ular bir necha energiya darajalarida sintetik holatlarga birlashtirilgan (Mn.4-jadvalga qarang).
MnH(g) termodinamik funksiyalar (1.3) - (1.6) , (1.9) , (1.10) , (1.93) - (1.95) tenglamalar yordamida hisoblangan. Qadriyatlar Q int va uning hosilalari (1.90) - (1.92) tenglamalari yordamida o'n to'rtta qo'zg'aluvchan holatni hisobga olgan holda hisoblab chiqilgan. Q kol.vr ( i) = (p i /p X)Q kol.vr ( X). X 7 S + holatining tebranish-aylanma bo'linish funktsiyasi va uning hosilalari energiya darajalari bo'yicha to'g'ridan-to'g'ri yig'ish yo'li bilan (1.70) - (1.75) tenglamalar yordamida hisoblangan. Hisob-kitoblar barcha energiya darajalarini qiymatlari bilan hisobga oldi J< J max , v , qaerda J max ,v (1.81) shartlardan topildi. X 7 S + holatining tebranish-aylanish darajalari (1.65) tenglamalar, koeffitsientlar qiymatlari yordamida hisoblab chiqilgan. Y Bu tenglamalardagi kl 55 Mn 1 H molekulyar konstantalardan vodorod izotoplarining tabiiy aralashmasiga mos keladigan izotopik modifikatsiya uchun (1.66) munosabatlari yordamida hisoblab chiqilgan. Mn.4. Koeffitsient qiymatlari Y kl , shuningdek miqdorlar v maksimal va J lim jadvalda keltirilgan. Mn.5.
MnH(g) hisoblangan termodinamik funksiyalardagi asosiy xatolar hisoblash usuli bilan aniqlanadi. Φº( qiymatlaridagi xatolar T) da T= 298,15, 1000, 3000 va 6000 K mos ravishda 0,16, 0,4, 1,1 va 2,3 J×K‑1×mol‑1 deb baholanadi.
MnH(g) termodinamik funktsiyalari ilgari [74SCH] da 5000 K gacha bo'lgan qo'zg'alish holatlarini hisobga olmasdan va [da 6000 K gacha bo'lgan qo'zg'alish holatlarini hisobga olmasdan hisoblangan.
D° 0 (MnH) = 140 ± 15 kJ× mol‑1 = 11700 ± 1250 sm‑1.
Umumiy ko'rinish
Marganets - IV davr kichik guruhining VIIB elementi. Elektron tuzilma atom 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2, birikmalardagi eng xarakterli oksidlanish darajalari +2 dan +7 gacha.
Marganets juda keng tarqalgan element bo'lib, er qobig'ining 0,1% (massa ulushi) ni tashkil qiladi. Tabiatda faqat birikmalar shaklida uchraydi, asosiy minerallar piroluzit (marganets dioksidi) MnO2.), gauskanit Mn3O4 va jigarrang Mn2O3.
Jismoniy xususiyatlar
Marganets kumushsimon oq, qattiq, mo'rt metalldir. Uning zichligi 7,44 g/sm 3, erish nuqtasi 1245 o S. Marganetsning to'rtta kristalli modifikatsiyasi ma'lum.
Kimyoviy xossalari
Marganets - faol metall, bir qator kuchlanishlarda alyuminiy va sink o'rtasida. Havoda marganets yupqa oksidli plyonka bilan qoplangan bo'lib, u qizdirilganda ham uni keyingi oksidlanishdan himoya qiladi. Mayda ezilgan holatda marganets osongina oksidlanadi.
3Mn + 2O 2 = Mn 3 O 4– havoda kalsinlangandaXona haroratidagi suv marganetsga juda sekin ta'sir qiladi, lekin qizdirilganda u tezroq ta'sir qiladi:
Mn + H 2 O = Mn(OH) 2 + H 2U suyultirilgan xlorid va nitrat kislotalarda, shuningdek issiq sulfat kislotada (sovuqda) eriydi. H2SO4 u amalda erimaydi):
Mn + 2HCl = MnCl 2 + H 2 Mn + H 2 SO 4 = MnSO 4 + H 2Kvitansiya
Marganets quyidagilardan olinadi:
1. eritmaning elektrolizlanishi MnSO 4. Elektrolitik usulda ruda qaytariladi va keyin sulfat kislota va ammoniy sulfat aralashmasida eritiladi. Olingan eritma elektrolizga duchor bo'ladi.
2. uning oksidlaridan kremniy bilan elektr pechlarida qaytarilishi.
Ilova
Marganets ishlatiladi:
1. qotishma po'latlar ishlab chiqarishda. 15% gacha marganetsni o'z ichiga olgan marganets po'lati yuqori qattiqlik va mustahkamlikka ega.
2. marganets magniy asosidagi bir qator qotishmalarning bir qismidir; ularning korroziyaga chidamliligini oshiradi.
Magran oksidlari
Marganets to'rtta oddiy oksid hosil qiladi - MnO, Mn2O3, MnO2 Va Mn2O7 va aralash oksid Mn3O4. Birinchi ikkita oksid asosiy xususiyatlarga ega, marganets dioksidi MnO2 amfoter va undan yuqori oksid Mn2O7 permanganik kislota angidrididir HMnO4. Marganets (IV) hosilalari ham ma'lum, ammo tegishli oksidi MnO3 olinmagan.
Marganets (II) birikmalari
Oksidlanish darajasi +2 marganets (II) oksidiga to'g'ri keladi MnO, marganets gidroksidi Mn(OH) 2 va marganets (II) tuzlari.
Marganets (II) oksidi boshqa marganets oksidlarini vodorod bilan qaytarish orqali yashil kukun shaklida olinadi:
MnO 2 + H 2 = MnO + H 2 Oyoki marganets oksalati yoki karbonatning havo kirishisiz termal parchalanishi paytida:
MnC 2 O 4 = MnO + CO + CO 2 MnCO 3 = MnO + CO 2Ishqorlar marganets (II) tuzlari eritmalariga ta'sir qilganda marganets gidroksid Mn(OH)2 ning oq cho'kmasi cho'kadi:
MnCl 2 + NaOH = Mn(OH) 2 + 2NaClHavoda u tezda qorayadi va jigarrang marganets (IV) gidroksid Mn (OH) 4 ga oksidlanadi:
2Mn(OH) 2 + O 2 + 2H 2 O =2 Mn(OH) 4Marganets (II) oksidi va gidroksid asosiy xususiyatga ega va kislotalarda oson eriydi:
Mn(OH)2 + 2HCl = MnCl 2 + 2H 2 OMarganets (II) tuzlari marganets suyultirilgan kislotalarda eritilganda hosil bo'ladi:
Mn + H 2 SO 4 = MnSO 4 + H 2- qizdirilgandayoki kislotalarning turli xil tabiiy marganets birikmalariga ta'siri bilan, masalan:
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 OQattiq shaklda marganets (II) tuzlari pushti rangga ega, bu tuzlarning eritmalari deyarli rangsizdir;
Oksidlovchi moddalar bilan o'zaro ta'sirlashganda, barcha marganets (II) birikmalari qaytaruvchi xususiyatga ega.
Marganets (IV) birikmalari
Eng barqaror marganets (IV) birikmasi quyuq jigarrang marganets dioksididir. MnO2. Pastki oksidlanish jarayonida ham, yuqori marganets birikmalarining qaytarilishida ham oson hosil bo'ladi.
MnO2- amfoter oksid, lekin kislotali va asosli xususiyatlar juda zaif ifodalangan.
Kislotali muhitda marganets dioksidi kuchli oksidlovchi vositadir. Konsentrlangan kislotalar bilan qizdirilganda quyidagi reaktsiyalar sodir bo'ladi:
2MnO 2 + 2H 2 SO 4 = 2MnSO 4 + O 2 + 2H 2 O MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 OBundan tashqari, ikkinchi reaksiyaning birinchi bosqichida birinchi navbatda beqaror marganets (IV) xlorid hosil bo'ladi, keyin u parchalanadi:
MnCl 4 = MnCl 2 + Cl 2Birlashganda MnO2 Manganitlar ishqorlar yoki asosiy oksidlar bilan olinadi, masalan:
MnO 2 + 2KOH = K 2 MnO 3 + H 2 OO'zaro aloqada bo'lganda MnO2 konsentrlangan sulfat kislota bilan marganets sulfat hosil bo'ladi MnSO4 va kislorod chiqariladi:
2Mn(OH) 4 + 2H2SO 4 = 2MnSO 4 + O 2 + 6H 2 OO'zaro ta'sir MnO2 kuchli oksidlovchi moddalar bilan marganets (VI) va (VII) birikmalarining hosil bo'lishiga olib keladi, masalan, kaliy xlorat bilan eritilganda kaliy manganat hosil bo'ladi:
3MnO 2 + KClO 3 + 6KOH = 3K2MnO 4 + KCl + 3H 2 Ova nitrat kislota - marganets kislotasi ishtirokida poloniy dioksidga ta'sir qilganda:
2MnO 2 + 3PoO 2 + 6HNO 3 = 2HMnO 4 + 3Po(NO 3) 2 + 2H 2 OMnO 2 ning qo'llanilishi
Oksidlovchi vosita sifatida MnO2 xlorid kislotadan xlor ishlab chiqarishda va quruq galvanik elementlarda ishlatiladi.
Marganets (VI) va (VII) birikmalari
Marganets dioksidi kaliy karbonat va nitrat bilan eritilganda yashil qotishma olinadi, undan kaliy manganatning quyuq yashil kristallarini ajratib olish mumkin. K2MnO4- juda beqaror permanganik kislota tuzlari H2MnO4:
MnO 2 + KNO 3 + K 2 CO 3 = K 2 MnO 4 + KNO 2 + CO 2suvli eritmada manganatlar o'z-o'zidan marganets kislotasi HMnO4 (permanganatlar) tuzlariga aylanadi va bir vaqtning o'zida marganets dioksidi hosil bo'ladi:
3K 2 MnO 4 + H 2 O = 2KMnO 4 + MnO 2 + 4KOHbunda eritmaning rangi yashildan qip-qizil ranggacha o'zgaradi va to'q jigarrang cho'kma hosil bo'ladi. Ishqor borligida manganatlar kislotali muhitda barqaror bo'lib, manganatning permanganatga o'tishi juda tez sodir bo'ladi.
Kuchli oksidlovchi moddalar (masalan, xlor) manganat eritmasiga ta'sir qilganda, ikkinchisi butunlay permanganatga aylanadi:
2K 2 MnO 4 + Cl 2 = 2KMnO 4 + 2KClKaliy permanganat KMnO4- permanganik kislotaning eng mashhur tuzi. U to'q binafsha rangli kristallar kabi ko'rinadi, suvda o'rtacha eriydi, barcha marganets (VII) birikmalari kabi, kaliy permanganat kuchli oksidlovchi vositadir. Koʻpgina organik moddalarni oson oksidlaydi, temir (II) tuzlarini temir (III) tuzlariga aylantiradi, oltingugurt kislotani sulfat kislotaga oksidlaydi, xlorid kislotadan xlor chiqaradi va hokazo.
Oksidlanish-qaytarilish reaksiyalarida KMnO4(ion MnO4-) turli darajada tiklanishi mumkin. Muhitning pH qiymatiga qarab, qaytarilish mahsuloti ion bo'lishi mumkin Mn 2+(kislotali muhitda), MnO2(neytral yoki ozgina ishqoriy muhitda) yoki ion MnO4 2-(yuqori ishqoriy muhitda), masalan:
KMnO4 + KNO 2 + KOH = K 2 MnO 4 + KNO 3 + H 2 O- yuqori ishqoriy muhitda 2KMnO 4 + 3KNO 2 + H 2 O = 2MnO 2 + 3KNO 3 + 2KOH- neytral yoki ozgina gidroksidi 2KMnO 4 + 5KNO 2 + 3H 2 SO 4 = 2MnSO 4 + K 2 SO 4 + 5KNO 3 + 3H 2 O- kislotali muhitdaQuruq shaklda qizdirilganda, kaliy permanganat taxminan 200 o C haroratda tenglama bo'yicha parchalanadi:
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2Permanganatlarga mos keladigan erkin permanganat kislotasi HMnO4 suvsiz holatda olinmagan va faqat eritmada ma'lum. Uning eritmasi konsentratsiyasini 20% gacha oshirish mumkin. HMnO4- suvli eritmada ionlarga butunlay ajraladigan juda kuchli kislota.
Marganets (VII) oksidi yoki marganets angidridi, Mn2O7 kaliy permanganatga konsentrlangan sulfat kislota ta'sirida tayyorlanishi mumkin: 2KMnO 4 + H 2 SO 4 = Mn 2 O 7 + K 2 SO 4 + H 2 O
Marganets angidridi yashil-jigarrang yog'li suyuqlikdir. Bu juda beqaror: qizdirilganda yoki yonuvchan moddalar bilan aloqa qilganda, u marganets dioksidi va kislorodga aylanadi.
Kaliy permanganat energetik oksidlovchi sifatida keng qo'llaniladi kimyoviy laboratoriyalar va sanoat, u ham dezinfektsiyalovchi sifatida xizmat qiladi kaliy permanganatning termal parchalanish reaktsiyasi kislorod ishlab chiqarish uchun ishlatiladi.
Vodorodning marganetsdagi eruvchanligini birinchi tizimli tadqiqotlar Luckemeyer-Hasse va Schenkga tegishli. Ular eruvchanlikning o'zgarishi a⇔b transformatsiyasi bilan birga borishini ko'rsatdi. Ular sanoat darajasidagi marganets bilan tajriba o'tkazganligi sababli, ularning natijalari yuqori toza marganets bo'yicha olib borilgan keyingi ishlarda aniqlangan miqdoriy qiymatlarga mos kelmasligi ajablanarli emas.
20 dan 1300 ° gacha bo'lgan harorat oralig'ida batafsil tadqiqotlar marganets distillatida Sieverts va Moritz, shuningdek, Potter va Lukens tomonidan elektrolitik distillangan marganets bo'yicha o'tkazildi. Ikkala holatda ham vodorodning avval to'liq gazsizlangan metall bilan muvozanatdagi bosimi turli haroratlarda o'lchandi.
Ikkala tadqiqot ham juda o'xshash natijalarga erishdi. Shaklda. 79-rasmda Sieverts va Moritz ma'lumotlari sof marganetsning ikkita namunasini isitish va sovutish paytida 20 dan 1300 ° gacha bo'lgan harorat oralig'ida 100 g marganets tomonidan adsorbsiyalangan vodorod hajmiga oid ma'lumotlarini ko'rsatadi.
Marganetsning a-modifikatsiyasida vodorodning eruvchanligi avval pasayadi, keyin esa harorat oshishi bilan ortadi. Vodorodning b-marganetsdagi eruvchanligi a-marganetsga qaraganda sezilarli darajada yuqori, shuning uchun b→a o'zgarishi vodorod adsorbsiyasining sezilarli darajada oshishi bilan birga keladi. b-marganetsda eruvchanligi harorat bilan ortadi.
b→g transformatsiyasi vodorodning eruvchanligining ortishi bilan ham kechadi, u g-marganetsda, shuningdek, b-marganetsda harorat bilan ortadi. Transformatsiya eruvchanlikning pasayishi bilan birga keladi. Vodorodning d-marganetsdagi eruvchanligi erish nuqtasiga qadar ortadi va suyuq marganetsdagi vodorodning eruvchanligi marganetsning qattiq holatda har qanday modifikatsiyasida eruvchanligidan sezilarli darajada yuqori.
Shunday qilib, marganetsning turli xil allotropik modifikatsiyalarida vodorodning eruvchanligining o'zgarishi allotropik o'zgarishlarning haroratlarini, shuningdek, isitish va sovutishning turli tezligida ularning histerezini o'rganishning oddiy va oqlangan usulini ishlab chiqishga imkon beradi.
Potter va Lukens natijalari, umuman olganda, Sieverts va Moritz natijalariga juda yaqin, buni jadvaldagi ma'lumotlarni o'rganish orqali ko'rish mumkin. 47. Natijalarning izchilligi juda yaxshi, xona haroratidan 500° gacha bo'lgan harorat oralig'ida a fazadagi eruvchanlikning o'zgarishi bundan mustasno: Sieverts va Moritz eruvchanlik Potter ma'lumotlaridan kelib chiqqan holda ancha yuqori ekanligini aniqladilar. va Lukens. Ushbu kelishmovchilikning sababi aniq emas.

Potter va Lukens doimiy haroratda vodorodning (V) eruvchanligi bosimga (P) bog'liqlikka qarab o'zgarishini aniqladilar:
bu yerda K doimiydir.
Hech bir tadqiqotchi marganets gidridini topmagan.
Elektrolitik marganetsdagi vodorod miqdori. Elektr cho'kishi paytida vodorod katodga to'planganligi sababli, olingan metallda vodorod bo'lishi ajablanarli emas.
Elektrolitik marganetsning vodorod tarkibi va uni olib tashlash bilan bog'liq masalalar Potter, Hayes va Lukens tomonidan o'rganilgan. Biz sanoat tozaligining oddiy elektrolitik marganetsini o'rgandik, u ilgari xona haroratida uch oy davomida saqlanadi.
Chiqarilgan (chiqarilgan) vodorod hajmini o'lchash 1300 ° gacha bo'lgan haroratlarda amalga oshirildi; natijalar rasmda ko'rsatilgan. 80.
200 ° ga qizdirilganda juda oz gaz chiqariladi, lekin allaqachon 300 ° da juda muhim hajm chiqariladi. 400° da bir oz ko'proq chiqariladi, lekin keyinchalik qizdirilganda ajralib chiqqan vodorod miqdori biroz o'zgaradi, marganetsning allotropik o'zgarishi tufayli eruvchanligi o'zgargan hollar bundan mustasno.
Marganets tarkibida 100 g metallga taxminan 250 sm3 vodorod borligi aniqlangan. Oddiy bosimdagi havoda 1 soat davomida 400 ° ga qizdirilganda, olib tashlash mumkin bo'lgan miqdorning 97% chiqariladi. Kutilganidek, tashqi bosimning pasayishi bilan bir xil miqdordagi vodorodni olib tashlash uchun isitishning qisqa muddati talab qilinadi.
Marganetsda mavjud bo'lgan vodorod o'ta to'yingan interstitsial qattiq eritma hosil qiladi, deb ishoniladi. Vodorodning a-marganetsning panjara parametrlariga ta'siri Potter va Huber tomonidan o'rganilgan; 100 g metallga 1 sm3 vodorodda 0,0003% ni tashkil etadigan panjaraning ma'lum bir kengayishi (ko'payishi) kuzatiladi (48-jadval).
Vodorodni olib tashlash uchun isitish panjaraning siqilishiga (qisqarishiga) olib keladi (49-jadval).
Yuqori vodorod miqdori bo'lgan namunalarda panjara parametrlarini aniq o'lchash juda qiyin, chunki loyqa diffraktsiya naqsh olinadi. Potter va Xuber buni gazning metallda bir xil taqsimlanmaganligi bilan izohlaydi. Bu loyqalik vodorod miqdori ortishi bilan ko'paymaydi va hatto vodorod miqdori yuqori bo'lganda bir oz kamayadi. 100 g ga 615 sm3 dan ortiq vodorod miqdori bilan elektrolitik marganetsni olish mumkin emasligi aniqlandi, bu a-marganetsning bir hujayrasiga ikkita vodorod atomiga to'g'ri keladi. Vodorodning metallda bir xil taqsimlanishi bilan elementar panjaralarning teng darajada buzilishini kutish mumkin va diffraktsiya naqshida aniq chiziqlar bo'lishi kerak.
Eng muhim marganets birikmalari di-, tetra- va etti valentli marganetsning hosilalaridir. Bir valentli marganetsning hosilalaridan faqat M5 siyanotuzlari ma'lum (bu erda M ishqoriy metall kationidir). Bu tuzlar Mn(P) siyanid kompleksini elektrokimyoviy yoki natriy amalgam bilan kamaytirish orqali olinadi. Suyuq ammiakda Mn (I) siyanid kompleksining yanada kamayishi mumkin, bu M6 birikmasining hosil bo'lishiga olib keladi, bu erda marganets nol valentlikka ega. Mn(I) komplekslari Mn(CO) 5 SCN ni neytral ligandlar - aminlar, fosfinlar, arsinlar bilan reaksiyaga kiritish orqali olingan.
Mn(P) tuzlari pushti rangga ega boʻlib, asosan suvda, ayniqsa, xlorid, nitrat, sulfat, atsetat va tiosiyanatda yaxshi eriydi. Bir oz eriydigan birikmalarga sulfid, fosfat va karbonat kiradi. Neytral yoki ozgina kislotali suvli eritmalarda Mn(P) ] 2+ da Mn(H 2 0), koʻproq kislotali eritmalarda esa [Mn(H 2 0) 4 ] 2+ kompleks ion hosil qiladi.
Mn(III) tuzlari intensiv rangga ega va murakkab birikmalar hosil qilishga juda moyil. Ular beqaror va oson gidrolizlanadi. Mn(IV) birikmalari beqaror. Mn02, MnF 4 va Mn(SO 4) 2 kabi barqaror Mn(IV) birikmalariga faqat bir nechta misollar keltirish mumkin. Kislotali eritmalarda Mn(IV) ioni kamayadi, lekin kuchli oksidlovchi moddalar ishtirokida u permanganat ioniga oksidlanadi. Mn (V) hosilalaridan faqat tuzlari ma'lum - ba'zi faol metallarning gipomanganatlari - Li, Na, K, Sr va Ba. Na 3 Mn0 4 Mn0 2 va NaOH (1: 3) aralashmasini kislorodli atmosferada 800° C da saqlash yoki kislorod oqimida Mn 2 0 3 bilan NaOH reaksiyaga solish natijasida olinadi. Suvsiz tuz toʻq yashil rangga ega, kristall gidratlar Na 3 Mn0 4 *7H 2 0 koʻk, Na 3 Mn0 4 *10H 2 0 esa osmon koʻk rangga ega. LiMn0 3 tuzi suvda erimaydi, NaMn0 3 va KMn0 3 tuzlari esa yaxshi eriydi, lekin qisman gidrolizlanadi.
Qattiq holatda ishqoriy metallarning manganatlari (VI) ma'lum bo'lib, ular quyuq yashil, deyarli qora kristallar hosil qiladi. Kaliy manganat K 2 Mn0 4 suvsiz kristallanadi, natriy manganat uchun esa 4, 6, 10 ta suv molekulalari bo'lgan kristallgidratlar ma'lum. Ishqoriy metall manganatlar suyultirilgan ishqor eritmalarida oson eriydi, bunday eritmalar yashil rangga ega; Toza suv va kuchsiz kislotalar ularni reaksiyaga ko‘ra parchalaydi:
3MnO 4 2- +4H + ↔ 2 MnO 4 - +Mn0 2 + 2H 2 0.
Ko'rinishidan, bu jarayon erkin permangan kislotasi H 2 Mn0 4 beqaror ekanligi bilan bog'liq, ammo uning dietil efirida barqarorligi haqida dalillar mavjud. Eng muhim Mn(VII) birikmalari MMP0 4 permanganatlardir (bu yerda M ishqoriy metall kationidir). KMn0 4 K 2 Mn0 4 elektrolitik oksidlanish natijasida olinadi. Jadvalda 8-rasmda gidroksidi metall permanganatlarning suvda eruvchanligi ko'rsatilgan.
8-jadval
Ishqoriy metall permanganatlarning suvda eruvchanligi
Permanganat Ca(Mn0 4) 2 * 5H 2 0 suvda oson eriydi va ichimlik suvini sterilizatsiya qilish uchun ishlatiladi. Quyidagi marganets oksidlari ma'lum: MnO - marganets oksidi yoki oksidi; MP 2 0 3 - marganets sesquioksidi; Mn0 2 - marganets dioksidi; Mn0 3 - marganets trioksidi yoki marganets angidrid; MP 2 0 7 - marganets yarim oksidi yoki marganets angidridi; MP 3 0 4 - qizil marganets oksidi deb ataladigan oraliq marganets oksidi. Barcha marganets oksidlari, MnO dan tashqari, HCl ta'sirida xlor chiqaradi. Kons. H 2 S0 4 qizdirilganda marganets oksidlarini eritib, kislorod chiqaradi va MnS0 4 ni hosil qiladi.
Mn (P) oksidi kulrang-yashildan to quyuq yashil ranggacha bo'lgan soyalarga ega yashil kukun. MnO vodorod yoki azot atmosferasida marganets karbonat yoki oksalatni kaltsiylash, shuningdek, yuqori oksidlarni gidrazin, vodorod yoki uglerod oksidi bilan qaytarish orqali olinadi. Mn(II) gidroksid ishqoriy metallar gidroksidlari ta'sirida Mn(II) eritmalaridan jelatinsimon oq cho'kma holida ajralib chiqadi. Mn(OH) 2 havoda barqaror.
Qora Mn 2 0 3 Mn0 2 havoda 550-900 ° S gacha qizdirilganda yoki Mn(II) tuzlarini kislorod yoki havo oqimida kalsinlanganda hosil bo'ladi. Mn 2 0 3 vodorod oqimida taxminan 230 ° C haroratda qizdirilganda, birinchi navbatda Mn 3 0 4 ga o'tish sodir bo'ladi va 300 ° C dan yuqori haroratlarda yashil monooksidga qaytarilish sodir bo'ladi. Mn 2 0 3 kislotalarda eritilganda Mn(III) tuzlari yoki Mn(P) va Mn0 2 tuzlari hosil boʻladi (kislota va haroratning tabiatiga qarab).
Mn(III)-Mn 2 0 3* H 2 0 oksidigidrat yoki marganets metagidroksidi MnO(OH) tabiatda manganit holida uchraydi. MP0 2 - qattiq
to'q kulrang yoki deyarli qora rang - havoda Mn(N0 3) 2 ni ehtiyotkorlik bilan kaltsiylash yoki ishqoriy muhitda kaliy permanganatni kamaytirish natijasida olinadi. Mn0 2 suvda erimaydi. 530° C dan yuqori kuyganda Mn 3 0 4 ga aylanadi; Mn0 2 oltingugurt kislotasi bilan oson reaksiyaga kirishib, marganets ditionat hosil qiladi.
Sovuq kon. H 2 S0 4 Mn0 2 ga ta'sir qilmaydi; 110°C gacha qizdirilganda Mn 2 (S0 4) 3, undan yuqori haroratda Mn 2 (S0 4) 3 MnS0 4 ga aylanadi. Marganets dioksidi gidrat Mn(P) tuzlarini oksidlash yoki manganatlar yoki permanganatlarni ishqoriy eritmalarda qaytarish natijasida olinadi. MnO(OH) 2 yoki H 2 Mn0 3 qora yoki qora-jigarrang kukun, suvda deyarli erimaydi. MnO, Mn 2 0 3 va Mn 0 2 aralashmasidan MnO ni (NH 4) 2 S0 4 ning 6N eritmasi bilan tanlab eritish orqali ajratish mumkin. MnO NH 4 C1 eritmasida ham yaxshi eriydi. Mn 2 0 3 ni Mn0 2 dan metafosfor kislotasining kons. eritmasi yordamida ajratish mumkin. H 2 S0 4. Mn0 2 bu eritmada uzoq vaqt qizdirilganda ham erimaydi. Mn0 2 oksidlovchi moddalar ishtirokida ishqorlar bilan eritilganda marganot kislotasi H 2 Mn0 4 -manganatlar tuzlari hosil bo'ladi. Manganat eritmalarini kislotalash jarayonida ajralib chiqadigan erkin H 2 Mn0 4 juda beqaror va quyidagi sxema bo'yicha parchalanadi:
ZN 2 Mn0 4 = 2NMp0 4 + Mn0 2 + 2N 2 0.
MP 2 0 7 kons. taʼsirida olinadi. KMP0 4 da H 2 S0 4. Bu og'ir, porloq, yashil-jigarrang yog'li modda bo'lib, oddiy haroratda barqaror va qizdirilganda portlovchi parchalanadi. IN katta miqdorda sovuq suv Mn 2 0 7 eriydi va HMn0 4 (kontsentratsiyasining 20% gacha) hosil qiladi. Toʻq binafsha rangli gigroskopik kristallar NMp0 4, shuningdek NMp0 4* 2N 2 0 0,3 qoʻshilishi bilan olinadi. M H 2 S0 4 dan 0,3 gacha M eritmasi Ba(Mn0 4) 2 haroratda<1° С с последующим удалением избытка воды и охлаждением смеси до - 75° С . При этой температуре НМп0 4 устойчива, выше +3° С она быстро разлагается. Кристаллическая НМп0 4 *2Н 2 0 устойчива при комнатной температуре в течение 10-30 мин.
Ftoridlar. MnF 2 MnCO 3 ni gidroflorik kislota bilan reaksiyaga kiritish orqali olinadi, ftor suyultirilgan HFda eriydi, kons. HCl va HN0 3. 20°C da suvda eruvchanligi 1,06 g/100 ni tashkil qiladi G. MnF 2 beqaror tetragidrat MnF 2 * 4H 2 0 hosil qiladi, oson parchalanadigan ammiak 3MnF 2 * 2NH 3 va gidroksidi metall ftoridlari bilan - qo'sh tuzlar MF * MnF 2 (bu erda M ishqoriy metall kationidir).
MnJ 3 yagona ma'lum Mn(III) galogenid - sharob-qizil qattiq modda bo'lib, 250 ° C da MnJ 2 ga ftor ta'sirida, Mn 2 0 3 HFda eritilganda yoki KMn0 4 Mn( bilan reaksiyaga kirishganda hosil bo'ladi. P) HF ishtirokida tuz. MnF 3 * 2H 2 0 shaklida kristallanadi. MnF 3 reaksiyaga ko'ra suv bilan parchalanadi.
2MnF 3 + 2H 2 0 = Mn0 2 + MnF 2 + 4HF.
Ishqoriy metall ftoridlari bilan MnF 3 qo'sh tuzlar MF*MnF 3 va 2MF*MnF 3 hosil qiladi (bu erda M ishqoriy metall kationidir). Mn(IV) ftorid birikmalaridan faqat 2MF*MnF 4 va MF*MnF 4 qoʻsh tuzlari maʼlum boʻlib, ular oltin-sariq shaffof jadval shaklidagi kristallardir. Suv 2KF*MnF 4 ni parchalab, Mn0 2* oq ajraladi.
Xloridlar. Suvsiz MnCl 2 quruq HCl ning oksid, karbonat yoki metall marganetsga ta'sirida, shuningdek, xlor oqimida metall marganetsni yoqish orqali olinadi. Mn(II) xlorid MnCl 2* 4H 2 0 shaklida kristallanadi, u ikki modifikatsiyada mavjud. MnS1 2* 2H 2 0, MnS1 2* 5H 2 0, 3MnS1 2 *5H 2 O, MnS1 2* 6H 2 0 kristall gidratlari ham maʼlum MnS1 2 suvda yaxshi eriydi (72,3 g/100 g 2 da). ) va mutlaq spirtda. Kislorod oqimida MnCl 2 Mn 2 0 3 ga aylanadi va HC1 oqimida 1190° S da bug'lanadi. MnCl 2 ishqoriy metall xloridlari bilan
MCl*Mns1 2 qoʻsh tuzlarini hosil qiladi. Quyidagi asosiy tuzlar olindi: MnOHCl, Mn 2 (OH) 3 Cl, Mn 3 (OH) 6 Cl. Xlorid komplekslari [Mn(H 2 0) 5 Cl] +, [Mn(H 2 0) 2 Cl 4 ] 2- va boshqalar mavjudligi aniqlangan. Komplekslarning tarkibi eritmadagi Cl - konsentratsiyasiga bog'liq, shuning uchun [Cl - ]>0,3 da. M[Cl - ]>5 M ─ [Mn(H 2 0) 2 C1 4 ] 2- da [Mn(H 2 0) 9 C1]+ kompleksi hosil boʻladi. Barqarorlik konstantalari [MnS1] + , [MnS1 2 ] va [MnS1 3 ] - mos ravishda 3,85 0,15 ga teng; 1,80 0,1 va 0,44 0,08. MnS1 3 noma'lum, lekin M 2 MnS1 6 qo'sh tuzlari olingan.
K 2 MpC1 5 reaksiya natijasida olinadi:
KMp0 4 + 8HC1 + KS1 = K 2 MpCl 5 + 2C1 2 + 4H 2 0.
MnCl 4 birinchi bo'lib piroluzit konsentratsiyada eritilganda hosil bo'ladi. Biroq, HCl xlorni yo'q qilish bilan darhol parchalanadi. M 2 MpS1 6 birikmalari barqarorroq.
K 2 MpCl 6 yuqori darajada sovutilgan 40% li HC1 ga kaltsiy permanganat va kaliy xlorid eritmalarini qo'shish orqali olinadi.
Ca (Mn0 4) 2 + 16HC1 + 4KS1 = 2K 2 MnCl 5 + CaCl 2 + 8H 2 0 + 3Cl 2.
Xuddi shu birikma KMn0 4 ni konsentratsiyada dietil efir bilan kamaytirish orqali olinadi. NS1. Ma'lum bo'lgan oksixloridlar MnOC1 3, Mn0 2 C1 2,
Bromidlar. MpVg 2 ko'rinish va xossalari MnS1 2 ga juda o'xshash. Biroq, bromidlarning qo'sh tuzlar hosil qilish qobiliyati xloridlarga qaraganda ancha past. MnBr 2 bir, ikki, to'rt yoki oltita suv molekulasi bilan kristalli gidratlar hosil qiladi. MnBr 2* 4H 2 0 ning suvda 0°C da eruvchanligi 127 g/100 ni tashkil qiladi. G. MpBr 3 va uning qo'sh tuzlari noma'lum.
Yodidlar. MnJ 2 ham MnCl 2 ga o'xshaydi, faqat u umuman qo'sh tuz hosil qilish qobiliyatiga ega emas, MnJ 2 bir, ikki, to'rt, olti, sakkiz yoki to'qqizta suv molekulasi bilan kristall gidrat hosil qiladi; MnJ 2 ishqoriy metallar siyanidlari bilan oʻzaro taʼsirlashganda qoʻsh tuzlar MnJ 2 *3MCN hosil boʻladi. MnJ 3 va uning qo'sh tuzlari olinmadi.
Nitratlar. Mn(N0 3) 2 MnC0 3 ga HN0 3 ta’sirida olinadi. Mn(N0 3) 2 bir, uch yoki oltita suv molekulasi bilan kristallanadi. Mn(N0 3) 2* 6H 2 0 - xira pushti ignasimon prizmalar, suvda va spirtda oson eriydi. 160-200° da Mn0 2 hosil qilib parchalanadi. Mn(N0 3) 2 ning 18°C da suvda eruvchanligi 134 g/100 g suvsiz tuz 9 molekulagacha ammiak qo‘shishi mumkin. Mn(N0 3) 2 fraksiyonel kristallanish yo'li bilan REE nitratlar bilan oson qo'sh tuzlar hosil qiladi.
Sulfatlar. Eng barqaror Mn(II) birikmalardan biri boʻlgan MnS0 4 deyarli barcha Mn(II) birikmalarni sulfat kislota bilan bugʻlanganda hosil boʻladi. MnS0 4 sharoitga qarab bir, to'rt, besh yoki etti suv molekulasi bilan kristallanadi. MnS0 4* 5H 2 0 - qizg'ish kristallar, suvda juda oson eriydi va spirtda erimaydi. Suvsiz MnS0 4 - oq maydalangan, mo'rt kristalli massa. Bir valentli metallar va ammoniy sulfatlari bilan MnS0 4 osongina qo'sh tuzlar M 2 S0 4 *MnSO 4 hosil qiladi. S0 4 2 - tarkibi , 2 - va 4 - turg'unlik konstantalari mos ravishda 8,5 ga teng bo'lgan Mn(II) komplekslarning hosil bo'lishi o'rnatildi; 9; 9.3. Mn 2 (S0 4) 3 Mn(III) oksidi yoki gidroksidni suyultirilgan H 2 S0 4 bilan reaksiyaga kiritish orqali olinadi. Mn 2 (S0 4) 3 H 2 S0 4 4H 2 0 shaklida kristallanadi. Kuchli qizdirilganda u Mn 2 (S0 4) 3 ga aylanadi, u juda gigroskopik va H 2 S0 4 da eriydi. Ishqoriy metall sulfatlar bilan Mn 2 (S0 4) 3 ikki qator qo'sh tuzlarni hosil qiladi: M 2 S0 4 *Mn 2 (S0 4) 3 va M, shuningdek, alum kabi tuzlar. Eng barqaror seziy alumi CsMn(S0 4) 2 *12H 2 0. Bundan tashqari, Fe(III), Cr(III), Al(III) bilan qoʻsh tuzlar Mn 2 (S0 4) 3 mavjud.
Mn(S0 4) 2 MnS0 4 ni kaliy permanganat bilan 50-60° S da oksidlash natijasida olinadi. Mn(S0 4) 2 H 2 S0 4 da (50-80%) eriydi va toʻq jigarrang eritma hosil qiladi. Suyultirilgan sulfat kislota va suvda u gidrolizlanib, MnO(OH) 2 ajralib chiqadi.
Sulfitlar. MnSO 3 MnSO 3 ni tarkibida S0 2 bo'lgan suv bilan reaksiyaga kiritish orqali olinadi. Suvda ozgina eriydi. 70° C dan past haroratda MnS0 3 trigidrat, yuqori haroratlarda esa monohidrat shaklida kristallanadi. Ishqoriy metall sulfitlari bilan MnS0 3 qo'sh tuzlar M 2 S0 3 MnS0 3 hosil qiladi.
Sulfidlar. MnS ammoniy sulfid yoki ishqoriy metallar sulfidlarining Mn(II) tuzlaridagi eritmalari taʼsirida olinadi. Uzoq vaqt davomida turganda yoki qizdirilganda, quyuq rangli cho'kma yashil rangning yanada barqaror modifikatsiyasiga aylanadi. MnS ning uchta modifikatsiyasi ma'lum. -MnS - kub sistemaning yashil kristallari (alabadin), -MnS - kub sistemaning qizil kristallari, -MnS - olti burchakli tizimning qizil kristallari. MnS eng yaxshi eriydigan sulfidlardan biridir, chunki kationlarning elektron tuzilishi o'zgarishi bilan ularning sulfidlarining suvda eruvchanligi o'zgaradi:
Fosfatlar. Mn(II) tuzlarining neytral eritmalaridan natriy fosfat ortiqcha boʻlgan marganets ortofosfatning kristalligidrati Mn 3 (P0 4) 2* 7H 2 0 boʻshashgan oq choʻkma shaklida choʻkma hosil boʻladi. Boshqa sharoitlarda boshqa fosfatlarni olish mumkin: di- va metafosfatlar, shuningdek kislota fosfatlari. Mn(P) tuzlari eritmasiga ammoniy xlorid va fosfat va oz miqdorda ammiak qo‘shilsa, mukammal kristallanadigan qo‘sh tuz – marganets – ammoniy fosfat NH 4 MnP0 4 *H 2 0 hosil bo‘ladi. Bu reaksiya gravimetrik analizda qo‘llaniladi. marganetsni aniqlash uchun. Bir nechta Mn(III) fosfatlar ma'lum va ular orasida ortofosfat MnP0 4* H 2 0 kulrang-yashil rangga, metafosfat Mn(P0 3) 8 esa qizil rangga ega. NH 4 MnP 2 0 7 empirik formulali marganets binafsharang kukun pigmentini tayyorlash tasvirlangan. Bu modda 120-340°S haroratda koʻk rangli beqaror mahsulot hosil boʻlishi bilan parchalanadi, u oʻz navbatida 340-460° da [Mn 2 (P 4 0 12)] va [Mn 3 (P 3 0 9) 2 ga parchalanadi. ]. Yangi cho`kmaga tushgan Mn(OH) 3 H 3 P0 3 eritmasi bilan o`zaro ta`sirlashganda qizil-binafsha rangli H[Mn(NR0 3) 2 ]*ZN 2 0 cho`kma hosil bo`ladi. Marganets fosfatlari suvda erimaydi.
Fosfidlar. Marganets fosfidlarining xossalari jadvalda keltirilgan. 9. Marganets monofosfidi qizil fosfor va elektrolitik marganets aralashmasini vakuumda sublimatsiyalangan, Mn 2 P va MnP tarkibida Mn 2 0 3 va natriy fosfat bo'lgan eritmalarni elektroliz qilish orqali olinadi. Marganets fosfidlari nitrat kislota va akva regiyada eriydi va fosfor miqdori kamayishi bilan eruvchanligi ortadi.
9-jadval
Marganets fosfidlarining xossalari
|
Kristal tuzilishi |
T. pl., °C |
||
|
Tetragonal | |||
|
Rombik | |||
|
kub | |||
|
Rombik |
Silisidlar. Yarim o'tkazgich xususiyatlarga ega bo'lgan marganets silisidi MnSi 1,72 ning tarkibi yaqinda takomillashtirildi.
Arsenatlar. Oddiy marganets arsenatlari Mn 3 (As0 4) 2 H 2 0, MnHAs0 4* H 2 0 va Mn(H 2 As0 4) 2, shuningdek qoʻsh tuzlar maʼlum.
NH 4 MnAs0 4 *6H 2 0.
Gidridlar. Marganets elektrodlari orasidagi vodoroddagi elektr zaryadsizlanishi sharoitida beqaror MnH gidridining hosil bo'lishining belgisi mavjud. Yuqori uchuvchan marganets penta-karbonilgidrid MnH(CO) 5 olindi, unda infraqizil spektrlarni o'rganishga ko'ra vodorod to'g'ridan-to'g'ri marganets bilan bog'langan. Rangsiz birikma, mp. -24,6 ° S.
Nitridlar. Marganets nitridlarining fizik va kimyoviy xossalari juda kam o'rganilgan. Bu beqaror birikmalardir (7-jadvalga qarang) va qizdirilganda azotni osongina chiqaradi. Mn 2 N va Mn 3 N 2 vodorod bilan qizdirilganda ammiak hosil bo'ladi. Mn 4 N kuchli ferromagnit xususiyatlarga ega. Mn 3 N 2 marganets amalgamasini quruq azotli muhitda qizdirish orqali olinadi.
Boridlar. Marganets boridlari MnV, MnV 2, MnV 4, Mn 2 V, Mn 3 V 4 va Mn 4 V borligi aniqlangan, ulardagi bor miqdori ortishi bilan kimyoviy qarshilik va erish nuqtasi ortadi. Marganets boridlari elektrolitik marganets kukunlarining briketlangan aralashmalarini tozalangan bor bilan tozalangan argonda 900-1350 ° S haroratda sinterlash orqali olingan. Barcha marganets boridlari oson eriydi. xlorid kislotasi, ulardagi bor miqdori ortishi bilan erish tezligi kamayadi.
Karbonatlar. MnCO 3 *H 2 0 monohidrat Mn(P) tuzining CO 2 toʻyingan eritmasidan natriy kislota karbonati bilan choʻktirish yoʻli bilan olinadi; atmosfera kislorodi bo'lmaganda bosim ostida isitish orqali suvsizlanadi. MnCO 3 ning suvda eruvchanligi past (PR = 9 * 10-11). Quruq holatda havoda barqaror, ho'l bo'lganda Mn 20 3 hosil bo'lishi tufayli oson oksidlanadi va qorayadi. Mn (P) tuzlari va boshqa metallarning eruvchan karbonatlarining o'zaro ta'siri odatda asosiy marganets karbonatlarini hosil qiladi.
Peroksid hosilalari. Mn(IV) peratsid H 4 Mn0 7 [NOMP(OOH) 3] ning jigarrang-qora tuzlari shaklida ma'lum. Ularni KMn0 4 ning kuchli sovutilgan ishqoriy eritmasiga H 2 0 2 ta’sirida olish mumkin. KOH ning past konsentratsiyasida K 2 H 2 Mn0 7, ko'proq konsentrlangan eritmalarda - K 3 HMn0 7 hosil bo'ladi. Ikkala ulanish ham barqaror emas.
Geteropoliyali birikmalar. Mn(P) Mo0 3 bilan geteropolitik birikma (NH 4) 3 H 7 *3H 2 0, W0 3 bilan Mn(IV) Na 2 H 6 birikma hosil qiladi.
Asetatlar. MnCO 3 ning sirka kislotadagi eritmasidan Mn(C 2 H 3 O 2) 2* 4H 2 0 havoda turg’un bo’lgan och qizil ignalar shaklida kristallanadi. Suvli eritmadan Mn(C 2 H 3 0 2) 2 ikkita suv molekulasi bilan kristallanadi. Oxirgi birikma quruq havoda barqaror, lekin suv ta'sirida gidrolizga uchraydi. Mn(C 2 H 3 0 2) 3 Mn (C 2 H 3 0 2) 2 ni kaliy permanganat yoki xlor bilan oksidlash orqali olinadi. Faqat suvsiz Mn(C 2 H 3 0 2) 3 atsetat maʼlum, u oson gidrolizlanadi.
Oksalatlar. MnS 2 0 4 oksalat kislotasi va Mn(P) tuzlarining issiq eritmalarini reaksiyaga kiritish natijasida olinadi. Sovuqda u uchta suv molekulasi bilan kristallanadi. Havoda MpS 2 0 4 ZN 2 0 beqaror boʻlib, MpS 2 0 4 -2H 2 0 ga aylanadi. Marganets oksalati suvda ishqoriy metall oksalatlari bilan qoʻsh tuzlar hosil qiladi M 2 C 2 0 4 -MnS 2 0; 4. MnS 2 0 4, [Mn(C 2 0 4) 2] 2- va [Mn(C 2 0 4) 3] 4] komplekslarining bosqichma-bosqich shakllanishi - mos ravishda 7 * 10 - 3, 1,26 * beqarorlik konstantalari bilan. 10 - o'rnatildi 2 va 1,77*10- 2 Marganets oksalatlari (III) faqat gidroksidi metallar bilan kompleks birikmalar shaklida ma'lum. Kaliy trioksalomanganat K 3 [Mn(C 2 0 4) 3 ]*3H 2 0 toʻq qizil prizma shaklida kristallanadi. Bu birikma yorug'lik yoki issiqlik ta'sirida parchalanadi. [Mn(C 2 0 4)] + , [Mn(C 2 0 4) 2 ]- va [Mn(C 2 0 4) 3 ] 3- komplekslarining beqarorlik konstantalari mos ravishda 1,05*10- 10 ga teng. ; 2,72*10-17; 3,82*10-20.
Formatlar. HCOO-tarkibi [Mn(HCOO)] + va [Mn(HCOO) 2 ] bo'lgan Mn(P) komplekslarning mos ravishda 3 va 15 barqarorlik konstantalari bilan hosil bo'lishi aniqlandi.
Mn(P) s sharob, limon, salitsil, olma va boshqa kislotalar suvli eritmada MP ning anionga nisbati 1: 1, etil spirti, aseton va dioksanda - 1: 2 nisbatda komplekslar hosil qiladi. Mn(P) ning murakkablashuvi askorbin kislotasi kislota. Ishqoriy muhitda hosil bo'lgan komplekslar mavjud umumiy formula n -, bu erda A - askorbin kislotaning anioni. BILAN koyevoy kislota Mn(P) kompleks birikmalar hosil qiladi [MnA(H 2 0) 2 ] + va MnA 2 (bu yerda A kojik kislota anioni), barqarorligi lg qiymatlari bilan tavsiflanadi. K l = 3,95 va lg K 2 = mos ravishda 2,83.
Kupferon marganets bilan yomon eriydigan birikma Mn(C 6 H 5 0 2 N 2) 2 hosil qiladi. Cho'kmaning eruvchanligi marganets tuzi va kupferonning ko'pligi bilan ortadi.
Formaldoksim ishqoriy muhitda Mn (P) bilan o'zaro qachon, u tez qizil-jigarrang, juda barqaror kompleks 2 ichiga havoda oksidlanadi rangsiz murakkab birikma beradi.
Natriy dietilditiokarbamat(DDTKNa) Mn(P) bilan och sariq choʻkma hosil qiladi, u havoda reagent ortiqcha boʻlganda qoʻngʻir-binafsharang kompleks Mn(DDTK) 3 ga aylanadi. Murakkab beqarorlik konstantasi
2,8*10-5. Marganets dietilditiokarbamatning turli erituvchilarda eruvchanligi jadvalda keltirilgan. 10.
10-jadval
Marganets dietilditiokarbamatning turli erituvchilarda eruvchanligi
|
Eritmoq |
Eruvchanlik |
Solvent |
Eruvchanlik |
||
|
g/100 ml hal qiluvchi |
g*mol/1000 ml hal qiluvchi |
g/100 ml hal qiluvchi |
g*mol/1000 ml hal qiluvchi |
||
|
Suv xloroform uglerod tetraklorid |
3,3*10- 4 0,364 0,202 |
Benzol butil asetat | |||
KompleksIII marganets (II) bilan Na 2 * 6H 2 0 kompleksini hosil qiladi - pushti rangga ega, suvda yaxshi eriydigan oq kristall modda.
Marganets kompleksonatlari ham ajratilgan - H 2 MnY*4H 2 0; (NH 4) 2 MnY*4H 2 O; Mn 2 Y*9H 2 0, bu yerda Y 4- etilendiamintetraasetik kislotaning anioni.
Boshqalar organik birikmalar marganets Metiltimol ko'k va ksilenol apelsin bilan marganets komplekslarining beqarorlik konstantalari mos ravishda 0,089 * 10-6 va 1,29 * 10-6 ni tashkil qiladi. Marganets ditizon bilan faqat pH > 7 da reaksiyaga kirishadi. Marganets ditizonatning tarkibi metallning ditizonga nisbati 1 ga teng: 2. Marganets 1-(2-piridilazo)-naftol-2 (PAN) bilan rangli kompleks birikmalar hosil qiladi, Suvda yomon eriydigan 4-(2-piridilazo)-resorbent (PAR), 8-gidroksixinolin (PAR bilan kompleksdan tashqari) organik erituvchilarda yaxshi eriydi va marganetsni fotometrik aniqlash uchun ishlatiladi. Marganetsni fotometrik aniqlash uchun uning benzol gidroksam kislotasi, antranilgidroksam kislotasi, tenoyltriftoratseton, tiooksin va boshqa organik reaktivlar bilan komplekslari ham qo'llaniladi. PAR va 9-salitsifluoron bilan marganets Mn-anion nisbati 1:2, beqarorlik konstantalari mos ravishda 3,9 * 10-12 va 5,5 * 10-14 bo'lgan komplekslarni hosil qiladi.
 Oziq-ovqat zanjirlari, oziq-ovqat tarmoqlari va trofik darajalar Oziq-ovqat tarmog'iga o'zingizning namunangizni yarating
Oziq-ovqat zanjirlari, oziq-ovqat tarmoqlari va trofik darajalar Oziq-ovqat tarmog'iga o'zingizning namunangizni yarating SSSRdagi kontslagerlar 1941 1945
SSSRdagi kontslagerlar 1941 1945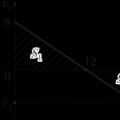 Bir zumda harakat tezligi
Bir zumda harakat tezligi