Ishqoriy metallarning xarakterli kimyoviy xossalari. Ishqoriy metallar Ishqorlarning nometallar bilan o'zaro ta'siriga misollar
Ishqoriy metallarga IA guruhi metallari kiradi Davriy jadval DI. Mendeleyev - litiy (Li), natriy (Na), kaliy (K), rubidiy (Rb), seziy (Cs) va fransiy (Fr). Ishqoriy metallarning tashqi energiya darajasida bitta valentlik elektron mavjud. Ishqoriy metallarning tashqi energiya darajasining elektron konfiguratsiyasi ns 1 ga teng. Ularning birikmalarida ular bitta oksidlanish darajasini +1 ko'rsatadi. OVRda ular kamaytirish agentlari, ya'ni. elektrondan voz keching.
Ishqoriy metallarning fizik xossalari
Barcha gidroksidi metallar engil (past zichlikka ega), juda yumshoq (Li bundan mustasno, ular pichoq bilan osongina kesiladi va folga ichiga o'raladi), past qaynash va erish nuqtalariga ega (zaryadning oshishi bilan). ishqoriy metall atomining yadrosi, erish nuqtasi kamayadi).
Erkin holatda Li, Na, K va Rb kumush-oq metallar, Cs oltin-sariq metalldir.
Ishqoriy metallar yopilgan ampulalarda kerosin yoki neft jeli qatlami ostida saqlanadi, chunki ular kimyoviy jihatdan yuqori reaktivdir.
Ishqoriy metallar yuqori issiqlik va elektr o'tkazuvchanligiga ega, bu esa mavjudligi bilan bog'liq metall aloqa va tanaga markazlashtirilgan kristall panjara
Ishqoriy metallarni tayyorlash
Barcha gidroksidi metallarni ularning tuzlari eritmasini elektroliz qilish orqali olish mumkin, ammo amalda faqat Li va Na shu tarzda olinadi, bu K, Rb, Cs ning yuqori kimyoviy faolligi bilan bog'liq:
2LiCl = 2Li + Cl 2
2NaCl = 2Na + Cl2
Har qanday gidroksidi metallni qaytaruvchi sifatida Ca, Mg yoki Si dan foydalangan holda, tegishli galogenidni (xlorid yoki bromid) kamaytirish orqali olish mumkin. Reaksiyalar qizdirilganda (600 – 900C) va vakuum ostida amalga oshiriladi. Ishqoriy metallarni shu tarzda olishning umumiy tenglamasi:
2MeCl + Ca = 2Me + CaCl 2,
qaerda Men metall.
Uning oksididan litiy olishning ma'lum usuli mavjud. Reaktsiya 300 ° C gacha qizdirish va vakuum ostida amalga oshiriladi:
2Li 2 O + Si + 2CaO = 4Li + Ca 2 SiO 4
Kaliy erigan kaliy gidroksidi va suyuq natriy o'rtasidagi reaksiya natijasida hosil bo'lishi mumkin. Reaktsiya 440 ° C gacha qizdirish orqali amalga oshiriladi:
KOH + Na = K + NaOH
Ishqoriy metallarning kimyoviy xossalari
Barcha gidroksidi metallar gidroksid hosil qiluvchi suv bilan faol o'zaro ta'sir qiladi. Ishqoriy metallarning yuqori kimyoviy faolligi tufayli suv bilan o'zaro ta'sir qilish reaktsiyasi portlash bilan birga bo'lishi mumkin. Lityum suv bilan eng tinch reaksiyaga kirishadi. Umumiy reaksiya tenglamasi:
2Me + H2O = 2MeOH + H2
qaerda Men metall.
Ishqoriy metallar atmosfera kislorodi bilan o'zaro ta'sirlanib, bir qancha turli birikmalar hosil qiladi - oksidlar (Li), peroksidlar (Na), superoksidlar (K, Rb, Cs):
4Li + O 2 = 2Li 2 O
2Na + O 2 = Na 2 O 2
Barcha ishqoriy metallar qizdirilganda nometallar (galogenlar, azot, oltingugurt, fosfor, vodorod va boshqalar) bilan reaksiyaga kirishadi. Masalan:
2Na + Cl 2 = 2NaCl
6Li + N 2 = 2Li 3 N
2Li +2C = Li 2 C 2
2Na + H 2 = 2NaH
Ishqoriy metallar murakkab moddalar (kislota eritmalari, ammiak, tuzlar) bilan ta'sir o'tkazishga qodir. Shunday qilib, gidroksidi metallar ammiak bilan o'zaro ta'sirlashganda, amidlar hosil bo'ladi:
2Li + 2NH 3 = 2LiNH 2 + H 2
Ishqoriy metallarning tuzlar bilan o'zaro ta'siri quyidagi printsip bo'yicha sodir bo'ladi - ular kamroq joy almashtiradi faol metallar(metallarning faollik qatoriga qarang) ularning tuzlaridan:
3Na + AlCl 3 = 3NaCl + Al
Ishqoriy metallarning kislotalar bilan o'zaro ta'siri noaniqdir, chunki bunday reaktsiyalar sodir bo'lganda, metall dastlab kislota eritmasi suvi bilan reaksiyaga kirishadi va bu o'zaro ta'sir natijasida hosil bo'lgan ishqor kislota bilan reaksiyaga kirishadi.
Ishqoriy metallar bilan reaksiyaga kirishadi organik moddalar, masalan, spirtlar, fenollar, karboksilik kislotalar:
2Na + 2C 2 H 5 OH = 2C 2 H 5 ONa + H 2
2K + 2C 6 H 5 OH = 2C 6 H 5 OK + H 2
2Na + 2CH 3 COOH = 2CH 3 COONa + H 2
Sifatli reaksiyalar
Ishqoriy metallarga sifatli reaksiya olovni ularning kationlari bilan bo'yashdir: Li + olovni qizil, Na + sariq va K +, Rb +, Cs + binafsha rangga bo'yadi.
Muammoni hal qilishga misollar
MISOL 1
| Mashq qilish | Na→Na 2 O→NaOH→Na 2 SO 4 kimyoviy o‘zgarishlarini amalga oshiring |
| Yechim | 4Na + O 2 →2Na 2 O Tuz 19 Tuz 1. Metall + Metall bo'lmagan. Inert gazlar bu o'zaro ta'sirga kirmaydi. Metall bo'lmagan metallning elektromanfiyligi qanchalik yuqori bo'lsa, u shunchalik ko'p metallar bilan reaksiyaga kirishadi. Masalan, ftor barcha metallar bilan, vodorod esa faqat faol metallar bilan reaksiyaga kirishadi. Metall metall faollik qatorida qanchalik chapga uzoqroq bo'lsa, u shunchalik ko'p nometallar bilan reaksiyaga kirishishi mumkin. Masalan, oltin faqat ftor bilan, litiy bilan - barcha metall bo'lmaganlar bilan reaksiyaga kirishadi. 2. Metall bo'lmagan + metall bo'lmagan. Bunday holda, ko'proq elektromanfiy bo'lmagan metall oksidlovchi vosita sifatida ishlaydi va kamroq elektronegativ bo'lmagan metall qaytaruvchi vosita sifatida ishlaydi. Elektromanfiyligi o'xshash bo'lgan metall bo'lmaganlar bir-biri bilan yomon o'zaro ta'sir qiladi, masalan, fosforning vodorod bilan va kremniyning vodorod bilan o'zaro ta'siri deyarli mumkin emas, chunki bu reaktsiyalarning muvozanati oddiy moddalar hosil bo'lishiga qarab siljiydi. Geliy, neon va argon metall bo'lmaganlar bilan reaksiyaga kirishmaydi, boshqa inert gazlar og'ir sharoitlarda ftor bilan reaksiyaga kirishishi mumkin. Kislorod xlor, brom va yod bilan o'zaro ta'sir qilmaydi. Kislorod past haroratlarda ftor bilan reaksiyaga kirishishi mumkin. 3. Metall + kislota oksidi. Metall nometallni oksiddan kamaytiradi. Keyin ortiqcha metall hosil bo'lgan nometall bilan reaksiyaga kirishishi mumkin. Masalan: 2Mg + SiO 2 = 2MgO + Si (magniy etishmovchiligi bilan) 2Mg + SiO 2 = 2MgO + Mg 2 Si (ortiqcha magniy bilan) 4. Metall + kislota. Vodorodning chap tomonidagi kuchlanish qatorida joylashgan metallar kislotalar bilan reaksiyaga kirishib, vodorodni chiqaradi. Istisno oksidlovchi kislotalar (konsentrlangan oltingugurt va har qanday nitrat kislotasi), reaktsiyalarda vodorodning o'ng tomonidagi kuchlanish seriyasida bo'lgan metallar bilan reaksiyaga kirishishi mumkin, vodorod ajralib chiqmaydi, lekin suv va kislotani kamaytirish mahsuloti olinadi; Shuni e'tiborga olish kerakki, metall ko'p asosli kislotaning ortiqcha bilan reaksiyaga kirishganda, kislota tuzi olinishi mumkin: Mg + 2H 3 PO 4 = Mg (H 2 PO 4) 2 + H 2. Agar kislota va metall o'rtasidagi o'zaro ta'sir mahsuloti erimaydigan tuz bo'lsa, u holda metall passivlanadi, chunki metall yuzasi kislota ta'siridan erimaydigan tuz bilan himoyalangan. Masalan, suyultirilgan sulfat kislotaning qo'rg'oshin, bor yoki kaltsiyga ta'siri. 5. Metall + tuz. Eritmada Bu reaktsiya magniyning o'ng tomonida, shu jumladan magniyning o'zi, lekin metall tuzining chap tomonidagi kuchlanish seriyasida joylashgan metallarni o'z ichiga oladi. Agar metall magniyga qaraganda faolroq bo'lsa, u tuz bilan emas, balki suv bilan reaksiyaga kirishib, gidroksidi hosil qiladi va keyinchalik tuz bilan reaksiyaga kirishadi. Bunday holda, asl tuz va hosil bo'lgan tuz eruvchan bo'lishi kerak. Erimaydigan mahsulot metallni passivlashtiradi. Biroq, ushbu qoidadan istisnolar mavjud: 2FeCl 3 + Cu = CuCl 2 + 2FeCl 2; 2FeCl 3 + Fe = 3FeCl 2. Temir oraliq oksidlanish darajasiga ega bo'lganligi sababli, uning eng yuqori oksidlanish darajasidagi tuzi oraliq oksidlanish darajasidagi tuzga osonlikcha qaytariladi, hatto kamroq faol metallarni oksidlaydi. Eritmalarda bir qator metall stresslar samarali emas. Tuz va metall o'rtasidagi reaktsiyaning mumkin yoki yo'qligini aniqlash faqat termodinamik hisoblar yordamida amalga oshirilishi mumkin. Masalan, natriy kaliyni kaliy xlorid eritmasidan siqib chiqarishi mumkin, chunki kaliy ko'proq uchuvchan: Na + KCl = NaCl + K (bu reaktsiya entropiya omili bilan belgilanadi). Boshqa tomondan, alyuminiy natriy xloriddan siljish orqali olingan: 3Na + AlCl 3 = 3NaCl + Al. Bu jarayon ekzotermik bo'lib, entalpiya omili bilan belgilanadi. Tuz qizdirilganda parchalanishi mumkin va uning parchalanish mahsulotlari metall, masalan, alyuminiy nitrat va temir bilan reaksiyaga kirishishi mumkin. Alyuminiy nitrat alyuminiy oksidi, azot oksidi (IV) ga qizdirilganda parchalanadi va kislorod, kislorod va azot oksidi temirni oksidlaydi: 10Fe + 2Al(NO 3) 3 = 5Fe 2 O 3 + Al 2 O 3 + 3N 2 6. Metall + asosiy oksid. Xuddi erigan tuzlarda bo'lgani kabi, bu reaksiyalarning imkoniyati ham termodinamik tarzda aniqlanadi. Alyuminiy, magniy va natriy ko'pincha qaytaruvchi moddalar sifatida ishlatiladi. Masalan: 8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe ekzotermik reaksiya, entalpiya omili 2 Al + 3Rb 2 O = 6Rb + Al 2 O 3 (uchuvchi rubidiy, entalpiya omili); 7. Metall bo'lmagan + asosiy oksid. Bu erda ikkita variant mavjud: 1) metall bo'lmagan - qaytaruvchi vosita (vodorod, uglerod): CuO + H 2 = Cu + H 2 O; 2) metall bo'lmagan - oksidlovchi vosita (kislorod, ozon, galogenlar): 4FeO + O 2 = 2Fe 2 O 3. 8. Metall bo'lmagan + asos. Qoida tariqasida, reaktsiya metall bo'lmagan va gidroksidi o'rtasida sodir bo'ladi: hamma ham metall bo'lmaganlar ishqorlar bilan reaksiyaga kirisha olmaydi: galogenlar (haroratga qarab turli yo'llar bilan), oltingugurt (qizdirilganda), kremniy, fosfor ekanligini yodda tutish kerak. ushbu o'zaro ta'sirga kirish. 2KOH + Cl 2 = KClO + KCl + H 2 O (sovuqda) 6KOH + 3Cl 2 = KClO 3 + 5KCl + 3H 2 O (issiq eritmada) 6KOH + 3S = K 2 SO 3 + 2K 2 S + 3H 2 O 2KOH + Si + H 2 O = K 2 SiO 3 + 2H 2 3KOH + 4P + 3H 2 O = PH 3 + 3KPH 2 O 2 9. Metall bo'lmagan + kislota oksidi. Bu erda ikkita variant ham mavjud: 1) metall bo'lmagan qaytaruvchi (vodorod, uglerod): CO 2 + C = 2CO; 2NO 2 + 4H 2 = 4H 2 O + N 2; SiO 2 + C = CO 2 + Si. Agar hosil bo'lgan metall bo'lmagan metall qaytaruvchi sifatida ishlatiladigan metall bilan reaksiyaga kirishishi mumkin bo'lsa, u holda reaktsiya yanada davom etadi (ko'p uglerod bilan) SiO 2 + 2C = CO 2 + SiC 2) metall bo'lmagan - oksidlovchi (kislorod, ozon, galogenlar): 2CO + O 2 = 2CO 2. CO + Cl 2 = COCl 2. 2NO + O 2 = 2NO 2. 10. Kislota oksidi + asosli oksid. Agar hosil bo'lgan tuz printsipial jihatdan mavjud bo'lsa, reaktsiya sodir bo'ladi. Masalan, alyuminiy oksidi sulfat angidrid bilan reaksiyaga kirishib, alyuminiy sulfat hosil qilishi mumkin, ammo karbonat angidrid bilan reaksiyaga kirisha olmaydi, chunki tegishli tuz mavjud emas. 11. Suv + asosli oksid. Agar gidroksidi, ya'ni eruvchan asos (yoki kaltsiy bo'lsa, ozgina eriydigan) hosil bo'lsa, reaksiya mumkin. Agar asos erimaydigan yoki ozgina eriydigan bo'lsa, unda asosning oksid va suvga parchalanishining teskari reaktsiyasi sodir bo'ladi. 12. Asosiy oksid + kislota. Agar hosil bo'lgan tuz mavjud bo'lsa, reaktsiya mumkin. Olingan tuz erimaydigan bo'lsa, oksid yuzasiga kislota kirishining bloklanishi tufayli reaktsiya passivlashishi mumkin. Ko'p asosli kislota ortiqcha bo'lsa, kislota tuzi hosil bo'lishi mumkin. 13. Kislota oksidi + asos. Odatda, reaktsiya gidroksidi va kislotali oksid o'rtasida sodir bo'ladi. Agar kislota oksidi ko'p asosli kislotaga to'g'ri kelsa, kislota tuzini olish mumkin: CO 2 + KOH = KHCO 3 . Kuchli kislotalarga mos keladigan kislotali oksidlar erimaydigan asoslar bilan ham reaksiyaga kirishishi mumkin. Ba'zida zaif kislotalarga mos keladigan oksidlar erimaydigan asoslar bilan reaksiyaga kirishadi va o'rta yoki asosiy tuzni olish mumkin (qoida tariqasida, kamroq eriydigan modda olinadi): 2Mg(OH) 2 + CO 2 = (MgOH) 2 CO 3 + H 2 O. 14. Kislota oksidi + tuz. Reaksiya eritmada ham, eritmada ham borishi mumkin. Eritmada kamroq uchuvchi oksid tuzdan ko'proq uchuvchi oksidni siqib chiqaradi. Eritmada kuchliroq kislotaga mos keladigan oksid kuchsizroq kislotaga mos keladigan oksidni siqib chiqaradi. Misol uchun, Na 2 CO 3 + SiO 2 = Na 2 SiO 3 + CO 2, oldinga yo'nalishda bu reaktsiya eritmada sodir bo'ladi, karbonat angidrid kremniy oksidiga qaraganda ko'proq uchuvchan bo'ladi; teskari yo'nalishda reaktsiya eritmada sodir bo'ladi, karbonat kislotasi kremniydan kuchliroq va kremniy oksidi cho'kadi. Kislotali oksidni o'z tuzi bilan birlashtirish mumkin, masalan, xromatdan dixromat, sulfatdan disulfat va sulfitdan disulfit olish mumkin: Na 2 SO 3 + SO 2 = Na 2 S 2 O 5 Buning uchun siz kristalli tuz va sof oksid yoki to'yingan tuz eritmasi va ortiqcha kislotali oksidni olishingiz kerak. Eritmada tuzlar o'z kislota oksidlari bilan reaksiyaga kirishib, kislota tuzlarini hosil qilishi mumkin: Na 2 SO 3 + H 2 O + SO 2 = 2 NaHSO 3 15. Suv + kislota oksidi. Reaktsiya eruvchan yoki ozgina bo'lsa mumkin eriydigan kislota. Agar kislota erimaydigan yoki ozgina eriydigan bo'lsa, unda teskari reaktsiya sodir bo'ladi, kislotaning oksidi va suvga parchalanishi. Masalan, sulfat kislota oksid va suvdan hosil bo'lish reaktsiyasi bilan tavsiflanadi, parchalanish reaktsiyasi amalda sodir bo'lmaydi, suv va oksiddan kremniy kislotasini olish mumkin emas, lekin u bu tarkibiy qismlarga oson parchalanadi, ammo karbonat va oltingugurt kislotalari ishtirok etishi mumkin. to'g'ridan-to'g'ri va teskari reaktsiyalarda. 16. Asos + kislota. Agar reaktivlardan kamida bittasi eriydigan bo'lsa, reaktsiya sodir bo'ladi. Reaktivlarning nisbatiga qarab o'rta, kislotali va asosli tuzlar olinishi mumkin. 17. Asosiy + tuz. Har ikkala boshlang'ich moddalar eriydigan bo'lsa va mahsulot sifatida kamida bitta elektrolit bo'lmagan yoki kuchsiz elektrolitlar (cho'kma, gaz, suv) olingan bo'lsa, reaktsiya sodir bo'ladi. 18. Tuz + kislota. Qoidaga ko'ra, agar ikkala boshlang'ich modda ham eriydigan bo'lsa va mahsulot sifatida kamida bitta elektrolit bo'lmagan yoki kuchsiz elektrolit (cho'kma, gaz, suv) olingan bo'lsa, reaktsiya sodir bo'ladi. Kuchli kislota kuchsiz kislotalarning erimaydigan tuzlari (karbonatlar, sulfidlar, sulfitlar, nitritlar) bilan reaksiyaga kirisha oladi va gazsimon mahsulot ajralib chiqadi. Konsentrlangan kislotalar va kristall tuzlar o'rtasidagi reaktsiyalar, agar yanada uchuvchan kislota olingan bo'lsa, mumkin: masalan, vodorod xlorid konsentrlangan sulfat kislotaning kristalli natriy xlorid, vodorod bromidi va vodorod yodidiga ta'sirida - ortofosfor kislotasi ta'sirida olinishi mumkin. mos keladigan tuzlar. Siz kislotali tuzni olish uchun o'zingizning tuzingiz bilan kislota bilan harakat qilishingiz mumkin, masalan: BaSO 4 + H 2 SO 4 = Ba (HSO 4) 2. 19. Tuz + tuz. Qoidaga ko'ra, agar ikkala boshlang'ich moddalar eriydigan bo'lsa va mahsulot sifatida kamida bitta elektrolit bo'lmagan yoki kuchsiz elektrolitlar olingan bo'lsa, reaktsiya yuzaga keladi. Eruvchanlik jadvalida tire bilan ko'rsatilgan tuz hosil bo'ladigan holatlarga alohida e'tibor qaratamiz. Bu erda 2 ta variant mavjud: 1) tuz mavjud emas, chunki qaytmas gidrolizlanadi . Bu ko'pchilik karbonatlar, sulfitlar, sulfidlar, uch valentli metallarning silikatlari, shuningdek, ikki valentli metallar va ammoniyning ba'zi tuzlari. Uch valentli metall tuzlari tegishli asos va kislotaga, ikki valentli metall tuzlari esa kam eriydigan asos tuzlariga gidrolizlanadi. Keling, misollarni ko'rib chiqaylik: 2FeCl 3 + 3Na 2 CO 3 = Fe 2 (CO 3) 3+ 6NaCl (1) Fe 2 (CO 3) 3+ 6H 2 O = 2Fe(OH) 3 + 3 H2CO3 H2CO3 suv va karbonat angidridga parchalanadi, chap va o'ng qismlardagi suv kamayadi va natijada: Fe 2 (CO 3) 3+ 3H 2 O = 2Fe(OH) 3 + 3 CO2(2) Agar (1) va (2) tenglamalarni birlashtirib, temir karbonatni kamaytirsak, temir (III) xlorid va natriy karbonatning o'zaro ta'sirini aks ettiruvchi yig'ma tenglamani olamiz: 2FeCl 3 + 3Na 2 CO 3 + 3H 2 O = 2Fe(OH) ) 3 + 3CO2 + 6NaCl CuSO 4 + Na 2 CO 3 = CuCO3+ Na 2 SO 4 (1) Qaytib bo'lmaydigan gidroliz tufayli tagiga chizilgan tuz mavjud emas: 2CuCO3+ H 2 O = (CuOH) 2 CO 3 + CO 2 (2) Agar biz (1) va (2) tenglamalarni birlashtirib, mis karbonatni kamaytirsak, sulfat (II) va natriy karbonatning o'zaro ta'sirini aks ettiruvchi umumiy tenglamani olamiz: 2CuSO 4 + 2Na 2 CO 3 + H 2 O = (CuOH) 2 CO 3 + CO 2 + 2Na 2 SO 4 2) Tuz tufayli mavjud emas intramolekulyar oksidlanish-qaytarilish , bunday tuzlarga Fe 2 S 3, FeI 3, CuI 2 kiradi. Ular olinishi bilanoq darhol parchalanadi: Fe 2 S 3 = 2FeS+ S; 2FeI 3 = 2FeI 2 +I 2; 2CuI 2 = 2CuI + I 2 Masalan; FeCl 3 + 3KI = FeI 3 + 3KCl (1), lekin FeI 3 o'rniga uning parchalanish mahsulotlarini yozish kerak: FeI 2 +I 2. Keyin shunday bo'ladi: 2FeCl 3 + 6KI = 2FeI 2 +I 2 + 6KCl Bu reaksiyani yozishning yagona usuli emas, agar yodid yetishmasa, yod va temir (II) xlorid olinishi mumkin: 2FeCl 3 + 2KI = 2FeCl 2 +I 2 + 2KCl Taklif etilgan sxema bu haqda hech narsa aytmaydi amfoter birikmalar va ularga mos keladigan oddiy moddalar. Biz ularga murojaat qilamiz alohida e'tibor. Demak, bu sxemadagi amfoter oksid ham kislotali, ham asosli oksidlar o‘rnini, amfoter gidroksid esa kislota va asos o‘rnini egallashi mumkin. Shuni esda tutish kerakki, kislotali, amfoter oksidlar va gidroksidlar suvsiz muhitda oddiy tuzlarni, eritmalarda esa murakkab tuzlarni hosil qiladi: Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O (birikma) Al 2 O 3 + 2NaOH + 3H 2 O = 2Na (eritmada) Oddiy moddalar, amfoter oksidlar va gidroksidlarga mos keladigan, gidroksidi eritmalar bilan reaksiyaga kirishib, murakkab tuzlar hosil qiladi va vodorodni chiqaradi: 2Al + 2NaOH + 6H 2 O = 2Na + 3H 2 MASHQ O'zaro ta'sir qilish imkoniyatini muhokama qiling ... Bu shuni anglatadiki, siz qaror qilishingiz kerak: 1) mumkin bo'lgan reaktsiya; 2) iloji bo'lsa, unda qanday sharoitda (eritmada, eritmada, qizdirilganda va hokazo), agar imkon bo'lmasa, nima uchun; 3) turli xil (qanday) sharoitlarda turli xil mahsulotlarni olish mumkinmi? Shundan so'ng siz barcha mumkin bo'lgan reaktsiyalarni yozishingiz kerak. Masalan: 1. magniyning kaliy nitrat bilan o'zaro ta'sir qilish imkoniyatini muhokama qiling. 1) Reaksiya mumkin 2) Eritmada paydo bo'lishi mumkin (qizdirilganda) 3) Eritmada reaktsiya mumkin, chunki nitrat magniyni oksidlovchi kislorod chiqishi bilan parchalanadi. KNO3 + Mg = KNO2 + MgO 2. Sulfat kislotaning natriy xlorid bilan o'zaro ta'sir qilish imkoniyatini muhokama qiling. 1) Reaksiya mumkin 2) Bu o'rtasida sodir bo'lishi mumkin konsentrlangan kislota va kristall tuz 3) Mahsulot natriy sulfat va natriy vodorod sulfat bo'lishi mumkin (ortiqcha kislotada, qizdirilganda) H 2 SO 4 + NaCl = NaHSO 4 + HCl H 2 SO 4 + 2NaCl = Na 2 SO 4 + 2HCl Quyidagilar orasida reaksiya yuzaga kelishi mumkinligini muhokama qiling: 1. Ortofosfor kislotasi va kaliy gidroksid; 2. Rux oksidi va natriy gidroksid; 3. Kaliy sulfit va temir (III) sulfat; 4. Mis (II) xlorid va kaliy yodidi; 5. Kaltsiy karbonat va alyuminiy oksidi; 6. Karbonat angidrid va natriy karbonat; 7. Temir (III) xlorid va vodorod sulfidi; 8. Magniy va oltingugurt dioksidi; 9. Kaliy dixromati va sulfat kislota; 10. Natriy va oltingugurt. Keling, C2 misollarini biroz tahlil qilaylik Mavzu No 3. NOMETALLARNING KIMYOVIY XUSUSIYATLARI Reja 1. Nometallarning asosiy kimyoviy xossalari. 2. Metall bo'lmagan elementlarning oksidlari. 3. Metall bo'lmagan elementlarning tabiatda tarqalishi. 4.Nometalllardan foydalanish. 1. Nometallarning asosiy kimyoviy xossalari Metall bo'lmaganlar (inert gazlardan tashqari) kimyoviy xususiyatga ega faol moddalar. Metalllar bilan reaksiyalarda metall bo'lmagan elementlarning atomlari elektronlar qo'shadi va metall bo'lmaganlar bilan reaksiyalarda ular qo'shma elektron juftlarini hosil qiladi. Elektromanfiylik seriyasi umumiy elektron juftlari qaysi atomga siljishini aniqlashga yordam beradi: F, O, N, Cl, Br, I, S, C, Se, H, P, As, B, Si elektromanfiylik pasayadi
2Mg + O2 = 2MgO (magniy oksidi) 6Li + N 2 = 2Li 3 N (litiy nitridi) 2Al + 3Cl 2 = 2AlCl 3 (alyuminiy xlorid) Ca + H 2 = CaH 2 (kaltsiy gidrid) Fe + S = FeS (ferum (II) sulfid) Metall bo'lmagan metallar metallar bilan o'zaro ta'sirlashganda, ionli kimyoviy bog'langan ikkilik birikmalar hosil bo'ladi. 2 . Nometallarning kislorod bilan o'zaro ta'siri: C + O 2 = CO 2 (uglerod (IV) oksidi) S + O 2 = SO 2 (c oltingugurt (IV) oksidi) Metall bo'lmaganlarning kislorod bilan o'zaro ta'sirining mahsulotlari kovalent qutbli aloqaga ega bo'lgan ikkilik birikmalardir. oksidlar , bunda kislorod oksidlanish darajasiga ega- 2. 3. Nometallarning vodorod bilan o'zaro ta'siri: H2+Cl2 = 2HCl (vodorod xlorid yoki vodorod xlorid) H2+S=H2 S (vodorod sulfidi yoki vodorod sulfidi) Metall bo'lmaganlar vodorod bilan o'zaro ta'sirlashganda, kovalent qutbli aloqaga ega uchuvchi (gazsimon yoki suyuq) ikkilik birikmalar hosil bo'ladi. 4. Nometallarning boshqa metall bo'lmaganlar bilan o'zaro ta'siri: C + 2S = CS 2 (uglerod (IV) sulfid) Si + 2Cl 2 = SiCl 4 (kremniy (IV) xlorid) Ikki nometallning o'zaro ta'sirining mahsulotlari har xil bo'lgan moddalardir agregatsiya holati kimda bor kovalent turi kimyoviy bog'lanish.
Metall bo'lmagan elementlarning oksidlari quyidagilarga bo'linadi: a) tuz hosil qiluvchi (ularning ko'pchiligi) va b) tuz hosil qilmaydi(CO, NO, N 2 O, H 2 O). Oksidlar orasida bor gazsimon moddalar(CO, CO 2,SO2 ), qattiq moddalar(P 2 O 5), suyuqliklar (H 2 O, Cl 2 O 7). Istisnosiz barcha oksidlarda, Kislorod bilan bog'langan metall bo'lmagan elementlarning atomlari mavjudijobiy oksidlanish holatlari. Metall bo'lmagan elementlarning aksariyat oksidlari kislotali . Ular o'zaro ta'sir qiladi:
Metall bo'lmaganlar keng tarqalgantabiatda metallarga qaraganda. Havo tarkibiga quyidagilar kiradi: azot, kislorod, inert gazlar. Karpat mintaqasidagi oltingugurt konlari dunyodagi eng yirik konlari hisoblanadi. Ukrainadagi grafitning sanoat koni Zavalevskoe koni bo'lib, uning xom ashyosi Mariupol grafit kombinati tomonidan qo'llaniladi. Jitomir viloyatida, Volinda olmos bo'lishi mumkin bo'lgan jinslarning konlari topilgan, ammo tijorat konlari hali topilmagan. Metall bo'lmagan elementlarning atomlari har xil bo'ladi murakkab moddalar, ular orasida oksidlar va tuzlar ustunlik qiladi.
Kislorod: Nafas olish jarayonlari Yonish, Metabolizm va energiya Metall ishlab chiqarish. Vodorod: Ammiak ishlab chiqarish, xlorid kislotasi, metanol, Suyuq yog'larni qattiq yog'larga aylantirish, Olovga chidamli metallarni payvandlash va kesish, Rudalardan metallarni olish. Oltingugurt: Sulfat kislotasini tayyorlash, Kauchukdan kauchuk yasash, Gugurt ishlab chiqarish, qora kukun, Dori vositalarini ishlab chiqarish. Bor: Yadro reaktorlarining neytronni yutuvchi materiallarining tarkibiy qismi, Po'lat buyumlarning sirtlarini korroziyadan himoya qilish, Yarimo'tkazgich texnologiyasida, Issiqlik energiyasini elektr energiyasiga aylantiruvchi qurilmalarni ishlab chiqarish. Azot: Gazsimon: Ammiak ishlab chiqarish uchun, Metalllarni payvandlashda inert muhit yaratish uchun, Vakuumli qurilmalarda, Elektr lampalar, Suyuqlik: Sovutgich tizimlarida sovutgich sifatida, Dori. Fosfor: Oq - qizil fosfor ishlab chiqarish uchun; Qizil - gugurt ishlab chiqarish uchun. Silikon: IN elektronika va elektrotexnikaqilish uchun: Sxemalar, diodlar, tranzistorlar, Fotosellar, Qotishmalarni ishlab chiqarish uchun. Xlor: xlorid kislota ishlab chiqarish, Organik erituvchilar, Dorilar, Plastmassa ishlab chiqarish uchun monomerlar, oqartirgichlar, Dezinfektsiyalash vositasi sifatida. Uglerod: Olmos: burg'ulash va kesish asboblarini ishlab chiqarish, abraziv material, Zargarlik buyumlari, Grafit: Quyuv, metallurgiya, radiotexnika ishlab chiqarishi, Batareyalar ishlab chiqarish, Neft va gaz sanoatida burg'ulash ishlari uchun, Korroziyaga qarshi qoplamalar ishlab chiqarish, Kamaytiruvchi mastikalar ishqalanish kuchi, Adsorbsiya. Adsorbsiya ba'zi moddalarning (xususan, uglerod) boshqa moddalarning (gaz yoki erigan moddalar) zarralarini o'z yuzasida ushlab turish qobiliyati. Tibbiyotda dorivor maqsadlarda foydalanish uglerodning adsorbsion qobiliyatiga asoslanadi, bular faollashtirilgan uglerodning planshetlari yoki kapsulalari; Ular zaharlanish uchun ichkarida ishlatiladi. Adsorbentning adsorbsiyalangan moddani adsorbsiyalash va olib tashlash qobiliyatini tiklash uchun isitish kifoya. Uglerodning adsorbsion qobiliyati M.D. Zelinskiy 1915 yilda ixtiro qilgan ko'mir gaz niqobida - nafas olish a'zolarini, odamning yuzini va ko'zlarini ta'sir qilishdan individual himoya qilish vositasi zararli moddalar. 1916 yilda gaz niqoblarini sanoat ishlab chiqarish yo'lga qo'yildi, bu Birinchi jahon urushi paytida yuz minglab askarlarning hayotini saqlab qoldi. Yaxshilangan gaz niqobi bugungi kunda ham qo'llaniladi. O'zaro ta'sir reaktsiyasini yozing: a) silikon bilan kislorod; b) vodorod bilan kremniy; v) xlorli rux; d) xlor bilan fosfor. Olingan birikmalarni nomlang. Suv bilan o'zaro ta'siri Ko'pgina metall bo'lmaganlar suv bilan oksidlar (va/yoki boshqa birikmalar) hosil qilish uchun reaksiyaga kirishadi. Reaksiyalar yuqori haroratda sodir bo'ladi. C + H 2 O → CO + H 2 6B + 6H 2 O → 2H 3 B 3 O 3 (boroksin) + 3H 2 4P + 10H 2 O → 2P 2 O 5 + 5H 2 3S + 2H 2 O → 2H 2 S + SO 2 Suv bilan o'zaro ta'sirlashganda, galogenlar nomutanosib (ular bir oksidlanish darajasiga ega bo'lgan birikmadan turli oksidlanish darajasiga ega birikmalar hosil qiladi) - F2 dan tashqari. Reaksiyalar xona haroratida sodir bo'ladi. Cl 2 + H 2 O → HCl + HClO Br 2 + H 2 O → HBr + HBrO 2F 2 + 2H 2 O → 4HF + O 2 Metall bo'lmaganlar bilan o'zaro ta'siri Kislorod bilan o'zaro ta'siri. Aksariyat nometalllar (galogenlar va asil gazlardan tashqari) kislorod bilan reaksiyaga kirishib, oksidlar hosil qiladi va ma'lum sharoitlarda (harorat, bosim, katalizatorlar) yuqori oksidlarni hosil qiladi. N 2 + O 2 → 2NO (reaktsiya 2000 ° C haroratda yoki elektr yoyida sodir bo'ladi) C + O 2 → CO 2 4B + 3O 2 → 2B 2 O 3 S + O 2 → SO 2 Ftor bilan o'zaro ta'siri Aksariyat nometallar (N2, C (olmos) dan tashqari, ba'zi nobel gazlar) ftor bilan reaksiyaga kirishib, ftoridlarni hosil qiladi. O 2 +2F 2 → 2OF 2 (uzatish bilan elektr toki) C + 2F 2 → CF 4 (900°C da) S +3F 2 → SF 6 2.3 Galogenlar bilan o'zaro ta'siri (Cl 2, Br 2) Metall bo'lmaganlar bilan (uglerod, azot, ftor, kislorod va inert gazlardan tashqari) tegishli galogenidlarni (xloridlar va bromidlar) hosil qiladi. 2S + Cl 2 → S 2 Cl 2 2S + Br 2 → S 2 Br 2 2P + 5Cl 2 → 2PCl 5 (xlorli atmosferada yonish) Cl 2 + Br 2 → 2BrCl Cl 2 + I 2 → 2ICl (45 ° C gacha qizdirish)) Br 2 + I 2 → 2IBr Oksidlar bilan o'zaro ta'siri Uglerod va kremniy metallar va metall bo'lmaganlarni oksidlaridan kamaytiradi. Reaksiyalar qizdirilganda sodir bo'ladi. SiO 2 +C=CO 2 +Si MnO2 + Si → Mn + SiO 2. Ishqorlar bilan o'zaro ta'siri Aksariyat metall bo'lmaganlar (F 2, Si bundan mustasno) ishqorlar bilan o'zaro ta'sirlashganda nomutanosibdir. Asil gazlar, O 2, N 2 va boshqa ba'zi metallar ishqorlar bilan reaksiyaga kirishmaydi Cl 2 + 2NaOH → NaCl + NaClO 3Cl 2 + 6NaOH → 5NaCl + NaClO 3 + H 2 O (qizdirilganda) 3S + 6NaOH → 2Na 2 S + Na 2 SO 3 + 3H 2 O (qotishma) P + NaOH → Na 3 PO 3 + PH 3 Si +2NaOH+ H 2 O → Na 2 SiO 3 + 2H 2 4F 2 + 6NaOH → OF 2 + 6NaF + 3H 2 O + O 2 Oksidlovchi kislotalar bilan o'zaro ta'siri Barcha metall bo'lmaganlar (galogenlar, asil gazlar, N 2, O 2, Si dan tashqari) oksidlovchi kislotalar bilan reaksiyaga kirishib, tegishli kislorodli kislota (yoki oksid) hosil qiladi. C + 2 H 2 SO 4 → CO 2 + 2SO 2 +2H 2 O B + 3HNO 3 → H 3 BO 3 + 3NO 2 S + 6HNO 3 → H 2 SO 4 + 6NO 2 + 2H 2 O Tuzlar bilan o'zaro ta'siri Elektromanfiy galogen qanchalik ko'p bo'lsa, uning tuzidan kamroq elektron manfiy reagentni siqib chiqaradi yoki vodorod aloqasi 2NaBr + Cl 2 → 2NaCl + Br 2 Kimyoviy xossalari oksid bo'lmagan ikkilik birikmalar har xil. Ularning aksariyati (galoidlardan tashqari) kislorod bilan reaksiyaga kirishib, ikkita oksid hosil qiladi (ammiak bo'lsa, katalizatorlardan foydalanish kerak). Asosiy oksidlarning kimyoviy xossalari Suv bilan o'zaro ta'siri Ishqoriy va gidroksidi tuproqli metallarning oksidlari suv bilan reaksiyaga kirishib, eruvchan (oz eruvchan) birikmalar - gidroksidi hosil qiladi. Na 2 O + H 2 O → 2NaOH Oksidlar bilan o'zaro ta'siri Asosiy oksidlar kislotali va amfoter oksidlar bilan reaksiyaga kirishib, tuzlar hosil qiladi. Na 2 O + SO 3 → Na 2 SO 4 CaO + Al 2 O 3 → CaAl 2 O 4 (birlashma) Kislotalar bilan o'zaro ta'siri Asosiy oksidlar kislotalar bilan reaksiyaga kirishadi CaO + 2HCl→ CaCl 2 + H 2 O FeO + 2HCl→ FeCl 2 + H 2 O Oksidlanish darajasi o'zgaruvchan elementlarning asosiy oksidlari oksidlanish-qaytarilish reaktsiyalarida qatnashishi mumkin FeO + 4HNO 3 →Fe(NO 3) 3 + NO 2 + 2H 2 O 2MnO + O 2 → 2MnO 2 Amfoter oksidlarning kimyoviy xossalari Oksidlar bilan o'zaro ta'siri Amfoter oksidlar asosli, kislotali va amfoter oksidlar bilan reaksiyaga kirishib, tuzlar hosil qiladi. Na 2 O + Al 2 O 3 → 2NaAlO 2 3SO 3 + Al 2 O 3 → 2Al 2 (SO 4) 3 ZnO + Al 2 O 3 → ZnAl 2 O 4 (birlashma) Kislotalar va asoslar bilan o'zaro ta'siri Amfoter oksidlar asoslar va kislotalar bilan reaksiyaga kirishadi 6HCl + Al 2 O 3 → 2AlCl 3 + 3H 2 O ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O (qizdirilganda) Tuzlar bilan o'zaro ta'siri Kam uchuvchi amfoter oksidlar o'z tuzlaridan ko'proq uchuvchi kislotali oksidlarni siqib chiqaradi. Al 2 O 3 + Na 2 CO 3 → 2NaAlO 2 + CO 2 Oksidlovchi - kamaytirish reaktsiyalari Oksidlanish darajasi o'zgaruvchan elementlarning amfoter oksidlari oksidlanish-qaytarilish reaktsiyalarida qatnashishi mumkin. MnO 2 + 4HCl→ MnCl 2 + Cl 2 + 2H 2 O Kislota oksidlarining kimyoviy xossalari 1. Suv bilan o'zaro ta'siri Aksariyat kislotali oksidlar mos keladigan kislota hosil qilish uchun suvda eriydi (oksidlanish darajasi yuqori bo'lgan metall oksidlari va SiO 2 suvda erimaydi). SO 3 + H 2 O → H 2 SO 4 P 2 O 5 + 3H 2 O → 2H 3 PO 4 Oksidlar bilan o'zaro ta'siri Kislotali oksidlar asosli va amfoter oksidlar bilan reaksiyaga kirishib, tuzlar hosil qiladi. |
 Luminesans: turlari, usullari, qo'llanilishi
Luminesans: turlari, usullari, qo'llanilishi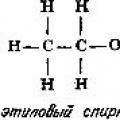 Organik kimyoning asosiy tamoyillari Organik reaksiyalarning tasnifi
Organik kimyoning asosiy tamoyillari Organik reaksiyalarning tasnifi O'qituvchi va o'qituvchi o'rtasidagi farq O'qituvchi va o'qituvchi o'rtasidagi farq nima
O'qituvchi va o'qituvchi o'rtasidagi farq O'qituvchi va o'qituvchi o'rtasidagi farq nima