Kimyasal bağ türlerinin nasıl belirleneceği. Kovalent kimyasal bağ
Bir cümleyle ilişki- bu, bir cümleye anlamlılık, düşünce bütünlüğü ve aynı zamanda mantıksal, sözcüksel ve sözdizimsel bütünlük vermenin bir yoludur. Bir cümlede iki tür bağlantı vardır: koordine eden ve düzenleyen.
Bağlantıyı koordine etme Bir cümlede, bir cümledeki birbirinden bağımsız öğelerin birleşimidir: basit bir cümledeki homojen üyeler veya karmaşık bir cümledeki basit cümleler.
İkincil bağlantı Bir cümlede birbirine bağlı öğelerin birleşimi bulunur: bir ifadedeki kelimeler, cümle veya karmaşık bir cümlenin parçası olan basit cümleler.
Bir cümledeki bağlantı türü nasıl belirlenir?
Her şeyden önce, konu her zaman yüklemle bağlantılı olduğundan dilbilgisel temeli atmak gerekir ve aynı zamanda giriş sözcüklerini de ortadan kaldırmaya değer.
Örnek. Dışarı çıkmak istedim ama kapı kilitliydi.
İki bağımsız bölümden oluşan karmaşık bir cümle, bileşik. Buna dayanarak, bu cümle şunu kullanır: iletişimi koordine etmek.
Odanın havası çok bayat olduğu için dışarı çıkmak istedim.
İçinde karmaşık bir cümle var ikincil bağlantı- bir cümle diğerinde söylenenin nedenini belirtir. Cümle karmaşıktır.
İkincil bağlantı türleri.
Var üç tür ikincil bağlantı:
Koordinasyon- bu, bağımlı ve ana kelimelerin (bir isim veya isim rolündeki konuşmanın başka bir kısmı) cinsiyet, sayı ve durum bakımından birbirine benzetildiği bir bağlantı türüdür. En basit anlaşma örnekleri ifadelerdedir: iğrenç yağmur, neşeli ben, görünmez biri, yoldan geçen rastgele biri, yankılanan bir "zy".
Gibi bağımlı kelimelerüzerinde anlaşmaya varıldığında konuşmanın herhangi bir değiştirilebilir kısmı görünebilir: sıfatlar, zamirler (iyelik, nitelik, işaret, olumsuz, belirsiz) ve sıra sayıları.
Neşeli hikaye anlatıcısına, kız kardeşine, ilk tanıştığın kişiye para yok.
Kontrol- hangi iletişim türü ana kelime bağımlı kelimenin özel durum formunu gerektirir. Vaka formu aynı zamanda Rus dilindeki belirli morfolojik normlarla da belirlenir. Bir cümle veya cümlede kontrolün varlığının ana işareti, edatın kullanılmasıdır, ancak edatsız bir kontrol biçimi de vardır. Kontrol varsa bağımlı kelime her zaman dolaylı durumların sorularına cevap verecektir.
Aya bakın, aya hayran kalın, makbuz imzalayın, belgeleri imzalayın, sorunları unutun, formülü unutun.
sıralama- anlam ve dilbilgisi açısından ikincil bir ilişki temelinde birbiriyle ilişkili iki veya daha fazla önemli (bağımsız) kelimenin birleşimidir. İfadeler nesneleri, eylemleri, işaretleri vb. adlandırır. Ama daha doğrusu, kelimelerden daha spesifik olarak: oku - yüksek sesle oku, kalem - tükenmez kalem, hızlı - çok hızlı.
İkincil bağlantı- biri ana, diğeri bağımlı olan eşit olmayan bileşenleri birbirine bağlayan SS'deki kelimelerin bağlantısı; Ana kelimeden bağımlı kelimeye kadar bir soru sorabilirsiniz.
İkincil bağlantı türleri:
Bir cümlenin bileşenleri birbirine üç türden bir ikincil ilişkiyle bağlanır: koordinasyon, kontrol, bitişiklik:
1) onay– ikincil bir ilişki olan bağımlı kelime ana kelimeye benzetilir morfolojik özelliklerinde, yani. burada bağımlı kelimenin cinsiyeti, sayısı, durumu, kök kelimenin karşılık gelen biçimleri tarafından önceden belirlenir.
Koordinasyon değişir tamamlamak Ve tamamlanmamış:
a) tam anlaşma ile alt kelime kabul edilir yardımcı kelimenin tüm biçimleri, her iki kelimenin gramer kategorilerinin izin verdiği ölçüde, örneğin: karanlık bir gecede (cinsiyet, durum ve sayı konusunda anlaşma); son dakikalar (durum ve sayı konusunda anlaşma); işaretler belirlendi (sayı koordinasyonu)
b) eksik anlaşma durumunda tüm koordinasyon olanakları tükenmedi, örneğin: Onu ayrılmaya hazır görüyorum (sıfatın zamiriyle cinsiyet ve sayı açısından anlaşması hazır, ancak durum açısından değil; bkz. eski yapı Onu ayrılmaya hazır görüyorum - tam anlaşmayla)
Kararlaştırıldığında bağımlı kelime şu şekilde ifade edilebilir:
1) herhangi bir biçimde bir sıfat (basit karşılaştırmalı ve buna dayalı olarak oluşturulan bileşik üstünlük derecesi hariç), cinsiyet, sayı, durum bakımından ana kelimeye uygun olan
2) zamir sıfatı (onun, onu, onlar hariç)
3) sıra numarası ve bir rakamı
4) cemaat; aynı anlaşma: kitap oku
5) isim - durum ve sayı bakımından ana kelimeye uyan koordineli bir uygulama (koordineli ismin sayıları değişirse)
6) dolaylı durumlarda asal sayılar; durumda anlaşma ve her ikisi de cinsiyet açısından: her ikisi de kız, her ikisi de erkek
2) yönetim- bir ismin veya zamirin, edatlı veya edatsız belirli bir durum biçiminde ana kelimeye bağlı olduğu ikincil bir ilişki; Bağımlı kelimenin, ana kelimenin dilbilgisel imkânına ve ifade ettiği anlama bağlı olarak şu veya bu durumun şeklini aldığı. Her iki sözcük biçiminin aynı anda değiştiği anlaşmanın aksine, ana sözcüğün dilbilgisel biçimi değiştiğinde bağımlı sözcük biçimi değişmeden kalır.
Yönetim ilişkileri kurar nesne, gramer açısından baskın kelime aramalar eylem veya durum ve bağımlı, eylemin nesnesi veya durumun taşıyıcısıdır(bir mektup gönderin, bir kitap okuyun) ve öznel Dilbilgisi açısından baskın olan kelimenin bir eylemi veya durumu adlandırdığı ve bağımlı kelimenin eylemin öznesini veya durumun taşıyıcısını adlandırdığı; ve ayrıca kapsamlı (yenileyici)çoğu durumda şu şekilde hareket eder: Sözdizimsel olarak bölünemeyen ifadeler, ana bileşen anlamsal yetersizliği veya belirsizliği nedeniyle kesin olarak tanımlanmış bir biçimde kullanılamaz: on gün, bir ördek sürüsü, bir bardak su, kahraman olun, hazırlanmaya başlayın, dört köşe, kendinize misafir deyin , bir ahmak olarak kabul edilebilir.
Yönetimdeki ana kelime şu şekilde ifade edilir:
1) herhangi bir biçimdeki fiil: kitap okumak
2) isim: kitap okumak
3) sıfat: başarıdan memnun
4) I. (V.) durumdaki asal sayı: üç sandalye, beş sandalye
Kontrol ederken bağımlı kelime - bir isim, zamir isim veya bir ismin işlevindeki konuşmanın herhangi bir kısmı: bir arkadaşınıza bakın
3) bitişiklik- bir tür ikincil bağlantı; ana kelimeye değiştirilemez bir bağımlı kelime eklenir veya anlaşma yeteneği olmayan değişken bağımlı bir kelimenin bir biçimi (fiil mastarı, katılımcı biçimi, bir sıfat veya zarfın basit karşılaştırmalı derecesi), yani. Bağımlı kelimenin değişmez olduğu, konuşmanın belirli bir bölümüne ait olması nedeniyle dava sisteminden izole edildiği, ana kelimeye bağımlılık anlamsal olarak ifade edilir. Katılımcılar, zarflar ve mastarlar bitişik olabilir.
Bitişikteki ana kelime:
1) fiil: hızlı koşmak
2) sıfat: çok hızlı,
3) zarf: çok hızlı
4) isim: rafadan yumurta, çan altı pantolon, büyük çocuklar
Bitişik olduğunda bağımlı kelime şu şekilde ifade edilir:
1) karşılaştırma dereceleri de dahil olmak üzere bir zarf: yürü, daha hızlı yaz
2) ulaç: kekemelik konuştu
3) mastar: yazması istendi
4) sıfatın karşılaştırmalı derecesi: daha büyük çocuklar
5) değişmez (analitik) sıfat: haki
6) zamirsel sıfat onun, onu, onların: onun evi
7) isim – tutarsız uygulama: “İzvestia” gazetesinde
3.3.1 Kovalent bağ antiparalel spinlerle eşleşmemiş elektronları taşıyan elektron bulutlarının örtüşmesi nedeniyle oluşan iki merkezli, iki elektronlu bir bağdır. Kural olarak, bir kimyasal elementin atomları arasında oluşur.
Kantitatif olarak değerlik ile karakterize edilir. Elementin değerliliği - bu, atomik değerlik bandında bulunan serbest elektronlar nedeniyle belirli sayıda kimyasal bağ oluşturma yeteneğidir.
Kovalent bir bağ yalnızca atomlar arasında bulunan bir çift elektron tarafından oluşturulur. Buna bölünmüş çift denir. Kalan elektron çiftlerine yalnız çiftler denir. Kabukları doldururlar ve bağlanmada rol almazlar. Atomlar arasındaki bağlantı yalnızca bir değil, iki hatta üç bölünmüş çift tarafından da gerçekleştirilebilir. Bu tür bağlantılara denir çift vesaire sürüsü - çoklu bağlantı.
3.3.1.1 Kovalent polar olmayan bağ. Her iki atoma da eşit miktarda ait olan elektron çiftlerinin oluşmasıyla oluşan bağa denir. kovalent polar olmayan. Pratik olarak eşit elektronegatifliğe (0.4 > ΔEO > 0) sahip atomlar arasında meydana gelir ve dolayısıyla homonükleer moleküllerdeki atomların çekirdekleri arasında elektron yoğunluğunun düzgün bir dağılımı olur. Örneğin H2, O2, N2, Cl2, vb. Bu tür bağların dipol momenti sıfırdır. Doymuş hidrokarbonlardaki (örneğin CH4'teki) CH bağının pratik olarak polar olmadığı kabul edilir, çünkü ΔEO = 2,5 (C) - 2,1 (H) = 0,4.
3.3.1.2 Kovalent polar bağ. Bir molekül iki farklı atomdan oluşuyorsa, elektron bulutlarının (orbitallerin) örtüşme bölgesi atomlardan birine doğru kayar ve böyle bir bağa denir. kutupsal . Böyle bir bağda atomlardan birinin çekirdeğinin yakınında elektron bulma olasılığı daha yüksektir. Örneğin HCl, H 2 S, PH 3.
Polar (simetrik olmayan) kovalent bağ - farklı elektronegatifliğe (2 > ΔEO > 0,4) sahip atomlar arasındaki bağlanma ve ortak elektron çiftinin asimetrik dağılımı. Tipik olarak iki metal olmayan arasında oluşur.
Böyle bir bağın elektron yoğunluğu daha elektronegatif bir atoma doğru kayar, bu da üzerinde kısmi bir negatif yükün (delta eksi) ve daha azında kısmi bir pozitif yükün (delta artı) ortaya çıkmasına neden olur. elektronegatif atom.
C?
Elektron yer değiştirmesinin yönü de bir okla gösterilir:
CCl, CO, CN, OH, CMg.
Bağlanan atomların elektronegatifliğindeki fark ne kadar büyük olursa, bağın polaritesi de o kadar yüksek olur ve dipol momenti de o kadar büyük olur. Ek çekici kuvvetler zıt işaretli kısmi yükler arasında etki eder. Bu nedenle bağ ne kadar polar olursa o kadar güçlü olur.
Hariç polarize edilebilirlik kovalent bağ mülkiyeti var doygunluk – Bir atomun, enerji açısından erişilebilir atomik yörüngelere sahip olduğu sayıda kovalent bağ oluşturma yeteneği. Kovalent bağın üçüncü özelliği yön.
3.3.2 İyonik bağlanma. Oluşumunun arkasındaki itici güç, atomların sekizli kabuk için aynı isteğidir. Ancak bazı durumlarda böyle bir "sekizli" kabuk yalnızca elektronlar bir atomdan diğerine aktarıldığında ortaya çıkabilir. Bu nedenle, kural olarak, metal ile metal olmayan arasında iyonik bir bağ oluşur.
Örnek olarak sodyum (3s 1) ve flor (2s 2 3s 5) atomları arasındaki reaksiyonu düşünün. NaF bileşiğindeki elektronegatiflik farkı
EO = 4,0 - 0,93 = 3,07
3s 1 elektronunu florine veren sodyum, bir Na + iyonu haline gelir ve neon atomunun elektronik konfigürasyonuna karşılık gelen dolu bir 2s 2 2p 6 kabuğuyla kalır. Flor, sodyumun bağışladığı bir elektronu kabul ederek tamamen aynı elektronik konfigürasyonu elde eder. Sonuç olarak zıt yüklü iyonlar arasında elektrostatik çekim kuvvetleri ortaya çıkar.
iyonik bağ – iyonların elektrostatik çekimine dayanan aşırı bir polar kovalent bağlanma durumu. Böyle bir bağ, bağlı atomların elektronegatifliğinde büyük bir fark olduğunda (EO > 2), daha az elektronegatif bir atomun değerlik elektronlarını neredeyse tamamen bırakıp bir katyona dönüştüğü ve daha elektronegatif başka bir atomun bağlandığı zaman meydana gelir. bu elektronlar ve bir anyon haline gelir. Ters işaretli iyonların etkileşimi yöne bağlı değildir ve Coulomb kuvvetleri doyma özelliğine sahip değildir. Bundan dolayı iyonik bağ mekansal yok odak Ve doygunluk , çünkü her iyon belirli sayıda karşı iyonla (iyon koordinasyon numarası) ilişkilidir. Bu nedenle iyonik bağlı bileşikler moleküler bir yapıya sahip değildir ve iyonik kristal kafesler oluşturan, erime ve kaynama noktaları yüksek, oldukça polar, genellikle tuza benzer ve sulu çözeltilerde elektriksel olarak iletken olan katı maddelerdir. Örneğin MgS, NaCl, A 2 O 3. Tamamen iyonik bağlara sahip neredeyse hiç bileşik yoktur, çünkü bir elektronun başka bir atoma tam bir aktarımının gözlenmemesi nedeniyle her zaman belirli bir miktarda kovalans kalır; Çoğu "iyonik" maddede bağ iyonikliği oranı %90'ı geçmez. Örneğin NaF'de bağ polarizasyonu yaklaşık %80'dir.
Organik bileşiklerde iyonik bağlar oldukça nadirdir çünkü Bir karbon atomu iyon oluşturmak için ne elektron kaybetmeye ne de kazanmaya eğilimlidir.
Değerlik İyonik bağlara sahip bileşiklerdeki elementler sıklıkla karakterize edilir oksidasyon durumu bu da belirli bir bileşikteki element iyonunun yük değerine karşılık gelir.
Oksidasyon durumu - bu, bir atomun elektron yoğunluğunun yeniden dağıtılmasının bir sonucu olarak elde ettiği koşullu bir yüktür. Kantitatif olarak, daha az elektronegatif bir elementten daha elektronegatif bir elemente doğru yer değiştiren elektronların sayısı ile karakterize edilir. Elektronlarını veren elementten pozitif yüklü iyon, bu elektronları kabul eden elementten ise negatif yüklü iyon oluşur.
Bulunan eleman en yüksek oksidasyon durumu (maksimum pozitif), AVZ'de bulunan tüm değerlik elektronlarından zaten vazgeçmiştir. Ve sayıları, elemanın bulunduğu grubun numarasına göre belirlendiğinden, o zaman en yüksek oksidasyon durumu çoğu element için ve eşit olacak grup numarası . İlişkin en düşük oksidasyon durumu (maksimum negatif), o zaman sekiz elektronlu bir kabuğun oluşumu sırasında, yani AVZ'nin tamamen doldurulması durumunda ortaya çıkar. İçin metal olmayanlar formülle hesaplanır Grup numarası – 8 . İçin metaller eşit sıfır Çünkü elektron kabul edemezler.
Örneğin kükürtün AVZ'si şu şekildedir: 3s 2 3p 4. Bir atom tüm elektronlarından (altı) vazgeçerse, en yüksek oksidasyon durumunu elde edecektir. +6 , grup numarasına eşit VI , kararlı kabuğu tamamlamak için gerekli olan ikisini alırsa, en düşük oksidasyon durumunu elde edecektir. –2 , eşit Grup numarası – 8 = 6 – 8= –2.
3.3.3 Metal bağı.Çoğu metalin doğası gereği genel olan ve diğer maddelerin özelliklerinden farklı olan bir takım özellikleri vardır. Bu özellikler nispeten yüksek erime sıcaklıkları, ışığı yansıtma yeteneği ve yüksek termal ve elektriksel iletkenliktir. Bu özellikler metallerde özel bir etkileşim türünün varlığıyla açıklanmaktadır. – metal bağlantı.
Periyodik tablodaki konumlarına uygun olarak metal atomları, çekirdeklerine oldukça zayıf bir şekilde bağlanan ve onlardan kolayca ayrılabilen az sayıda değerlik elektronuna sahiptir. Sonuç olarak, metalin kristal kafesinde, kristal kafesin belirli konumlarında lokalize pozitif yüklü iyonlar ve pozitif merkezler alanında nispeten serbestçe hareket eden ve tüm metaller arasında iletişim kuran çok sayıda delokalize (serbest) elektron belirir. Elektrostatik çekim nedeniyle atomlar.
Bu, uzayda katı bir yönelime sahip olan metalik bağlar ile kovalent bağlar arasındaki önemli bir farktır. Metallerdeki bağlanma kuvvetleri lokalize veya yönlendirilmiş değildir ve bir "elektron gazı" oluşturan serbest elektronlar, yüksek termal ve elektriksel iletkenliğe neden olur. Dolayısıyla bu durumda bağların yönünden bahsetmek imkansızdır çünkü değerlik elektronları kristal boyunca neredeyse eşit bir şekilde dağılmıştır. Örneğin metallerin plastisitesini, yani iyonların ve atomların herhangi bir yönde yer değiştirme olasılığını açıklayan şey budur.
3.3.4 Donör-alıcı bağı. İki elektronun etkileşiminden ortak bir elektron çiftinin ortaya çıktığı kovalent bağ oluşum mekanizmasına ek olarak, özel bir durum da vardır. bağışçı-alıcı mekanizması . Zaten mevcut (yalnız) bir elektron çiftinin geçişi sonucu kovalent bir bağın oluşması gerçeğinde yatmaktadır. bağışçı (elektron tedarikçisi) donörün ortak kullanımı için ve akseptör (serbest atom yörüngesinin tedarikçisi).
Bir kez oluştuğunda kovalentten hiçbir farkı yoktur. Verici-alıcı mekanizması, bir amonyum iyonunun oluşum şemasıyla iyi bir şekilde gösterilmiştir (Şekil 9) (yıldız işaretleri, nitrojen atomunun dış seviyesindeki elektronları gösterir):

Şekil 9 - Amonyum iyonunun oluşum şeması
Azot atomunun ABZ'sinin elektronik formülü 2s 2 2p 3'tür, yani her biri bir değerlik elektronuna sahip olan üç hidrojen atomu (1s 1) ile kovalent bir bağa giren üç eşleşmemiş elektrona sahiptir. Bu durumda, yalnız elektron çifti nitrojenin tutulduğu bir amonyak molekülü NH3 oluşur. Eğer elektronu olmayan bir hidrojen protonu (1s 0) bu moleküle yaklaşırsa, nitrojen elektron çiftini (donör) bu hidrojen atomik yörüngesine (alıcı) aktararak bir amonyum iyonunun oluşmasına neden olur. İçinde her hidrojen atomu, bir nitrojen atomuna ortak bir elektron çifti ile bağlanır ve bunlardan biri, bir verici-alıcı mekanizması yoluyla uygulanır. Farklı mekanizmalar tarafından oluşturulan H-N bağlarının özelliklerde herhangi bir farklılığa sahip olmadığına dikkat etmek önemlidir. Bu fenomen, bağ oluşumu anında nitrojen atomunun 2s ve 2p elektronlarının yörüngelerinin şekil değiştirmesinden kaynaklanmaktadır. Sonuç olarak, tamamen aynı şekle sahip dört yörünge ortaya çıkıyor.
Donörler genellikle çok sayıda elektrona sahip, ancak az sayıda eşlenmemiş elektrona sahip atomlardır. Periyod II elementleri için nitrojen atomuna ek olarak oksijen (iki ortaksız çift) ve flor (üç ortaksız çift) için de böyle bir olasılık mevcuttur. Örneğin, sulu çözeltilerde hidrojen iyonu H+ hiçbir zaman serbest durumda değildir, çünkü hidronyum iyonu H3O+ her zaman su molekülleri H2O ve H+ iyonundan oluşur. Hidronyum iyonu tüm sulu çözeltilerde mevcuttur. , ancak yazma kolaylığı için H+ sembolü korunmuştur.
3.3.5 Hidrojen bağı. Ortak bir elektron çiftini kendi üzerine "çeken" güçlü bir elektronegatif elementle (azot, oksijen, flor vb.) İlişkili bir hidrojen atomu, elektron eksikliği yaşar ve etkili bir pozitif yük elde eder. Bu nedenle, aynı (molekül içi bağ) veya başka bir molekülün (moleküller arası bağ) başka bir elektronegatif atomunun (etkili bir negatif yük elde eden) yalnız elektron çifti ile etkileşime girebilir. Sonuç olarak ortaya çıkıyor hidrojen bağı , grafiksel olarak noktalarla gösterilir:

Bu bağ diğer kimyasal bağlardan çok daha zayıftır (oluşumunun enerjisi 10'dur) – 40 kJ/mol) ve esas olarak kısmen elektrostatik, kısmen donör-alıcı karaktere sahiptir.
Hidrojen bağı, H2O, H2F2, NH3 gibi inorganik bileşikler gibi biyolojik makromoleküllerde son derece önemli bir rol oynar. Örneğin, H2O'daki O-H bağları, oksijen atomunda aşırı negatif yük - ile birlikte belirgin biçimde polar niteliktedir. Hidrojen atomu ise tam tersine küçük bir pozitif yük + kazanır ve komşu su molekülünün oksijen atomunun yalnız elektron çiftleriyle etkileşime girebilir.
Su molekülleri arasındaki etkileşimin oldukça güçlü olduğu ortaya çıkıyor, öyle ki su buharında bile (H 2 O) 2, (H 2 O) 3, vb. Bileşimin dimerleri ve trimerleri vardır. Çözeltilerde, uzun bileşik zincirleri bu tür görünebilir:
Çünkü oksijen atomunun iki ortaklanmamış elektron çifti vardır.
Hidrojen bağlarının varlığı suyun, alkollerin ve karboksilik asitlerin yüksek kaynama sıcaklıklarını açıklar. Hidrojen bağları nedeniyle su, H2E'ye (E = S, Se, Te) kıyasla bu kadar yüksek erime ve kaynama sıcaklıklarıyla karakterize edilir. Hidrojen bağları olmasaydı su -100 °C'de erir ve -80 °C'de kaynardı. Alkoller ve organik asitler için tipik birleşme durumları gözlemlenir.
Hidrojen bağları, hem farklı moleküller arasında hem de bir molekülün içinde, eğer bu molekül donör ve alıcı yetenekleri olan gruplar içeriyorsa oluşabilir. Örneğin proteinlerin yapısını belirleyen peptid zincirlerinin oluşumunda ana rolü oynayan molekül içi hidrojen bağlarıdır. H bağları bir maddenin fiziksel ve kimyasal özelliklerini etkiler.
Diğer elementlerin atomları hidrojen bağları oluşturmaz , çünkü polar bağların (O-H, N-H, vb.) dipollerinin karşıt uçlarının elektrostatik çekim kuvvetleri oldukça zayıftır ve yalnızca kısa mesafelerde etki eder. En küçük atom yarıçapına sahip olan hidrojen, bu tür dipollerin çekici kuvvetlerin fark edilecek kadar yakınlaşmasına olanak tanır. Büyük atom yarıçapına sahip başka hiçbir element bu tür bağları oluşturamaz.
3.3.6 Moleküller arası etkileşim kuvvetleri (van der Waals kuvvetleri). 1873 yılında Hollandalı bilim adamı I. Van der Waals, moleküller arasında çekime neden olan kuvvetlerin olduğunu öne sürdü. Bu kuvvetlere daha sonra Van der Waals kuvvetleri adı verildi. – Moleküller arası bağın en evrensel türü. Van der Waals bağının enerjisi hidrojen bağından daha azdır ve 2–20 kJ/∙mol tutarındadır.
Oluşma yöntemine bağlı olarak kuvvetler aşağıdakilere ayrılır:
1) yönelimsel (dipol-dipol veya iyon-dipol) - polar moleküller arasında veya iyonlar ve polar moleküller arasında meydana gelir. Polar moleküller birbirlerine yaklaştıkça, bir dipolün pozitif tarafı diğer dipolün negatif tarafına doğru yönlendirilecek şekilde kendilerini yönlendirirler (Şekil 10).
|
Şekil 10 - Oryantasyon etkileşimi |
||||
2) indüksiyon (dipol - indüklenmiş dipol veya iyon - indüklenmiş dipol) - polar moleküller veya iyonlar ile polar olmayan moleküller arasında ortaya çıkar, ancak polarizasyon yeteneğine sahiptir. Dipoller, polar olmayan molekülleri etkileyerek onları belirtilen (indüklenen) dipollere dönüştürebilir. (Şekil 11).
|
Şekil 11 - Endüktif etkileşim |
||||
3) dağıtıcı (indüklenen dipol - indüklenen dipol) - polarizasyon yeteneğine sahip polar olmayan moleküller arasında ortaya çıkar. Herhangi bir soy gaz molekülünde veya atomunda elektriksel yoğunluk dalgalanmaları meydana gelir ve bu dalgalanmalar anlık dipollere neden olur, bu da komşu moleküllerde anlık dipollere neden olur. Anlık dipollerin hareketi tutarlı hale gelir, görünümleri ve bozunmaları eşzamanlı olarak gerçekleşir. Anlık dipollerin etkileşimi sonucunda sistemin enerjisi azalır (Şekil 12).
|
Şekil 12 - Dağılım etkileşimi |
|||||||
Sooo N-A-D-O, Kimyasalın türü nasıl belirlenir. bağlantılar? Tercihen basit bir dille...) ve en iyi cevabı aldım
Yanıtlayan: Petros[Guru]
İki özdeş metal olmayan dövme. polar olmayan (H-H, Cl-Cl).
İki farklı - Cov.polar (H-Cl,C=O); metal ve metal olmayan - iyonik (K-Cl).
Metallerde (bir parçamda) - metalik.
Yanıtlayan: Amazan Kurbanov[acemi]
kimya 8. sınıf
Yanıtlayan: Inga Filippova[aktif]
Kovalent bağ, metal olmayan atomlar arasında oluşan kimyasal bir bağdır. Kovalent bir bağ, aynı türdeki metal olmayan atomlar arasında oluşuyorsa polar olabilir veya farklı türdeki metal olmayan atomlar arasında oluşuyorsa polar olmayabilir.
Madde karmaşıksa ve içindeki tüm atomlar metal değilse, bu kovalent polar olmayan bir bağ olacaktır.
Bir maddenin tüm atomları metal ise, maddenin basit veya karmaşık olmasına bakılmaksızın bu durumda bağ METAL olacaktır.
Madde karmaşıksa ve hem metal atomları hem de metal olmayan atomlar içeriyorsa, farklı türdeki atomlar arasında bir İYONİK bağ oluşur.
Benim için hepsi bu.
Yanıtlayan: Evgeniy Terentyev[usta]
Kovalent bağ (Latince ortak - “birlikte” ve valelerden - “güç sahibi”), bir çift değerlik elektron bulutunun üst üste binmesi (paylaşılması) ile oluşan kimyasal bir bağdır. İletişimi sağlayan elektron bulutlarına (elektronlara) ortak elektron çifti denir.
Kovalent bağ terimi ilk kez 1919'da Nobel Ödülü sahibi Irving Langmuir tarafından icat edildi. Terim, elektronların serbest olduğu metalik bir bağın veya atomlardan birinin bir elektronu bırakıp katyona ve diğer atomun haline geldiği iyonik bağın aksine, elektronların paylaşımını içeren bir kimyasal bağa atıfta bulunuyordu. Bir elektronu kabul edip anyona dönüştü.
Daha sonra (1927), F. London ve W. Heitler, hidrojen molekülü örneğini kullanarak, kuantum mekaniği açısından kovalent bağın ilk tanımını verdiler.
M. Born dalga fonksiyonunun istatistiksel yorumu dikkate alındığında, bağlanan elektronları bulmanın olasılık yoğunluğu, molekülün çekirdekleri arasındaki boşlukta yoğunlaşmıştır (Şekil 1). Elektron çifti itme teorisi, bu çiftlerin geometrik boyutlarını dikkate alır. Böylece, her periyodun elemanları için bir elektron çiftinin (A) belirli bir ortalama yarıçapı vardır:
Neon'a kadar olan öğeler için 0,6; argona kadar olan elementler için 0,75; Kripton'a kadar olan elementler için 0,75 ve ksenona kadar olan elementler için 0,8.
Kovalent bir bağın karakteristik özellikleri (yönlülük, doygunluk, polarite, polarize edilebilirlik) bileşiklerin kimyasal ve fiziksel özelliklerini belirler.
Bağlantının yönü, maddenin moleküler yapısı ve molekülünün geometrik şekli ile belirlenir. İki bağ arasındaki açılara bağ açıları denir.
Doyabilirlik, atomların sınırlı sayıda kovalent bağ oluşturma yeteneğidir. Bir atomun oluşturduğu bağların sayısı, dış atomik yörüngelerinin sayısıyla sınırlıdır.
Bağın polaritesi, atomların elektronegatifliklerindeki farklılıklar nedeniyle elektron yoğunluğunun eşit olmayan dağılımından kaynaklanmaktadır. Bu temelde, kovalent bağlar polar olmayan ve polar (polar olmayan - diatomik bir molekül aynı atomlardan (H2, Cl2, N2) oluşur ve her atomun elektron bulutları bu atomlara göre simetrik olarak dağıtılır; polar - diatomik bir molekül, farklı kimyasal elementlerin atomlarından oluşur ve toplam elektron bulutu atomlardan birine doğru kayar, böylece moleküldeki elektrik yükünün dağılımında bir asimetri oluşturarak molekülün bir dipol momentini oluşturur).
Yanıtlayan: Dinara Zaripova[guru]
4 çeşit kimyasal vardır. bağlantılar (belki daha fazla, ama en yaygın olanlara bakalım)
1) kovalent - METAL OLMAYANLAR arasındaki bağ
a) polar olmayan - aynı kimyasalın atomları arasında. element (O2)
b) kutupsal - farklı kimyasalların atomları arasında. elementler (HCl)
2) iyonik - metaller ve metal olmayanlar arasında
3) metal - METALLER arasında
4) hidrojen (organik kimyasal) - her türlü kimyasal bağ arasında özel bir yere sahiptir. İki elektronegatif iyon (örneğin oksijen atomu) arasında bulunan bir hidrojen atomu tarafından sağlanır.
Yanıtlayan: Aliya Yesenbayeva[guru]
İyonik, kovalent (polar ve polar olmayan) vardır... İyonik METAL+METAL OLMAYAN, örneğin Slav---NA+CL....Kovalent---Metal olmayan+metal olmayan... Daha önce de söylediğim gibi, 2 tür kovalent bağ vardır -polar, 2 farklı elementin (Metal olmayanlar) birleştirildiği zamandır, örneğin H+Cl ve polar olmayan hemen hemen her zaman basit maddelerdir, örneğin Cl2.F2.O2 ve benzeri)) Kimyada 4'üm var, ancak bağlantılı olarak 5'im var ))Bize ulaşın)) İyi şanslar Slavik)) Anlamadıysanız temsilciye yazın))
Yanıtlayan: Tatyana Ivanova[guru]
Metalik bağ hakkında her şey doğrudur: metal kristalindeki atomlar arasındaki bağdır.
Kovalent (polar olmayan ve polar) ve iyonik bağlara gelince, bağın türü elementlerin elektronegatifliklerindeki farka göre belirlenir (elektronegatiflik değeri tabloda veya referans kitabındaki elektronegatiflik ölçeğinde görülebilir; bazı ders kitapları):
- elektronegatiflikteki fark 0 ise, bu durumda bağ KOVALENT OLMAYAN bir bağdır - metal olmayan bir elementin atomları arasında (Cl2, H2, O2, P4, grafit ve elmastaki karbon atomları arasında...);
- elektronegatiflikteki fark 0 ila 2 arasındaysa (0 ve 2 hariç), o zaman bağ KOVALENT POLAR'dır - farklı metal olmayan atomlar arasında (örneğin, H2O, PCl5, CS2) ve ayrıca bir dizide metal olmayan metal bileşiklerinin (örneğin, germanyum oksit GeO2 - elektronegatiflik farkı 3,50 - 2,02 = 1,48; magnezyum silisit Mg2Si - elektronegatiflik farkı 2,25 - 1,23 = 1,02);
- elektronegatiflikteki fark 2'den büyük veya ona eşitse, İYONİK bağ, periyodik tabloda birbirinden uzakta bulunan metaller ve metal olmayanlar (1 ve 2 grubunun metalleri ve metal olmayanlar) arasındaki bir bağdır. gruplar 6 ve 7, örneğin: kalsiyum oksit CaO - elektronegatiflik farkı 3,50 - 0,86 = 2,64'e eşittir; potasyum florür KF - elektronegatiflik farkı 4,10 - 0,91 = 3,19'dur.
Bu nedenle, bir kovalent polar bağ, bir kovalent polar olmayan bağ ile bir iyonik bağ arasında bir geçiş olarak düşünülebilir. İyonik ve kovalent polar bağlar arasında net bir sınır yoktur, kovalent ve iyonik bağların oluşum mekanizması aynı olduğundan iyonik bağ, kovalent polar bağın aşırı derecesidir.
Bu nedenle, bağın türünü belirlerken önceki cevaplara göre hareket edin, ancak bir metal ile metal olmayan arasındaki bağın türünü netleştirmeniz gerekiyorsa (bu bağ her zaman iyonik değildir!), o zaman elektronegatiflik ölçeğini kullanın.
170009 0
Her atomun belirli sayıda elektronu vardır.
Kimyasal reaksiyonlara girerken atomlar elektron verir, kazanır veya paylaşarak en kararlı elektronik konfigürasyona ulaşır. En düşük enerjiye sahip konfigürasyonun (soy gaz atomlarında olduğu gibi) en kararlı olduğu ortaya çıkıyor. Bu modele “sekizli kural” denir (Şekil 1).
Pirinç. 1.
Bu kural herkes için geçerlidir bağlantı türleri. Atomlar arasındaki elektronik bağlantılar, en basit kristallerden en sonunda canlı sistemler oluşturan karmaşık biyomoleküllere kadar kararlı yapılar oluşturmalarına olanak tanır. Sürekli metabolizmaları nedeniyle kristallerden farklıdırlar. Aynı zamanda birçok kimyasal reaksiyon mekanizmalara göre ilerlemektedir. elektronik transfer Vücuttaki enerji süreçlerinde kritik bir rol oynayanlar.
Kimyasal bağ, iki veya daha fazla atomu, iyonu, molekülü veya bunların herhangi bir kombinasyonunu bir arada tutan kuvvettir..
Kimyasal bağın doğası evrenseldir: negatif yüklü elektronlar ile pozitif yüklü çekirdekler arasındaki, atomların dış kabuğundaki elektronların konfigürasyonuyla belirlenen elektrostatik bir çekim kuvvetidir. Bir atomun kimyasal bağ oluşturma yeteneğine denir değerlik, veya oksidasyon durumu. Kavramı değerlik elektronları- kimyasal bağlar oluşturan, yani en yüksek enerji yörüngelerinde bulunan elektronlar. Buna göre atomun bu yörüngeleri içeren dış kabuğuna denir. değerlik kabuğu. Şu anda kimyasal bir bağın varlığını belirtmek yeterli değildir, ancak türünü açıklığa kavuşturmak gerekir: iyonik, kovalent, dipol-dipol, metalik.
İlk bağlantı türüiyonik bağlantı
Lewis ve Kossel'in elektronik değerlik teorisine göre atomlar kararlı bir elektronik konfigürasyona iki şekilde ulaşabilirler: Birincisi, elektronları kaybederek, katyonlar ikincisi, onları elde etmek, dönüştürmek anyonlar. Elektron transferi sonucunda zıt işaretli yüklere sahip iyonlar arasındaki elektrostatik çekim kuvveti nedeniyle Kossel tarafından "kimyasal bağ" olarak adlandırılan bir kimyasal bağ oluşur. elektrovalent"(şimdi denir iyonik).
Bu durumda anyonlar ve katyonlar dolu bir dış elektron kabuğu ile kararlı bir elektronik konfigürasyon oluşturur. Tipik iyonik bağlar, periyodik sistemin T ve II gruplarının katyonlarından ve VI ve VII gruplarının metalik olmayan elementlerinin anyonlarından oluşur (sırasıyla 16 ve 17 alt grup, kalkojenler Ve halojenler). İyonik bileşiklerin bağları doymamış ve yönsüz olduğundan diğer iyonlarla elektrostatik etkileşim olasılığını korurlar. Şek. Şekil 2 ve 3, Kossel elektron transfer modeline karşılık gelen iyonik bağların örneklerini göstermektedir.
Pirinç. 2.
Pirinç. 3. Sofra tuzu molekülündeki iyonik bağ (NaCl)
Burada maddelerin doğadaki davranışını açıklayan bazı özellikleri hatırlamak, özellikle de şu düşünceyi dikkate almak yerinde olacaktır: asitler Ve sebepler.
Tüm bu maddelerin sulu çözeltileri elektrolitlerdir. Farklı renk değiştiriyorlar göstergeler. Göstergelerin etki mekanizması F.V. Ostwald. Göstergelerin, rengi ayrışmamış ve ayrışmamış hallerde farklılık gösteren zayıf asitler veya bazlar olduğunu gösterdi.
Bazlar asitleri nötralize edebilir. Bazların tümü suda çözünmez (örneğin, OH grupları içermeyen bazı organik bileşikler çözünmez, özellikle trietilamin N(C2H5)3); çözünür bazlara denir alkaliler.
Asitlerin sulu çözeltileri karakteristik reaksiyonlara girer:
a) metal oksitlerle - tuz ve su oluşumuyla;
b) metallerle - tuz ve hidrojen oluşumuyla;
c) karbonatlarla - tuz oluşumuyla, CO 2 ve N 2 O.
Asitlerin ve bazların özellikleri çeşitli teorilerle açıklanmaktadır. S.A.'nın teorisine göre. Arrhenius, asit iyonlara ayrışan bir maddedir N+, baz iyon oluştururken O- . Bu teori, hidroksil grupları olmayan organik bazların varlığını hesaba katmaz.
Uyarınca proton Brønsted ve Lowry'nin teorisine göre asit, proton veren moleküller veya iyonlar içeren bir maddedir ( bağışçılar protonlar) ve baz, protonları kabul eden moleküllerden veya iyonlardan oluşan bir maddedir ( kabul edenler protonlar). Sulu çözeltilerde hidrojen iyonlarının hidratlı formda, yani hidronyum iyonları formunda bulunduğunu unutmayın. H3O+ . Bu teori, yalnızca su ve hidroksit iyonlarıyla değil, aynı zamanda bir çözücünün yokluğunda veya sulu olmayan bir çözücüyle gerçekleştirilen reaksiyonları da açıklar.
Örneğin amonyak arasındaki reaksiyonda N.H. 3 (zayıf baz) ve gaz fazında hidrojen klorür, katı amonyum klorür oluşur ve iki maddenin denge karışımında her zaman ikisi asit, diğer ikisi baz olmak üzere 4 parçacık vardır:
Bu denge karışımı iki eşlenik asit ve baz çiftinden oluşur:
1)N.H. 4+ ve N.H. 3
2) HC1 Ve Cl ‑
Burada her eşlenik çiftte asit ve baz bir proton kadar farklılık gösterir. Her asitin bir konjuge bazı vardır. Güçlü bir asidin zayıf bir konjuge bazı vardır ve zayıf bir asidin güçlü bir konjuge bazı vardır.
Brønsted-Lowry teorisi, suyun biyosferin yaşamındaki benzersiz rolünü açıklamaya yardımcı olur. Su, etkileşime girdiği maddeye bağlı olarak asit veya baz özellikleri gösterebilir. Örneğin, asetik asidin sulu çözeltileri ile reaksiyonlarda su bir bazdır ve sulu amonyak çözeltileri ile reaksiyonlarda bir asittir.
1) CH3COOH + H2O ↔ H3O + + CH 3 COO- . Burada bir asetik asit molekülü, bir su molekülüne bir proton bağışlıyor;
2) NH3 + H2O ↔ NH4 + + O- . Burada bir amonyak molekülü, bir su molekülünden bir protonu kabul eder.
Böylece su iki eşlenik çift oluşturabilir:
1) H2O(asit) ve O- (eşlenik baz)
2) H3O+ (asit) ve H2O(eşlenik baz).
İlk durumda su bir proton verir, ikincisinde ise onu kabul eder.
Bu özelliğe denir amfiprotonizm. Hem asit hem baz olarak tepkimeye girebilen maddelere denir amfoterik. Bu tür maddeler genellikle canlı doğada bulunur. Örneğin amino asitler hem asitlerle hem de bazlarla tuz oluşturabilirler. Bu nedenle peptitler, mevcut metal iyonlarıyla kolayca koordinasyon bileşikleri oluşturur.
Dolayısıyla iyonik bir bağın karakteristik özelliği, bağlanan elektronların çekirdeklerden birine tam hareketidir. Bu, iyonlar arasında elektron yoğunluğunun neredeyse sıfır olduğu bir bölge olduğu anlamına gelir.
İkinci bağlantı türü isekovalent bağlantı
Atomlar elektronları paylaşarak kararlı elektronik konfigürasyonlar oluşturabilirler.
Böyle bir bağ, bir çift elektronun teker teker paylaşılmasıyla oluşur herkesten atom. Bu durumda paylaşılan bağ elektronları atomlar arasında eşit olarak dağıtılır. Kovalent bağların örnekleri şunları içerir: homonükleer iki atomlu H molekülleri 2 , N 2 , F 2. Allotroplarda aynı tür bağlantı bulunur O 2 ve ozon O 3 ve çok atomlu bir molekül için S 8 ve ayrıca heteronükleer moleküller hidrojen klorür HC1, karbondioksit CO 2, metan CH 4, etanol İLE 2 N 5 O, kükürt heksaflorür SF 6, asetilen İLE 2 N 2. Bu moleküllerin tümü aynı elektronları paylaşır ve bağları aynı şekilde doyurulur ve yönlendirilir (Şekil 4).
Biyologlar için çift ve üçlü bağların, tekli bağa kıyasla daha düşük kovalent atom yarıçapına sahip olması önemlidir.
Pirinç. 4. Cl2 molekülündeki kovalent bağ.
İyonik ve kovalent bağ türleri, mevcut birçok kimyasal bağ türünün iki uç örneğidir ve pratikte bağların çoğu orta düzeydedir.
Periyodik sistemin aynı veya farklı periyotlarının zıt uçlarında bulunan iki elementin bileşikleri ağırlıklı olarak iyonik bağlar oluşturur. Elementler bir periyotta birbirine yaklaştıkça bileşiklerinin iyonik yapısı azalır ve kovalent karakter artar. Örneğin, periyodik tablonun sol tarafındaki elementlerin halojenürleri ve oksitleri ağırlıklı olarak iyonik bağlar oluşturur ( NaCl, AgBr, BaSO 4, CaCO 3, KNO 3, CaO, NaOH) ve tablonun sağ tarafındaki elementlerin aynı bileşikleri kovalenttir ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH, glikoz C 6 H 12 Ç 6, etanol C 2 H 5 OH).
Kovalent bağın ise bir modifikasyonu daha vardır.
Çok atomlu iyonlarda ve karmaşık biyolojik moleküllerde her iki elektron da ancak bir atom. Buna denir bağışçı elektron çifti. Bu elektron çiftini bir donörle paylaşan atoma denir. akseptör elektron çifti. Bu tip kovalent bağa denir koordinasyon (bağışçı-alıcı, veyadatif) iletişim(Şekil 5). Bu tür bir bağ, biyoloji ve tıp için çok önemlidir, çünkü metabolizma için en önemli olan d-elementlerin kimyası büyük ölçüde koordinasyon bağları ile tanımlanır.
İncir. 5.
Kural olarak, karmaşık bir bileşikte metal atomu, bir elektron çiftinin alıcısı olarak hareket eder; aksine iyonik ve kovalent bağlarda metal atomu bir elektron donörüdür.
Kovalent bağın özü ve çeşitliliği - koordinasyon bağı - GN tarafından önerilen başka bir asit ve baz teorisi yardımıyla açıklığa kavuşturulabilir. Lewis. Brønsted-Lowry teorisine göre "asit" ve "baz" terimlerinin anlamsal kavramını bir miktar genişletti. Lewis'in teorisi, karmaşık iyonların oluşumunun doğasını ve maddelerin nükleofilik ikame reaksiyonlarına, yani CS oluşumuna katılımını açıklar.
Lewis'e göre asit, bir bazdan bir elektron çifti alarak kovalent bağ oluşturabilen bir maddedir. Bir Lewis bazı, elektron bağışlayarak Lewis asidi ile kovalent bir bağ oluşturan, yalnız bir elektron çiftine sahip bir maddedir.
Yani Lewis'in teorisi asit-baz reaksiyonlarının kapsamını protonların hiç katılmadığı reaksiyonlara kadar genişletiyor. Üstelik bu teoriye göre protonun kendisi de bir asittir çünkü bir elektron çiftini kabul edebilmektedir.
Dolayısıyla bu teoriye göre katyonlar Lewis asitleri, anyonlar ise Lewis bazlarıdır. Bir örnek aşağıdaki reaksiyonlar olabilir:
Yukarıda, kovalent moleküllerde metal atomlarından alıcı atomlara tam elektron transferi meydana gelmediğinden, maddelerin iyonik ve kovalent olarak bölünmesinin göreceli olduğu belirtilmişti. İyonik bağa sahip bileşiklerde her iyon, zıt işaretli iyonların elektrik alanında olduğundan karşılıklı olarak polarize olur ve kabukları deforme olur.
Polarize edilebilirlik iyonun elektronik yapısı, yükü ve boyutuna göre belirlenir; anyonlar için katyonlardan daha yüksektir. Katyonlar arasında en yüksek polarize edilebilirlik, daha yüksek yüklü ve daha küçük boyutlu katyonlar içindir; örneğin, Hg 2+, Cd 2+, Pb 2+, Al 3+, Tl 3+. Güçlü bir polarizasyon etkisine sahiptir N+ . İyon polarizasyonunun etkisi iki yönlü olduğundan oluşturdukları bileşiklerin özelliklerini önemli ölçüde değiştirir.
Üçüncü bağlantı türü isedipol-dipol bağlantı
Listelenen iletişim türlerine ek olarak dipol-dipol de vardır. moleküller arası etkileşimler de denir van der Waals .
Bu etkileşimlerin gücü moleküllerin doğasına bağlıdır.
Üç tür etkileşim vardır: kalıcı dipol - kalıcı dipol ( dipol-dipol cazibe); kalıcı dipol - indüklenen dipol ( tümevarım cazibe); anlık dipol - indüklenen dipol ( dağıtıcı cazibe veya Londra kuvvetleri; pirinç. 6).
Pirinç. 6.
Yalnızca polar kovalent bağları olan moleküllerin dipol-dipol momenti vardır ( HCl, NH3, S02, H20, C6H5Cl) ve bağ gücü 1-2'dir Debaya(1D = 3,338 × 10‑30 coulomb metre - C × m).
Biyokimyada başka bir tür bağlantı daha vardır: hidrojen sınırlayıcı bir durum olan bağlantı dipol-dipol cazibe. Bu bağ, bir hidrojen atomu ile küçük bir elektronegatif atom (çoğunlukla oksijen, flor ve nitrojen) arasındaki çekimle oluşur. Benzer elektronegatifliğe sahip büyük atomlarda (klor ve kükürt gibi) hidrojen bağı çok daha zayıftır. Hidrojen atomu önemli bir özelliğiyle diğerlerinden ayrılır: Bağ elektronları çekildiğinde çekirdeği (proton) açığa çıkar ve artık elektronlar tarafından korunmaz.
Bu nedenle atom büyük bir dipole dönüşür.
Van der Waals bağından farklı olarak bir hidrojen bağı yalnızca moleküller arası etkileşimler sırasında değil aynı zamanda bir molekül içinde de oluşur. molekül içi hidrojen bağı. Hidrojen bağları biyokimyada önemli bir rol oynar, örneğin proteinlerin yapısını a-sarmal formunda stabilize etmek veya DNA'nın çift sarmalının oluşumu için (Şekil 7).
Şekil 7.
Hidrojen ve van der Waals bağları iyonik, kovalent ve koordinasyon bağlarından çok daha zayıftır. Moleküller arası bağların enerjisi tabloda gösterilmiştir. 1.
Tablo 1. Moleküller arası kuvvetlerin enerjisi
Not: Moleküller arası etkileşimlerin derecesi erime ve buharlaşma (kaynama) entalpisi ile yansıtılır. İyonik bileşikler, iyonları ayırmak için molekülleri ayırmaktan önemli ölçüde daha fazla enerji gerektirir. İyonik bileşiklerin erime entalpisi moleküler bileşiklerinkinden çok daha yüksektir.
Dördüncü bağlantı türü isemetal bağlantı
Son olarak başka bir tür moleküller arası bağ daha vardır: maden: metal bir kafesin pozitif iyonlarının serbest elektronlarla bağlantısı. Bu tür bir bağlantı biyolojik nesnelerde oluşmaz.
Bağ türlerinin kısa bir incelemesinden bir ayrıntı netleşir: Bir metal atomunun veya iyonunun (bir elektron vericisi) ve bir atomun (elektron alıcısı) önemli bir parametresi, onun boyut.
Ayrıntılara girmeden, periyodik tablodaki gruplarda atom numaraları arttıkça atomların kovalent yarıçaplarının, metallerin iyonik yarıçaplarının ve etkileşen moleküllerin van der Waals yarıçaplarının arttığını not ediyoruz. Bu durumda iyon yarıçaplarının değerleri en küçük, van der Waals yarıçapları ise en büyüğüdür. Kural olarak, grupta aşağı doğru ilerledikçe hem kovalent hem de van der Waals olmak üzere tüm elementlerin yarıçapları artar.
Biyologlar ve doktorlar için en büyük önem taşıyanlar koordinasyon(bağışçı-alıcı) koordinasyon kimyası tarafından dikkate alınan bağlar.
Tıbbi biyoinorganikler. G.K. Baraşkov
 Lüminesans: türleri, yöntemleri, uygulamaları
Lüminesans: türleri, yöntemleri, uygulamaları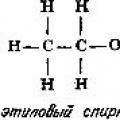 Organik kimyanın temel prensipleri Organik reaksiyonların sınıflandırılması
Organik kimyanın temel prensipleri Organik reaksiyonların sınıflandırılması Öğretmen ile öğretmen arasındaki fark Öğretmen ile öğretmen arasındaki fark nedir
Öğretmen ile öğretmen arasındaki fark Öğretmen ile öğretmen arasındaki fark nedir