Aldehyd octowy. Właściwości fizyczne i termiczne
Zobacz także:
- OCTONY, sole kwasu octowego, stosowane są w praktyce laboratoryjnej do sporządzania roztworów buforowych. Po wprowadzeniu do organizmu A., podobnie jak inne sole kwasów tłuszczowych, ulegają utlenieniu do soli dwutlenku węgla, powodując wzrost zasadowości krwi i...
- ACETYLEN, zawiera substancję chemiczną wzór C2H2 (wzór struktury HC CH) i jest w zwykłych warunkach bezbarwnym trującym gazem w temperaturze 0° i 26 atm. skraplając się w ciecz. 1 l A. ...
- ACETOSON, benzozon, C6H6C0.02.COSN„ nadtlenek benzoiloacetylu, biały krystaliczny. proszek, stopiony, w temperaturze 40°, rozpuszczalny w wodzie; roztwory wodne, takie jak nadtlenek wodoru, są silnymi utleniaczami; acetozon rozkłada się przez zasady i substancje organiczne; po podgrzaniu...
- ACETYMETR(od łac. acetum – ocet i greckiego metron – miara), wynalezione przez Otto urządzenie służące do określania ilości wolnego kwasu octowego w occie w przypadkach, gdy występują w nim obce kwasy i...
- ACETON, CH3-CO-CH3 (dimetyloketon), bezbarwna, palna ciecz o ciężarze właściwym 0,79 w temperaturze 18°, o przyjemnym zapachu i palącym smaku. Wrze w temperaturze 56,5°, łatwo rozpuszcza się w wodzie, alkoholu i eterze. Okazuje się, że aceton...
Wstęp
Obecnie znane są miliony związków chemicznych. A większość z nich jest organiczna. Substancje te są podzielone na kilka dużych grup, nazwa jednej z nich to aldehydy. Dziś przyjrzymy się przedstawicielowi tej klasy – aldehydowi octowemu.
Definicja
Aldehyd octowy jest związkiem organicznym z grupy aldehydów. Można go też nazwać inaczej: aldehydem octowym, etanalem lub metyloformaldehydem. Wzór aldehydu octowego to CH3-CHO.
Właściwości


Paragon
Aldehyd octowy powstaje głównie w wyniku utleniania etylenu (proces Wackera). Chlorek palladu działa jako środek utleniający. Substancję tę można również otrzymać podczas hydratacji acetylenu, który zawiera sole rtęci. Produktem reakcji jest enol, który izomeryzuje do pożądanej substancji. Inną metodą wytwarzania aldehydu octowego, która była najbardziej popularna na długo przed poznaniem procesu Wackera, jest utlenianie lub odwadnianie etanolu w obecności katalizatorów miedziowych lub srebrnych. Podczas odwadniania oprócz pożądanej substancji powstaje wodór, a podczas utleniania - woda.
Aplikacja
Stosując omawiany związek otrzymuje się butadien, polimery aldehydowe i niektóre substancje organiczne, w tym kwas o tej samej nazwie. Powstaje podczas utleniania. Reakcja wygląda następująco: „tlen + aldehyd octowy = kwas octowy”. Etanal jest ważnym prekursorem wielu pochodnych i ta właściwość jest szeroko stosowana w syntezie
wiele substancji. W organizmach ludzkich, zwierzęcych i roślinnych aldehyd octowy uczestniczy w niektórych złożonych reakcjach. Jest także częścią dymu papierosowego.
Wniosek
Aldehyd octowy może być zarówno korzystny, jak i szkodliwy. Jest szkodliwy dla skóry, jest drażniący i prawdopodobnie rakotwórczy. Dlatego jego obecność w organizmie jest niepożądana. Ale niektórzy ludzie sami prowokują pojawienie się aldehydu octowego, paląc papierosy i pijąc alkohol. Pomyśl o tym!
900 mg/kg (myszy, doustnie),
661 mg/kg (szczury, doustnie)
Aldehyd octowy (aldehyd octowy, etanal, metyloformaldehyd) - związek organiczny z klasy aldehydów o wzorze chemicznym CH 3 -CHO, jest aldehydem etanolu i kwasu octowego. Jest to jeden z najważniejszych aldehydów, powszechnie występujący w przyrodzie i produkowany w dużych ilościach przemysłowo. Aldehyd octowy występuje w kawie, dojrzałych owocach, pieczywie i jest syntetyzowany przez rośliny w wyniku ich metabolizmu. Wytwarzany także przez utlenianie etanolu.
Właściwości fizyczne
Substancja jest bezbarwną cieczą o ostrym zapachu, rozpuszczalną w wodzie, alkoholu i eterze. Ze względu na bardzo niską temperaturę wrzenia (20,2°C), aldehyd octowy jest magazynowany i transportowany w postaci trimeru – paraldehydu, z którego można go otrzymać poprzez ogrzewanie z kwasami mineralnymi (najczęściej kwasem siarkowym).
Paragon
W 2003 roku światowa produkcja wynosiła około miliona ton rocznie.
Główną metodą produkcji jest utlenianie etylenu (proces Wackera):
Chlorek palladu stosuje się jako środek utleniający w procesie Wackera, który regeneruje się poprzez utlenianie chlorkiem miedzi w obecności tlenu atmosferycznego:
Aldehyd octowy wytwarza się również przez uwodnienie acetylenu w obecności soli (reakcja Kucherowa), w wyniku czego powstaje enol, który izomeryzuje do aldehydu:
Do odkrycia procesu Wackera dominowała inna metoda. Polegał on na utlenianiu lub odwodornieniu alkoholu etylowego przy użyciu katalizatora miedziowego lub srebrnego.
Reaktywność
Pod względem właściwości chemicznych aldehyd octowy jest typowym aldehydem alifatycznym i dla niego charakterystyczne są reakcje tej klasy związków. O jego reaktywności decydują dwa czynniki: aktywność karbonylu grupy aldehydowej i ruchliwość atomów wodoru grupy metylowej, ze względu na indukcyjne działanie karbonylu.
Podobnie jak inne związki karbonylowe z atomami wodoru przy atomie węgla α, aldehyd octowy tautomeryzuje, tworząc enolowy alkohol winylowy, równowaga jest prawie całkowicie przesunięta w stronę formy aldehydowej (stała równowagi wynosi tylko 6 · 10 –5 w temperaturze pokojowej):
Reakcja kondensacji
Ze względu na mały rozmiar cząsteczki i dostępność jako bezwodny monomer (w przeciwieństwie do formaldehydu), aldehyd octowy jest powszechnym środkiem elektrofilowym w syntezie organicznej. Jeśli chodzi o reakcje kondensacji, aldehyd jest prochiralny. Stosowany jest przede wszystkim jako źródło syntonu „CH3C+H(OH)” w aldolu i pokrewnych reakcjach kondensacji. Odczynnik Grignarda i związki litoorganiczne reagują z MeCHO, tworząc pochodne hydroksyetylowe. W jednej z reakcji kondensacji dodaje się trzy równoważniki formaldehydu i jedna redukuje powstały aldehyd, tworząc pentaerytrytol (C(CH2OH)4.) z MeCHO.
Aldehyd octowy jest również ważnym elementem budulcowym w syntezie związków heterocyklicznych. Znakomitym przykładem jest konwersja za pomocą amoniaku do 5-etylo-2-metylopirydyny („aldehyd-kolidyna”)
Reakcja kondensacji aldolowej spowodowana jest ruchliwością wodoru w pozycji alfa rodnika i przebiega w obecności rozcieńczonych zasad. Można to uznać za reakcję nukleofilowej addycji jednej cząsteczki aldehydu do drugiej:
Pochodne acetalu
Trzy cząsteczki aldehydu octowego kondensują, tworząc „paraldehyd”, cykliczny trimer zawierający pojedyncze wiązania C-O. W wyniku kondensacji czterech cząsteczek powstaje cykliczny związek zwany metaldehydem.
Aldehyd octowy tworzy trwałe acetale podczas reakcji z etanolem w warunkach odwodnienia. Produkt CH3CH(OCH2CH3)2 nazywany jest „acetalem”, chociaż termin ten jest używany do opisania szerszej grupy związków o ogólnym wzorze RCH(OR”)2.
Aplikacja
Aldehyd octowy służy do produkcji kwasu octowego, butadienu, niektórych substancji organicznych i polimerów aldehydowych.
Tradycyjnie aldehyd octowy był używany głównie jako prekursor kwasu octowego. Wniosek ten został odrzucony ze względu na fakt, że kwas octowy jest wydajniej wytwarzany z metanolu w procesach Monsanto i Kativa. Jeśli chodzi o reakcję kondensacji, aldehyd octowy jest ważnym prekursorem pochodnych pirydyny, pentaerytrolu i aldehydu krotonowego. Mocznik i aldehyd octowy kondensują, tworząc żywice. Bezwodnik octowy reaguje z aldehydem octowym, dając dioctan etylidenu, z którego otrzymuje się octan winylu, monomer polioctanu winylu.
Biochemia
Choroba Alzheimera
Osoby, którym brakuje czynnika genetycznego odpowiedzialnego za konwersję aldehydu octowego do kwasu octowego, mogą być narażone na większe ryzyko rozwoju choroby Alzheimera. „Wyniki te wskazują, że brak ALDH2 jest czynnikiem ryzyka choroby Alzheimera o późnym początku”.
Problem alkoholowy
Aldehyd octowy pochodzący ze spożytego etanolu wiąże enzymy, tworząc addukty związane z chorobami narządów. Lek disulfiram (Antabuse) zapobiega utlenianiu aldehydu octowego do kwasu octowego. Daje to nieprzyjemne uczucie podczas picia alkoholu. Antabuse stosuje się, gdy sam alkoholik chce wyzdrowieć.
Czynnik rakotwórczy
Aldehyd octowy jest substancją rakotwórczą grupy 1. „Istnieje wiele dowodów na rakotwórczość aldehydu octowego (głównego metabolitu etanolu) w doświadczeniach na zwierzętach”, ponadto aldehyd octowy uszkadza DNA i powoduje rozwój mięśni nieproporcjonalny do całkowitej masy ciała, co jest związane z brakiem równowagi w równowadze białkowej organizmu. W wyniku badania przeprowadzonego na 818 alkoholikach naukowcy doszli do wniosku, że u pacjentów, którzy byli narażeni na większe działanie aldehydu octowego, występował defekt w genie enzymu dehydrogenazy alkoholowej. Dlatego u takich pacjentów występuje większe ryzyko zachorowania na nowotwory górnego odcinka przewodu pokarmowego i wątroby.
Bezpieczeństwo
Aldehyd octowy jest toksyczny dla skóry, drażniący i rakotwórczy. Jednak toksyczność aldehydu octowego jest niższa niż formaldehydu, ponieważ aldehyd octowy jest szybko utleniany w organizmie do nieszkodliwego kwasu octowego. Jest również substancją zanieczyszczającą powietrze podczas spalania, palenia i spalin samochodowych. Ponadto etanal powstaje podczas obróbki cieplnej polimerów i tworzyw sztucznych.
Długotrwały kontakt z powietrzem może spowodować powstanie nadtlenków i wybuch, który może zniszczyć pojemnik.
- Skóra: Nosić odpowiednią odzież ochronną, aby zapobiec kontaktowi ze skórą.
- Oczy: Stosowanie odpowiednich środków ochrony oczu
- Zmiana odzieży: Gdy jest mokra (ze względu na ryzyko pożaru)
- Zalecenia: Zainstaluj fontanny do przemywania oczu, zapewnij miejsca do szybkiej zmiany
Zastosowanie RPE
W przypadku przekroczenia maksymalnego dopuszczalnego stężenia należy zastosować RPE izolacyjne o stałym nadciśnieniu pod maską pełnotwarzową (dopływ powietrza pod ciśnieniem itp.). W przypadku stosowania RPE z wężem muszą być one wyposażone w pomocniczy, niezależny aparat oddechowy ze stałym nadciśnieniem pod maską i okresem użytkowania wystarczającym do opuszczenia miejsca niebezpiecznego w przypadku przerwania dopływu powietrza przez wąż.
Do ewakuacji można zastosować RPE filtrujące z maską pełnotwarzową i filtrami chroniącymi przed oparami związków organicznych lub aparat izolacyjny.
Wrodzona nietolerancja alkoholu
Jednym z mechanizmów wrodzonej nietolerancji alkoholu jest gromadzenie się aldehydu octowego.
Napisz recenzję o artykule "Aldehyd octowy"
Notatki
- Encyklopedia chemiczna / Redakcja: Knunyants I.L. i inne. - M.: Encyklopedia radziecka, 1988. - T. 1. - 623 s.
- Marzec, J. „Chemia organiczna: reakcje, mechanizmy i struktury” J. Wiley, Nowy Jork: 1992. ISBN 0-471-58148-8.
- Sowin, TJ; Melcher, LM „Acetaldehyde” w Encyklopedii odczynników do syntezy organicznej (wyd.: L. Paquette) 2004, J. Wiley & Sons, Nowy Jork. DOI:10.1002/047084289
- pl: Synteza aminokwasów Streckera
- Kendall, EC McKenzie, BF (1941), „dl-Alanine”, Org. Syntezator; Kol. Tom. 1:21
- Wittiga, G.; Hesse, A. (1988), „Ukierunkowane kondensacje aldolowe: β-fenylocynamonowy aldehyd”, Org. Syntezator; Kol. Tom. 6:901
- Frank, RL; Pilgrim, FJ; Riener, EF (1963), „5-etylo-2-metylopirydyna”, Org. Syntezator; Kol. Tom. 4:451
- Adkins, H.; Nissen, BH (1941), „Acetal”, Org. Syntezator; Kol. Tom. 1:1
- pl: Proces Monsanto
- pl:Proces Cativa
- NAD+ do NADH Hipolito, L.; Sanchez, MJ; Polache, A.; Granero, L. Metabolizm mózgu etanolu i alkoholizmu: aktualizacja. Aktualny Metab. leków. 2007, 8, 716-727
- „Niedobór mitochondrialnego ALDH2 jako stres oksydacyjny”. Annals of the New York Academy of Sciences 1011: 36-44. Kwiecień 2004. doi:10.1196/annals.1293.004. PMID 15126281. Źródło 2009-08-13.
- Nakamura, K.; Iwahashi, K.; Furukawa, A.; Ameno, K.; Kinoshita, H.; Ijiri, I.; Sekine, Y.; Suzuki, K.; Iwata, Y.; Minabe, Y.; Mori, N. Addukty aldehydu octowego w mózgu alkoholików. Łuk. Toksyk. 2003, 77, 591.
- (Informacja prasowa). Międzynarodowa Agencja Badań nad Rakiem (IARC). - „2 listopada 2009 r. — IARC zaktualizowało oceny nowotworów dotyczące kilku nawyków osobistych i narażenia w gospodarstwie domowym, które powodują raka, w tym tytoniu, orzechów areka, alkoholu i domowego dymu węglowego. Aktualizację przeprowadzono za radą 30 naukowców z 10 krajów, którzy spotkali się w IARC w październiku 2009 r. [...] Grupa Robocza stwierdziła, że aldehyd octowy związany ze spożyciem alkoholu jest rakotwórczy dla ludzi (Grupa 1) i potwierdziła klasyfikację w Grupie 1 dotyczącego spożycia alkoholu i etanolu w napojach alkoholowych.” Źródło 1 sierpnia 2014 r.
- Podsumowanie chemiczne dotyczące aldehydu octowego, Agencja Ochrony Środowiska Stanów Zjednoczonych
- ^ Nicholas S. Aberle, II, Larry Burd, Bonnie H. Zhao i Jun Ren (2004). „Zaburzenia kurczliwości serca wywołane aldehydem octowym można złagodzić witaminą B1, ale nie witaminami B6 i B12”. Alkohol i alkoholizm 39 (5): 450-454. doi:10.1093/alcalc/agh085.
- Nils Homann, Felix Stickel, Inke R. König, Arne Jacobs, Klaus Junghanns, Monika Benesova, Detlef Schuppan, Susanne Himsel, Ina Zuber-Jerger, Claus Hellerbrand, Dieter Ludwig, Wolfgang H. Caselmann, Helmut K. Seitz Dehydrogenaza alkoholowa 1C* Allel 1 jest markerem genetycznym raka związanego z alkoholem u osób pijących dużo alkoholu International Journal of Cancer tom 118, wydanie 8, strony 1998-2002
- Palenie. (2006). Encyklopedia Britannica. Dostęp: 27 października 2006.
- / Michael E. Barsan (redaktor techniczny). -NIOSH. - Cincinnati, Ohio, 2007. - s. 2. - 454 s. - (publikacja DHHS (NIOSH) nr 2005-149).
|
||||||||||||||||||
Fragment charakteryzujący aldehyd octowy
Gdy władca zbliżał się do jednej flanki batalionów pełniących wartę, na przeciwną flankę wskoczył kolejny tłum jeźdźców, a przed nimi Rostów rozpoznał Napoleona. To nie mógł być nikt inny. Jechał galopem w małym kapeluszu, z andrzejkową wstążką na ramieniu, w niebieskim mundurze rozpiętym pod białą kamizelką, na niezwykle rasowym siwym koniu arabskim, na szkarłatnym, haftowanym złotem siodło. Zbliżając się do Aleksandra, podniósł kapelusz i tym ruchem kawaleryjskie oko Rostowa nie mogło nie zauważyć, że Napoleon siedział słabo i niepewnie na koniu. Bataliony krzyczały: Hurra i Vive l "Empereur! [Niech żyje cesarz!] Napoleon powiedział coś do Aleksandra. Obaj cesarze zsiedli z koni i złapali się za ręce. Na twarzy Napoleona pojawił się nieprzyjemnie udawany uśmiech. Aleksander powiedział coś do go z czułym wyrazem twarzy.Rostów, nie spuszczając wzroku, mimo deptania koni przez oblegających tłum francuskich żandarmów, śledził każdy ruch cesarza Aleksandra i Bonapartego. Zaskoczyło go to, że Aleksander zachowywał się na równi z Bonapartem i że Bonaparte był całkowicie wolny, jakby ta bliskość z władcą była dla niego naturalna i znajoma, jako równy traktował cara rosyjskiego.
Aleksander i Napoleon z długim ogonem swojej świty zbliżyli się do prawej flanki batalionu Preobrażeńskiego, bezpośrednio w stronę stojącego tam tłumu. Tłum znalazł się nagle tak blisko cesarzy, że stojący w pierwszych rzędach Rostow przestraszył się, że go rozpoznają.
„Panie, je vous require la pozwolenie de donner la legion d”honneur au plus braw de vos solutats, [Panie, proszę o pozwolenie na nadanie Orderu Legii Honorowej najodważniejszemu z waszych żołnierzy], powiedział ostry, precyzyjny głos, kończąc każdą literę. Przemówił niski Bonaparte, patrząc prosto w oczy Aleksandra, Aleksander słuchał uważnie, co mówiono, i pochylał głowę, uśmiechając się miło.
„A celui qui s”est le plus vaillament conduit dans cette derieniere guerre, [Temu, który okazał się najodważniejszy podczas wojny]” – dodał Napoleon, podkreślając każdą sylabę, ze spokojem i pewnością siebie oburzającą Rostowa, rozglądając się po szeregach Rosjan rozciągniętych przed nimi stoją żołnierze, wszyscy w straży i nieruchomi, wpatrujący się w twarz swego cesarza.
„Votre majeste me permettra t elle de requester l"avis du pułkownik? [Wasza Wysokość pozwoli mi zapytać o opinię pułkownika?] - powiedział Aleksander i zrobił kilka pospiesznych kroków w stronę księcia Kozłowskiego, dowódcy batalionu. Tymczasem Bonaparte zaczął brać zdjął białą rękawiczkę małą dłonią i rozdarł ją na kawałki, adiutant rzucił ją, pospiesznie pędząc od tyłu i podniósł.
- Komu mam to dać? – cesarz Aleksander zapytał Kozłowskiego niezbyt głośno, po rosyjsku.
- Komu rozkazujesz, Wasza Wysokość? „Cesarz skrzywił się z niezadowolenia i rozglądając się, powiedział:
- Ale musisz mu odpowiedzieć.
Kozłowski zdecydowanym spojrzeniem spojrzał na szeregi i tym spojrzeniem schwytał także Rostów.
„Czy to nie ja?” pomyślał Rostów.
- Łazariew! – rozkazał pułkownik z grymasem; a pierwszy rangą żołnierz, Łazariew, sprytnie wystąpił do przodu.
-Gdzie idziesz? Zatrzymaj się tutaj! - głosy szeptały do Łazariewa, który nie wiedział, dokąd iść. Łazariew zatrzymał się, ze strachem spojrzał w bok na pułkownika, a jego twarz zadrżała, jak to bywa u żołnierzy wezwanych na front.
Napoleon lekko odwrócił głowę do tyłu i cofnął swoją małą pulchną rączkę, jakby chciał coś wziąć. Twarze jego świty, odgadnąwszy w tej chwili, co się dzieje, zaczęły się awanturować, szeptać, przekazując sobie coś, a paź, ten sam, którego Rostow widział wczoraj u Borysa, podbiegł i z szacunkiem pochylił się wyciągniętą rękę i nie kazał jej czekać ani sekundy, umieścił w niej rozkaz na czerwonej wstążce. Napoleon, nie patrząc, zacisnął dwa palce. Zakon znalazł się pomiędzy nimi. Napoleon podszedł do Łazariewa, który przewracając oczami, uparcie w dalszym ciągu patrzył tylko na swojego władcę, a z powrotem spoglądał na cesarza Aleksandra, pokazując w ten sposób, że to, co teraz robił, robił dla swojego sojusznika. Mała biała dłoń z rozkazem dotknęła przycisku żołnierza Łazariewa. To było tak, jakby Napoleon wiedział, że aby ten żołnierz był szczęśliwy, nagrodzony i wyróżniał się na zawsze od wszystkich na świecie, wystarczyło, aby on, ręka Napoleona, była godna dotknięcia piersi żołnierza. Napoleon po prostu przyłożył krzyż do piersi Łazariewa i puszczając jego rękę, zwrócił się do Aleksandra, jakby wiedział, że krzyż powinien przylgnąć do piersi Łazariewa. Krzyż naprawdę utknął.
Pomocne ręce Rosjan i Francuzów natychmiast podniosły krzyż i przyczepiły go do munduru. Łazariew spojrzał ponuro na małego człowieczka z białymi rączkami, który zrobił coś nad nim, i nadal trzymając go w bezruchu na straży, znów zaczął patrzeć prosto w oczy Aleksandra, jakby pytał Aleksandra: czy powinien jeszcze stać, czy kazaliby mu teraz iść na spacer, a może zająć się czymś innym? Ale nie kazano mu nic robić i pozostawał w tym stanie bez ruchu dość długo.
Władcy wsiedli i odjechali. Preobrazhenci, rozbijając szeregi, zmieszali się ze strażnikami francuskimi i zasiedli do przygotowanych dla nich stołów.
Łazariew siedział na honorowym miejscu; Oficerowie rosyjscy i francuscy uściskali go, pogratulowali i uścisnęli mu dłonie. Tłumy oficerów i ludzi podeszły tylko po to, żeby popatrzeć na Łazariewa. Na placu wokół stołów rozległ się ryk rosyjsko-francuskich rozmów i śmiech. Minęło Rostów z zarumienionymi twarzami, wesołych i szczęśliwych.
- Co to za poczęstunek, bracie? „Wszystko jest na srebrze” – powiedział jeden. – Widziałeś Łazariewa?
- Piła.
„Mówią, że jutro naród Preobrażeński ich wyleczy”.
- Nie, Lazarev ma szczęście! Dożywotnia emerytura 10 franków.
- To jest kapelusz, chłopaki! - krzyknął Przemieniony, zakładając kudłaty kapelusz Francuza.
- To cud, jak dobrze, kochanie!
-Słyszałeś recenzję? – powiedział do drugiego oficer straży. Trzeciego dnia był Napoleon, Francja, odważny; [Napoleon, Francja, odwaga;] wczoraj Alexandre, Russie, wielkość; [Aleksander, Rosja, wielkość;] Jednego dnia nasz władca daje informację zwrotną, a następnego Napoleon. Jutro cesarz wyśle Jerzego do najodważniejszego ze strażników francuskich. To niemożliwe! Muszę odpowiedzieć rzeczowo.
Borys i jego przyjaciel Żylinski również przyszli obejrzeć bankiet Przemienienia Pańskiego. Wracając, Borys zauważył Rostowa, który stał w rogu domu.
- Rostów! Cześć; „Nigdy się nie widzieliśmy” – powiedział mu i nie mógł się powstrzymać przed pytaniem, co się z nim stało: twarz Rostowa była tak dziwnie ponura i zdenerwowana.
„Nic, nic” – odpowiedział Rostów.
-Wejdziesz?
- Tak, wejdę.
Rostow długo stał na rogu, patrząc z daleka na biesiadników. W jego umyśle toczyła się bolesna praca, której nie mógł dokończyć. W mojej duszy zrodziły się straszne wątpliwości. Potem przypomniał sobie Denisowa ze zmienionym wyrazem twarzy, z pokorą i cały szpital z tymi odciętymi rękami i nogami, z tym brudem i chorobami. Wydało mu się to tak wyraźnie, że mógł teraz poczuć szpitalny zapach zwłok, że rozejrzał się, aby zrozumieć, skąd mógł pochodzić ten zapach. Potem przypomniał sobie tego zadowolonego z siebie Bonapartego z białą ręką, który był teraz cesarzem, którego cesarz Aleksander kocha i szanuje. Po co odrywane ręce, nogi i zabijani ludzie? Potem przypomniał sobie nagrodzonych Łazariewa i Denisowa, ukaranych i niewybaczonych. Przyłapał się na tym, że ma tak dziwne myśli, że zaczął się ich bać.
Z tego stanu wyprowadził go zapach jedzenia od Preobrażeńców i głód: musiał coś zjeść przed wyjściem. Poszedł do hotelu, który widział rano. W hotelu zastał tak wielu ludzi, oficerów podobnych do niego, którzy przybyli w cywilnych strojach, że musiał zmusić się do zjedzenia obiadu. Dołączyło do niego dwóch oficerów z tego samego oddziału. Rozmowa naturalnie zeszła na pokojową. Oficerowie i towarzysze Rostowa, podobnie jak większość armii, byli niezadowoleni z pokoju zawartego po Frydlandzie. Mówili, że gdyby wytrzymali dłużej, Napoleon by zniknął, że w swoich oddziałach nie ma krakersów ani amunicji. Mikołaj jadł w milczeniu i głównie pił. Wypił jedną lub dwie butelki wina. Praca wewnętrzna, która w nim powstała, nierozwiązana, wciąż go dręczyła. Bał się oddawać swoim myślom i nie mógł ich opuścić. Nagle, na słowa jednego z oficerów, że patrzenie na Francuzów jest obraźliwe, Rostów zaczął gwałtownie krzyczeć, co nie było w żaden sposób uzasadnione, i dlatego bardzo zaskoczył oficerów.
– A jak możesz oceniać, co byłoby lepsze! - krzyknął z twarzą nagle zarumienioną krwią. - Jak możesz oceniać działania suwerena, jakie mamy prawo rozumować?! Nie możemy zrozumieć ani celu, ani działań władcy!
„Tak, nie powiedziałem ani słowa o władcy” – usprawiedliwił się oficer, nie mogąc wytłumaczyć swojego temperamentu inaczej niż faktem, że Rostów był pijany.
Ale Rostów nie słuchał.
„Nie jesteśmy urzędnikami dyplomatycznymi, ale jesteśmy żołnierzami i niczym więcej” – kontynuował. „Każą nam umrzeć – tak umieramy”. A jeśli ukarzą, to znaczy, że jest winny; Nie nam to osądzać. Suwerennemu cesarzowi podoba się uznanie Bonapartego za cesarza i zawarcie z nim sojuszu – to znaczy, że należy to zrobić. W przeciwnym razie gdybyśmy zaczęli osądzać i rozważać wszystko, nie pozostałoby nic świętego. W ten sposób powiemy, że Boga nie ma, nie ma niczego” – krzyczał Mikołaj, uderzając w stół, bardzo niewłaściwie, zgodnie z koncepcjami rozmówców, ale bardzo konsekwentnie w toku swoich myśli.
„Nasza praca polega na wykonywaniu swoich obowiązków, hakowaniu i nie myśleniu, to wszystko” – podsumował.
„I pijcie” – powiedział jeden z oficerów, który nie chciał się kłócić.
„Tak, i pij” – podjął Nikołaj. - Hej ty! Kolejna butelka! - krzyknął.
W 1808 roku cesarz Aleksander udał się do Erfurtu na nowe spotkanie z cesarzem Napoleonem, a w wyższych sferach Petersburga dużo mówiło się o wielkości tego uroczystego spotkania.
W 1809 roku bliskość obu władców świata, jak nazywano Napoleona i Aleksandra, osiągnęła taki punkt, że gdy w tym samym roku Napoleon wypowiedział wojnę Austrii, korpus rosyjski wyjechał za granicę, aby pomóc swemu dawnemu wrogowi Bonaparte w walce z ich dawnym sojusznikiem, cesarz austriacki; do tego stopnia, że w wyższych sferach mówiono o możliwości małżeństwa Napoleona z jedną z sióstr cesarza Aleksandra. Jednak oprócz zewnętrznych względów politycznych, w tym czasie szczególnie żywo uwagę społeczeństwa rosyjskiego zwracały przemiany wewnętrzne, jakie dokonywały się wówczas we wszystkich komórkach administracji publicznej.
Życie zaś, prawdziwe życie ludzi, z ich istotnymi interesami, czyli zdrowiem, chorobą, pracą, odpoczynkiem, z ich zainteresowaniami myśli, nauki, poezji, muzyki, miłości, przyjaźni, nienawiści, namiętności, toczyło się jak zawsze, niezależnie i bez powinowactwo polityczne lub wrogość do Napoleona Bonaparte, a poza wszelkimi możliwymi transformacjami.
Książę Andriej mieszkał we wsi bez przerwy przez dwa lata. Wszystkie te przedsiębiorstwa na majątkach, które Pierre rozpoczął i nie przyniosły żadnego rezultatu, ciągle przechodząc od jednej rzeczy do drugiej, wszystkie te przedsiębiorstwa, nie pokazując ich nikomu i bez zauważalnej pracy, przeprowadził książę Andriej.
Miał w dużym stopniu tę praktyczną wytrwałość, której brakowało Pierre'owi, a która bez zakresu i wysiłku z jego strony wprawiała wszystko w ruch.
Jeden z jego majątków składający się z trzystu dusz chłopskich został przekazany wolnym rolnikom (był to jeden z pierwszych przykładów w Rosji, w innych pańszczyzna została zastąpiona przez rezygnującego). W Bogucharowie na jego konto zapisano uczoną babcię, aby pomagała matkom w porodzie, a za wynagrodzeniem ksiądz uczył czytać i pisać dzieci chłopów i służących na podwórku.
Książę Andriej połowę czasu spędził w Górach Łysych z ojcem i synem, który nadal był z nianiami; drugą połowę czasu w klasztorze Boguczarów, jak jego ojciec nazywał swoją wieś. Pomimo obojętności, jaką okazywał Pierre'owi na wszystkie zewnętrzne wydarzenia świata, pilnie je śledził, otrzymał wiele książek i ku swemu zaskoczeniu zauważył, kiedy z samego wiru życia przybyli do niego lub jego ojca z Petersburga nowi ludzie , że ci ludzie, wiedząc o wszystkim, co dzieje się w polityce zagranicznej i wewnętrznej, są daleko w tyle za nim, który stale siedzi we wsi.
Oprócz zajęć z imion, oprócz ogólnych studiów nad czytaniem szerokiej gamy książek, książę Andriej był w tym czasie zaangażowany w krytyczną analizę naszych dwóch ostatnich niefortunnych kampanii i opracowywanie projektu zmiany naszych przepisów i przepisów wojskowych.
Wiosną 1809 r. Książę Andriej udał się do posiadłości Ryazan swojego syna, którego był opiekunem.
Ogrzany wiosennym słońcem siedział w wózku, patrząc na pierwszą trawę, pierwsze liście brzozy i pierwsze chmury białych wiosennych chmur rozsypujących się po jasnoniebieskim niebie. Nie myślał o niczym, tylko rozglądał się wesoło i bez znaczenia.
Minęliśmy powóz, w którym rok temu rozmawiał z Pierrem. Minęliśmy brudną wieś, klepiska, zieleń, zjazd z zalegającym śniegiem w pobliżu mostu, podjazd przez wypłukaną glinę, pasy ścierniska i tu i ówdzie zielone krzaki i weszliśmy po obu stronach drogi w brzozowy las. W lesie było prawie gorąco, nie było słychać wiatru. Brzoza, cała usiana zielonymi lepkimi liśćmi, nie poruszyła się, a spod zeszłorocznych liści, unosząc je, wypełzła pierwsza zielona trawa i fioletowe kwiaty. Małe świerki, rozsiane tu i ówdzie wzdłuż brzozowego lasu, swoją szorstką, wieczną zielenią przypominały nieprzyjemną zimę. Konie parskały, gdy wjechały do lasu, i zaczęła się mgła.
Aldehyd octowy, będący metabolitem alkoholu, ma zdolność zwiększania uwalniania z zakończeń adrenergicznych katecholamin, które zwiększają napięcie naczyń oporowych. Katecholaminy powodują niedobór tlenu w sercu i tkankach organizmu, a także tachykardię. Aldehyd octowy ma zdolność kondensowania z niektórymi katecholaminami, mianowicie dopaminą, z późniejszym tworzeniem tetrahydroizochinolin, które gromadzą się w neuronach mózgu i działają jako fałszywe przekaźniki zastępując katecholaminy. Substancje te powodują poważne zaburzenia w funkcjonowaniu ośrodkowego układu nerwowego, niektóre z nich mają wyraźne właściwości halucynogenne.
Aldehyd octowy hamuje między innymi eliminację produktów przemiany materii etanolu, co prowadzi do upośledzenia funkcji wątroby. W ten sposób kwas octowy gromadzi się w biologicznym środowisku ludzkiego ciała. Aldehyd octowy spowalnia reakcje redoks, hamując w ten sposób utlenianie innych substancji. W ten sposób glicerol, kwas pirogronowy i kwasy tłuszczowe gromadzą się w osoczu krwi, co przyczynia się do rozwoju kwasicy metabolicznej.
Często zespołowi odstawienia alkoholu u pacjenta towarzyszy podwyższony poziom wapnia we krwi i spadek poziomu glukozy, co przyczynia się do depresji świadomości i rozwoju zaburzeń drgawkowych.
Alkohol wraz z produktami jego rozkładu ma działanie toksyczne na naczynia włosowate, zwiększając agregację płytek krwi, co przyczynia się do rozwoju zakrzepicy, szczególnie jeśli pacjent cierpi na miażdżycę. Zakrzepica z kolei może powodować zawał mięśnia sercowego i udar niedokrwienny mózgu. W tym przypadku aldehyd octowy ma tendencję do bezpośredniego hamowania funkcji skurczowej mięśnia sercowego.
Gdy osocze krwi ulegnie zakwaszeniu, czyli gdy jego poziom pH spadnie, hemoglobina znajdująca się w czerwonych krwinkach zaczyna gorzej wiązać tlen. To z kolei zmniejsza ilość tlenu dostarczanego do komórek i rozwój głodu tlenowego, przejście układów komórkowych na beztlenową (beztlenową) metodę utleniania glukozy, która jest mniej skuteczna i powoduje dalszą akumulację niedotlenionych związków i w związku z tym wzrasta kwasica.
Autorstwo i redakcja tekstu:
Kierownik Katedry Psychiatrii i Narkologii w Alkoklinik MC, psychiatra-narkolog Popov A.G. , psychiatra-narkolog Serova L.A.
Nasi lekarze
Zdjęcie Centrum Medycznego Aloklinik




Właściwości chemiczne aldehydu octowego
1. Uwodornienie. Dodatek wodoru następuje w obecności katalizatorów uwodornienia (Ni, Co, Cu, Pt, Pd itp.). Jednocześnie zamienia się w alkohol etylowy:
CH3CHO + H2C2H5OH
Kiedy aldehydy lub ketony są redukowane wodorem w momencie rozdzielania (za pomocą metali alkalicznych lub amalgamatu magnezu), wraz z odpowiednimi alkoholami, w małych ilościach powstają również glikole:
2 CH3CHO + 2HCH3 - CH - CH - CH3
2. Reakcje addycji nukleofilowej
2.1 Dodatek haloalkilów magnezu
CH3 - CH2 - MgBr + CH3CHO BrMg - O - CH - C2H5
2.2 Dodatek kwasu cyjanowodorowego prowadzi do powstania nitrylu kwasu b-hydroksypropionowego:
CH3CHO + HCN CH3 - CH - CN
2.3 Dodatek wodorosiarczynu sodu daje substancję krystaliczną - pochodną aldehydu octowego:
CH3CHO + HSO3NaCH3 - C - SO3Na
2.4 Interakcja z amoniakiem prowadzi do powstania acetaldiminy:
CH3CHO + NH3CH3-CH=NH
2.5 W przypadku hydroksyloaminy aldehyd octowy uwalnia wodę, tworząc acetaldoksym:
CH3CHO + H2NOH H2O + CH3-CH =NOH
2.6 Szczególnie interesujące są reakcje aldehydu octowego z hydrazyną i jej substytutami:
CH3CHO + H2N - NH2 + OCHCH3 CH3-CH=N-N=CH-CH3 + 2H2O
Aldazyna
2.7 Aldehyd octowy może dodać wodę do grupy karbonylowej, tworząc hydrat - glikol geminalny. W temperaturze 20°C 58% aldehydu octowego w roztworze wodnym występuje w postaci hydratu -C- + HOH HO-C-OH
2.8 Kiedy aldehyd octowy reaguje z alkoholami, powstają półacetale:
CH3CHO + HOR CH3-CH
W obecności śladów kwasu mineralnego tworzą się acetale
CH3 - CH + ROH CH3 - CH + H2O
2.9 Aldehyd octowy, oddziałując z PC15, wymienia atom tlenu na dwa atomy chloru, co wykorzystuje się do otrzymania geminalnego dichloroetanu:
CH3CHO + PC15 CH3CHCl2 + POCl3
3. Reakcje utleniania
Aldehyd octowy utlenia się pod wpływem tlenu atmosferycznego do kwasu octowego. Produktem pośrednim jest kwas nadoctowy:
CH3CHO + O2 CH3CO-OOH
CH3CO-OOH + CH3CHOCH3-C-O-O-CH-CH3
Roztwór amoniaku wodorotlenku srebra po lekkim podgrzaniu z aldehydami utlenia je do kwasów, tworząc wolne metaliczne srebro. Jeżeli probówkę, w której zachodzi reakcja, odtłuszczono wcześniej od wewnątrz, to srebro leży cienką warstwą na jej wewnętrznej powierzchni – powstaje srebrne lustro:
CH3CHO + 2OHCH3COONH4 + 3NH3 + H2O + 2Ag
4. Reakcje polimeryzacji
Pod wpływem kwasów aldehyd octowy ulega trimeryzacji i powstaje paraldehyd:
3CH3CHO CH3 - CH CH - CH3
5. Halogenowanie
Aldehyd octowy reaguje z bromem i jodem z tą samą szybkością, niezależnie od stężenia halogenu. Reakcje przyspieszają zarówno kwasy, jak i zasady.
CH3CHO + Br2 CH2BrCHO + HBr
Po podgrzaniu z chlorkiem tris(trifenylofosfino)rodu ulegają dekarbonylacji, tworząc metan:
CH3CHO + [(C6H5)P]3RhClCH4 + [(C6H5)3P]3RhCOCl
7. Kondensacja
7.1 Kondensacja aldolowa
W środowisku słabo zasadowym (w obecności octanu, węglanu lub siarczynu potasu) aldehyd octowy ulega kondensacji aldolowej według A.P. Borodina, tworząc alkohol aldehydowy (3-hydroksybutanal), w skrócie aldol. Aldol powstaje w wyniku dodania aldehydu do grupy karbonylowej innej cząsteczki aldehydu z rozszczepieniem wiązania C-H w pozycji b do karbonylu:
CH3CHO + CH3CHO CH3-CHOH-CH2-CHO
Po podgrzaniu aldol (bez substancji usuwających wodę) oddziela wodę, tworząc nienasycony aldehyd krotonowy (2-butenal):
CH3-CHOH-CH2-CHO CH3-CH=CH-CHO + H2O
Dlatego przejście od nasyconego aldehydu do nienasyconego aldehydu przez aldol nazywa się kondensacją krotonową. Do odwodnienia dochodzi na skutek bardzo dużej ruchliwości atomów wodoru w pozycji b względem grupy karbonylowej (superkoniugacja) i jak w wielu innych przypadkach następuje zerwanie wiązania p w stosunku do grupy karbonylowej.
7.2 Kondensacja estrów
Prowadzi do powstania eteru octowego etylowego w wyniku działania alkoholanów glinu na aldehyd octowy w środowisku niewodnym (według V. E. Tishchenko):
2CH3CHOCH3-CH2-O-C-CH3
7.3 Kondensacja Claisena-Schmidta.
Ta cenna reakcja syntezy polega na katalizowanej zasadą kondensacji aromatycznego lub innego aldehydu pozbawionego atomów wodoru z aldehydem lub ketonem alifatycznym. Na przykład aldehyd cynamonowy można wytworzyć przez wytrząsanie mieszaniny benzaldehydu i aldehydu octowego z około 10 częściami rozcieńczonej zasady i pozostawienie mieszaniny na 8-10 dni. W tych warunkach odwracalne reakcje prowadzą do dwóch aldoli, ale jeden z nich, w którym 3-hydroksyl jest aktywowany przez grupę fenylową, nieodwracalnie traci wodę, zamieniając się w aldehyd cynamonowy:
C6H5--CHO + CH3CHO C6H5-CHOH-CH2-CHO C6H5-CH=CH-CHO
Właściwości chemiczne tlenu
Tlen jest wysoce reaktywny, szczególnie po podgrzaniu i w obecności katalizatora. Oddziałuje bezpośrednio z większością prostych substancji, tworząc tlenki. Jedynie w odniesieniu do fluoru tlen wykazuje właściwości redukujące.
Podobnie jak fluor, tlen tworzy związki z prawie wszystkimi pierwiastkami (z wyjątkiem helu, neonu i argonu). Nie reaguje bezpośrednio z halogenami, kryptonem, ksenonem, metalami złotymi i platynowymi, a ich związki otrzymuje się pośrednio. Tlen łączy się bezpośrednio ze wszystkimi innymi pierwiastkami. Procesom tym zwykle towarzyszy wydzielanie ciepła.
Ponieważ tlen ustępuje pod względem elektroujemności jedynie fluorowi, przyjmuje się, że stopień utlenienia tlenu w zdecydowanej większości związków wynosi -2. Ponadto tlenowi przypisuje się stopnie utlenienia +2 i +4, a także +1(F2O2) i -1(H2O2).
Metale alkaliczne i metale ziem alkalicznych są najaktywniej utleniane i w zależności od warunków powstają tlenki i nadtlenki:
O2 + 2Ca = 2CaO
O2 + Ba = BaO2
Niektóre metale w normalnych warunkach utleniają się jedynie z powierzchni (na przykład chrom lub aluminium). Powstała warstwa tlenkowa zapobiega dalszej interakcji. Wzrost temperatury i zmniejszenie wielkości cząstek metalu zawsze przyspiesza utlenianie. Zatem żelazo w normalnych warunkach utlenia się powoli. W bardzo wysokiej temperaturze (400°C) żelazny drut spala się w tlenie:
3Fe + 2O2 = Fe3O4
Drobny proszek żelaza (żelazo piroforyczne) samozapala się w powietrzu nawet w zwykłych temperaturach.
Z wodorem tlen tworzy wodę:
Po podgrzaniu siarka, węgiel i fosfor spalają się w tlenie. Oddziaływanie tlenu z azotem rozpoczyna się dopiero w temperaturze 1200°C lub w wyniku wyładowania elektrycznego:
Związki wodoru spalają się w tlenie, na przykład:
2H2S + 3О2 = 2SO2 + 2Н2О (z nadmiarem O2)
2H2S + O2 = 2S + 2H2O (przy braku O2)
 Luminescencja: rodzaje, metody, zastosowania
Luminescencja: rodzaje, metody, zastosowania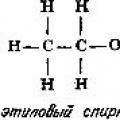 Podstawowe zasady chemii organicznej Klasyfikacja reakcji organicznych
Podstawowe zasady chemii organicznej Klasyfikacja reakcji organicznych Różnica między nauczycielem a nauczycielem Jaka jest różnica między nauczycielem a nauczycielem
Różnica między nauczycielem a nauczycielem Jaka jest różnica między nauczycielem a nauczycielem