Hvordan bestemme typer kjemiske bindinger. Kovalent kjemisk binding
Forholdet i en setning- dette er en måte å gi en setning meningsfullhet, tankefullhet, samt logisk, leksikalsk og syntaktisk fullstendighet. Det er to typer sammenhenger i en setning - koordinerende og underordnet.
Koordinerende forbindelse i en setning er en kombinasjon av elementer i en setning som er uavhengige av hverandre: homogene medlemmer i en enkel setning eller enkle setninger i en sammensatt setning.
Underordnet forbindelse i en setning er en kombinasjon av elementer som er avhengige av hverandre: ord i en frase, setning eller enkle setninger som en del av en kompleks setning.
Hvordan bestemme typen forbindelse i en setning?
Først av alt er det nødvendig å forkaste det grammatiske grunnlaget, siden emnet alltid er knyttet til predikatet, og det er også verdt å eliminere innledende ord.
Eksempel. Jeg ville ut, men døren var låst.
En sammensatt setning med to uavhengige deler, sammensatt. Basert på dette bruker denne setningen koordinerende kommunikasjon.
Jeg ønsket å gå ut fordi luften i rommet var veldig foreldet.
En kompleks setning der det er underordnet forbindelse- den ene setningen angir årsaken til det som er sagt i den andre. Setningen er kompleks.
Typer underordnede forbindelser.
Finnes tre typer underordnede forbindelser:
Koordinasjon- dette er en type sammenheng når de avhengige og hovedordene (et substantiv eller en annen orddel i rollen som et substantiv) sammenlignes med hverandre i kjønn, tall og kasus. De enkleste eksemplene på enighet er i setninger: ekkelt regn, blide meg, usynlig noen, en tilfeldig forbipasserende, et rungende «zy».
Som avhengige ord når det er avtalt, kan alle foranderlige deler av talen vises: adjektiv, pronomen (besittende, attributive, demonstrative, negative, ubestemte) og ordenstall.
Ingen penger, til den blide historiefortelleren, søsteren din, til den første personen du møter.
Kontroll- type kommunikasjon der hovedord krever en spesiell kasusform av det avhengige ordet. Saksskjema samtidig bestemmes det av visse morfologiske normer i det russiske språket. Hovedtegnet på tilstedeværelsen av kontroll i en frase eller setning er bruken av en preposisjon, selv om det også er en form for kontroll uten en preposisjon. Hvis det er kontroll, vil det avhengige ordet alltid svare på spørsmål om indirekte tilfeller.
Se på månen, beundre månen, signer for kvittering, signer dokumenter, glem problemer, glem formelen.
Samlokalisering- er en kombinasjon av to eller flere betydningsfulle (uavhengige) ord knyttet til hverandre på grunnlag av et underordnet forhold i betydning og grammatisk. Setninger navngir objekter, handlinger, tegn osv. Men mer presist, mer spesifikt enn ord: les - les høyt, penn - kulepenn, raskt - veldig raskt.
Underordnet forbindelse– koblingen av ord i SS, som forbinder ulik komponenter, hvorav den ene er den viktigste, og den andre er avhengig; Fra hovedordet til det avhengige ordet kan du stille et spørsmål.
Typer underordnede forbindelser:
Komponentene i en setning er koblet til hverandre av et underordnet forhold, som er av tre typer: koordinering, kontroll, tilknytning:
1) godkjenning– et underordnet forhold der det avhengige ordet sammenlignes med hovedordet i sine morfologiske egenskaper, dvs. der formene for kjønn, tall, kasus for det avhengige ordet er forhåndsbestemt av de tilsvarende formene til stamordet.
Koordinasjonen varierer fullstendig Og ufullstendig:
a) med full enighet, aksepterer det underordnede ordet alle former for det underordnede ordet, så langt de grammatiske kategoriene til begge ordene tillater, for eksempel: på en mørk natt (enighet i kjønn, kasus og tall); siste minutter (avtale i sak og antall); karakterer settes (koordinering i antall)
b) ved ufullstendig avtale ikke alle koordineringsmuligheter er uttømt, for eksempel: Jeg ser ham klar til å forlate (enighet av adjektivet klar med pronomenet i kjønn og tall, men ikke i tilfelle; jf. den foreldede konstruksjonen Jeg ser ham klar til å gå - med full enighet)
Det avhengige ordet når det er avtalt kan uttrykkes:
1) et adjektiv i hvilken som helst form (bortsett fra det enkle komparativet og den sammensatte superlativgraden av sammenligning bygget på dets grunnlag), som stemmer overens med hovedordet i kjønn, tall, kasus
2) pronominal adjektiv (unntatt hans, henne, dem)
3) ordinært tall og tall en
4) nattverd; samme avtale: les bok
5) et substantiv - en koordinert applikasjon som stemmer overens med hovedordet i kasus og tall (hvis det koordinerte substantivet endres i tall)
6) kardinalnummer i indirekte tilfeller; enighet i tilfelle, og for ordet begge i kjønn: begge jenter, begge gutter
2) ledelse– et underordnet forhold der et substantiv eller pronomen er avhengig av hovedordet i form av et bestemt kasus med eller uten preposisjon, dvs. der det avhengige ordet har form av en eller annen kasus avhengig av hovedordets grammatiske mulighet og betydningen det uttrykker. Den avhengige ordformen forblir uendret når den grammatiske formen til hovedordet endres, i motsetning til enighet, hvor begge ordformene endres samtidig.
Ledelsen etablerer relasjoner gjenstand, der grammatisk dominerende ord samtaler handling eller stat, og den avhengige er gjenstand for handlingen eller bærer av staten(send et brev, les en bok), og subjektiv, der det grammatisk dominerende ordet navngir en handling eller tilstand, og det avhengige ordet navngir subjektet for handlingen eller bæreren av staten; og også omfattende (påfylling), som i de fleste tilfeller fungerer som syntaktisk udelelige fraser, siden hovedkomponenten, på grunn av sin semantiske utilstrekkelighet eller usikkerhet, ikke kan brukes i en strengt definert form: ti dager, en flokk ender, et glass vann, bli en helt, begynn å forberede, fire hjørner, kall deg en gjest , betraktes som en enkelhet.
Hovedordet i ledelse er uttrykt:
1) verb i hvilken som helst form: lese en bok
2) substantiv: lese en bok
3) adjektiv: fornøyd med suksess
4) kardinalnummer i I. (V.) tilfelle: tre stoler, fem stoler
Avhengig ord når du kontrollerer - et substantiv, pronominal substantiv eller hvilken som helst del av tale i funksjonen til et substantiv: se på en venn
3) tilknytning- en type underordnet forbindelse der hovedordet er forbundet med et uforanderlig avhengig ord eller en form av et variabelavhengig ord som ikke har evnen til å stemme overens (verbinfinitiv, partisipiell form, enkel komparativ grad av et adjektiv eller adverb), dvs. der det avhengige ordet er uforanderlig, isolert fra kasussystemet på grunn av dets tilhørighet til en viss del av talen, uttrykkes avhengigheten av hovedordet semantisk. Partisipp, adverb og infinitiver kan være tilstøtende.
Hovedordet ved tilstøtende:
1) verb: løp fort
2) adjektiv: veldig fort,
3) adverb: veldig raskt
4) substantiv: bløtkokt egg, klokkebunnbukser, eldre barn
Det avhengige ordet når tilstøtende uttrykkes:
1) et adverb, inkludert i form av grader av sammenligning: gå, skrive raskere
2) gerund: snakket stamming
3) infinitiv: bedt om å skrive
4) komparativ grad av adjektivet: eldre barn
5) uforanderlig (analytisk) adjektiv: khaki
6) pronominal adjektiv hans, hennes, deres: huset hans
7) substantiv - inkonsekvent bruk: i avisen "Izvestia"
3.3.1 Kovalent binding er en to-senter, to-elektronbinding dannet på grunn av overlapping av elektronskyer som bærer uparrede elektroner med antiparallelle spinn. Som regel dannes det mellom atomer av ett kjemisk element.
Det er kvantitativt preget av valens. Valens av elementet - dette er dens evne til å danne et visst antall kjemiske bindinger på grunn av frie elektroner lokalisert i atomvalensbåndet.
En kovalent binding dannes bare av et par elektroner plassert mellom atomer. Det kalles et delt par. De gjenværende elektronparene kalles ensomme par. De fyller skjellene og er ikke med på å binde. Forbindelsen mellom atomer kan utføres ikke bare av ett, men også av to og til og med tre delte par. Slike forbindelser kalles dobbelt osv sverm - flere tilkoblinger.
3.3.1.1 Kovalent upolar binding. En binding oppnådd gjennom dannelsen av elektronpar som tilhører likt begge atomene kalles kovalent ikke-polar. Det forekommer mellom atomer med praktisk talt lik elektronegativitet (0,4 > ΔEO > 0) og derfor en jevn fordeling av elektrontetthet mellom atomkjernene i homonukleære molekyler. For eksempel H 2, O 2, N 2, Cl 2 osv. Dipolmomentet til slike bindinger er null. CH-bindingen i mettede hydrokarboner (for eksempel i CH 4) regnes som praktisk talt upolar, fordi ΔEO = 2,5 (C) - 2,1 (H) = 0,4.
3.3.1.2 Kovalent polar binding. Hvis et molekyl dannes av to forskjellige atomer, så forskyves overlappingssonen til elektronskyer (orbitaler) mot ett av atomene, og en slik binding kalles polar . Med en slik binding er sannsynligheten for å finne elektroner nær kjernen til et av atomene høyere. For eksempel HCl, H 2 S, PH 3.
Polar (usymmetrisk) kovalent binding - binding mellom atomer med ulik elektronegativitet (2 > ΔEO > 0,4) og asymmetrisk fordeling av det vanlige elektronparet. Vanligvis dannes det mellom to ikke-metaller.
Elektrontettheten til en slik binding forskyves mot et mer elektronegativt atom, noe som fører til at det vises en delvis negativ ladning (delta minus) på den, og en delvis positiv ladning (delta pluss) på den mindre elektronegativt atom.
C .
Retningen for elektronforskyvning er også indikert med en pil:
CCl, CO, CN, OH, CMg.
Jo større forskjellen er i elektronegativitet til de bundne atomene, desto høyere er polariteten til bindingen og desto større er dipolmomentet. Ytterligere tiltrekningskrefter virker mellom partielle ladninger med motsatt fortegn. Derfor, jo mer polar bindingen er, jo sterkere er den.
Unntatt polariserbarhet kovalent binding har eiendommen metning – et atoms evne til å danne like mange kovalente bindinger som det har energisk tilgjengelige atomorbitaler. Den tredje egenskapen til en kovalent binding er dens retning.
3.3.2 Ionebinding. Drivkraften bak dannelsen er det samme ønsket til atomer for oktettskallet. Men i noen tilfeller kan et slikt "oktett"-skall bare oppstå når elektroner overføres fra ett atom til et annet. Derfor dannes det som regel en ionisk binding mellom et metall og et ikke-metall.
Tenk som et eksempel på reaksjonen mellom natrium (3s 1) og fluor (2s 2 3s 5) atomer. Elektronegativitetsforskjell i NaF-forbindelse
EO = 4,0 - 0,93 = 3,07
Natrium, etter å ha gitt sitt 3s 1 elektron til fluor, blir et Na + ion og forblir med et fylt 2s 2 2p 6 skall, som tilsvarer den elektroniske konfigurasjonen til neonatomet. Fluor får nøyaktig den samme elektroniske konfigurasjonen ved å akseptere ett elektron donert av natrium. Som et resultat oppstår elektrostatiske tiltrekningskrefter mellom motsatt ladede ioner.
Ionebinding – et ekstremt tilfelle av polar kovalent binding, basert på elektrostatisk tiltrekning av ioner. En slik binding oppstår når det er stor forskjell i elektronegativiteten til de bundne atomene (EO > 2), når et mindre elektronegativt atom nesten fullstendig gir fra seg valenselektronene og blir til et kation, og et annet, mer elektronegativt atom, fester seg disse elektronene og blir et anion. Samspillet mellom ioner av motsatt fortegn er ikke avhengig av retningen, og Coulomb-krefter har ikke egenskapen til metning. På grunn av dette ionisk binding har ingen romlig fokus Og metning , siden hvert ion er assosiert med et visst antall motioner (ionekoordinasjonsnummer). Derfor har ikke ionbundne forbindelser molekylstruktur og er faste stoffer som danner ioniske krystallgitter, med høye smelte- og kokepunkter, de er svært polare, ofte saltaktige og elektrisk ledende i vandige løsninger. For eksempel MgS, NaCl, A 2 O 3. Det er praktisk talt ingen forbindelser med rent ioniske bindinger, siden en viss mengde kovalens alltid forblir på grunn av det faktum at en fullstendig overføring av ett elektron til et annet atom ikke observeres; i de mest "ioniske" stoffene overstiger ikke andelen bindingsionisitet 90%. For eksempel, i NaF er bindingspolarisasjonen omtrent 80%.
I organiske forbindelser er ioniske bindinger ganske sjeldne, fordi Et karbonatom har en tendens verken til å miste eller få elektroner for å danne ioner.
Valence elementer i forbindelser med ioniske bindinger er svært ofte karakterisert oksidasjonstilstand , som igjen tilsvarer ladningsverdien til grunnstoffionet i en gitt forbindelse.
Oksidasjonstilstand - dette er en betinget ladning som et atom får som et resultat av omfordeling av elektrontetthet. Kvantitativt er det preget av antall elektroner som er forskjøvet fra et mindre elektronegativt element til et mer elektronegativt. Et positivt ladet ion dannes fra grunnstoffet som ga fra seg elektronene sine, og et negativt ion dannes fra grunnstoffet som tok imot disse elektronene.
Elementet som ligger i høyeste oksidasjonstilstand (maksimalt positivt), har allerede gitt opp alle valenselektronene som ligger i AVZ. Og siden antallet deres bestemmes av nummeret til gruppen der elementet er plassert, da høyeste oksidasjonstilstand for de fleste elementer og vil være like gruppenummer . Angående laveste oksidasjonstilstand (maksimalt negativ), så vises det under dannelsen av et åtte-elektronskall, det vil si i tilfelle når AVZ er helt fylt. Til ikke-metaller det beregnes med formelen Gruppenummer – 8 . Til metaller lik null , siden de ikke kan akseptere elektroner.
For eksempel har AVZ av svovel formen: 3s 2 3p 4. Hvis et atom gir fra seg alle elektronene (seks), vil det få den høyeste oksidasjonstilstanden +6 , lik gruppenummeret VI , hvis det tar de to nødvendige for å fullføre det stabile skallet, vil det oppnå den laveste oksidasjonstilstanden –2 , lik Gruppenummer – 8 = 6 – 8= –2.
3.3.3 Metallbinding. De fleste metaller har en rekke egenskaper som er generelle i naturen og skiller seg fra egenskapene til andre stoffer. Slike egenskaper er relativt høye smeltetemperaturer, evnen til å reflektere lys og høy termisk og elektrisk ledningsevne. Disse funksjonene forklares av eksistensen av en spesiell type interaksjon i metaller – metallforbindelse.
I samsvar med deres posisjon i det periodiske systemet har metallatomer et lite antall valenselektroner, som er ganske svakt bundet til kjernene og lett kan løsnes fra dem. Som et resultat vises positivt ladede ioner i metallets krystallgitter, lokalisert i visse posisjoner av krystallgitteret, og et stort antall delokaliserte (frie) elektroner, beveger seg relativt fritt i feltet med positive sentre og kommuniserer mellom alt metall. atomer på grunn av elektrostatisk tiltrekning.
Dette er en viktig forskjell mellom metalliske bindinger og kovalente bindinger, som har en streng orientering i rommet. Bindingskrefter i metaller er ikke lokaliserte eller rettet, og frie elektroner som danner en "elektrongass" forårsaker høy termisk og elektrisk ledningsevne. Derfor er det i dette tilfellet umulig å snakke om retningen til bindingene, siden valenselektronene er fordelt nesten jevnt over hele krystallen. Det er dette som forklarer for eksempel plastisiteten til metaller, dvs. muligheten for forskyvning av ioner og atomer i alle retninger
3.3.4 Donor-akseptor-binding. I tillegg til mekanismen for kovalent bindingsdannelse, ifølge hvilken et delt elektronpar oppstår fra samspillet mellom to elektroner, er det også en spesiell giver-akseptor mekanisme . Det ligger i det faktum at en kovalent binding dannes som et resultat av overgangen til et allerede eksisterende (ensomt) elektronpar giver (elektronleverandør) for felles bruk av giveren og akseptor (leverandør av fri atomorbital).
Når den først er dannet, er den ikke forskjellig fra kovalent. Donor-akseptormekanismen er godt illustrert av skjemaet for dannelse av et ammoniumion (figur 9) (stjerner indikerer elektronene til det ytre nivået av nitrogenatomet):

Figur 9 - Skjema for dannelse av ammoniumion
Den elektroniske formelen til ABZ til nitrogenatomet er 2s 2 2p 3, det vil si at den har tre uparrede elektroner som går inn i en kovalent binding med tre hydrogenatomer (1s 1), som hver har ett valenselektron. I dette tilfellet dannes et ammoniakkmolekyl NH 3, der det ensomme elektronparet nitrogen beholdes. Hvis et hydrogenproton (1s 0), som ikke har noen elektroner, nærmer seg dette molekylet, vil nitrogen overføre elektronparet sitt (donor) til denne hydrogenatomorbitalen (akseptoren), noe som resulterer i dannelsen av et ammoniumion. I den er hvert hydrogenatom koblet til et nitrogenatom med et felles elektronpar, hvorav ett implementeres via en donor-akseptormekanisme. Det er viktig å merke seg at H-N-bindinger dannet av forskjellige mekanismer ikke har noen forskjeller i egenskaper. Dette fenomenet skyldes det faktum at i øyeblikket av bindingsdannelse endrer orbitalene til 2s og 2p elektronene til nitrogenatomet form. Som et resultat vises fire orbitaler med nøyaktig samme form.
Donorer er vanligvis atomer med et stort antall elektroner, men med et lite antall uparrede elektroner. For elementer fra periode II, i tillegg til nitrogenatomet, er en slik mulighet tilgjengelig for oksygen (to ensomme par) og fluor (tre ensomme par). For eksempel er hydrogenionet H + i vandige løsninger aldri i fri tilstand, siden hydroniumionet H 3 O + alltid dannes fra vannmolekylene H 2 O og H + ionet. Hydroniumionet er tilstede i alle vandige løsninger , selv om det for enkelhets skyld er bevart symbolet H+.
3.3.5 Hydrogenbinding. Et hydrogenatom assosiert med et sterkt elektronegativt grunnstoff (nitrogen, oksygen, fluor, etc.), som "trekker" et vanlig elektronpar på seg selv, opplever mangel på elektroner og får en effektiv positiv ladning. Derfor er den i stand til å samhandle med det ensomme elektronparet til et annet elektronegativt atom (som får en effektiv negativ ladning) av det samme (intramolekylær binding) eller et annet molekyl (intermolekylær binding). Som et resultat oppstår det hydrogenbinding , som er grafisk indikert med prikker:

Denne bindingen er mye svakere enn andre kjemiske bindinger (energien til dannelsen er 10 – 40 kJ/mol) og har hovedsakelig en delvis elektrostatisk, delvis donorakseptorkarakter.
Hydrogenbindingen spiller en ekstremt viktig rolle i biologiske makromolekyler, slike uorganiske forbindelser som H 2 O, H 2 F 2, NH 3. For eksempel er O-H-bindinger i H2O merkbart polare i naturen, med et overskudd av negativ ladning – på oksygenatomet. Hydrogenatomet, tvert imot, får en liten positiv ladning + og kan samhandle med de ensomme elektronparene til oksygenatomet til et nabovannmolekyl.
Interaksjonen mellom vannmolekyler viser seg å være ganske sterk, slik at selv i vanndamp er det dimerer og trimerer av sammensetningen (H 2 O) 2, (H 2 O) 3, etc. I løsninger, lange kjeder av assosiasjoner av denne typen kan vises:
fordi oksygenatomet har to ensomme elektronpar.
Tilstedeværelsen av hydrogenbindinger forklarer de høye koketemperaturene til vann, alkoholer og karboksylsyrer. På grunn av hydrogenbindinger er vann preget av så høye smelte- og koketemperaturer sammenlignet med H 2 E (E = S, Se, Te). Hvis det ikke fantes hydrogenbindinger, ville vann smelte ved –100 °C og koke ved –80 °C. Typiske tilfeller av assosiasjon er observert for alkoholer og organiske syrer.
Hydrogenbindinger kan oppstå både mellom ulike molekyler og innenfor et molekyl hvis dette molekylet inneholder grupper med donor- og akseptorevner. For eksempel er det intramolekylære hydrogenbindinger som spiller hovedrollen i dannelsen av peptidkjeder, som bestemmer strukturen til proteiner. H-bindinger påvirker de fysiske og kjemiske egenskapene til et stoff.
Atomer av andre grunnstoffer danner ikke hydrogenbindinger , siden kreftene til elektrostatisk tiltrekning av motsatte ender av dipoler av polare bindinger (O-H, N-H, etc.) er ganske svake og virker bare på korte avstander. Hydrogen, som har den minste atomradiusen, gjør at slike dipoler kan komme så nærme at tiltrekningskreftene blir merkbare. Ingen andre grunnstoffer med stor atomradius er i stand til å danne slike bindinger.
3.3.6 Intermolekylære interaksjonskrefter (van der Waals-krefter). I 1873 antydet den nederlandske forskeren I. Van der Waals at det er krefter som forårsaker tiltrekning mellom molekyler. Disse styrkene ble senere kalt van der Waals-styrker – den mest universelle typen intermolekylære bindinger. Energien til van der Waals-bindingen er mindre enn hydrogenbindingen og utgjør 2–20 kJ/∙mol.
Avhengig av forekomstmetoden er krefter delt inn i:
1) orienterende (dipol-dipol eller ione-dipol) - oppstår mellom polare molekyler eller mellom ioner og polare molekyler. Når polare molekyler nærmer seg hverandre, orienterer de seg slik at den positive siden av den ene dipolen er orientert mot den negative siden av den andre dipolen (Figur 10).
|
Figur 10 - Orienteringsinteraksjon |
||||
2) induksjon (dipol - indusert dipol eller ion - indusert dipol) - oppstår mellom polare molekyler eller ioner og ikke-polare molekyler, men i stand til polarisering. Dipoler kan påvirke ikke-polare molekyler, og gjøre dem om til indikerte (induserte) dipoler. (Figur 11).
|
Figur 11 - Induktiv interaksjon |
||||
3) dispersiv (indusert dipol - indusert dipol) - oppstår mellom ikke-polare molekyler som er i stand til polarisering. Elektriske tetthetsfluktuasjoner forekommer i ethvert edelgassmolekyl eller -atom, noe som resulterer i øyeblikkelige dipoler, som igjen induserer øyeblikkelige dipoler i nabomolekyler. Bevegelsen av øyeblikkelige dipoler blir konsistent, deres utseende og forfall skjer synkront. Som et resultat av samspillet mellom øyeblikkelige dipoler, avtar systemets energi (Figur 12).
|
Figur 12 - Dispersjonsinteraksjon |
|||||||
Sååå N-A-D-O, Hvordan bestemme typen kjemikalie. forbindelser? Helst på enkelt språk...) og fikk det beste svaret
Svar fra Petros[guru]
To identiske ikke-metallsmier. ikke-polar (H-H, Cl-Cl).
To forskjellige - Cov.polar (H-Cl,C=O); metall og ikke-metall - ionisk (K-Cl).
I metaller (i et stykke av meg) - metallisk.
Svar fra Amazan Kurbanov[nybegynner]
kjemi 8. klasse
Svar fra Inga Filippova[aktiv]
En kovalent binding er en kjemisk binding som oppstår mellom ikke-metallatomer. En kovalent binding kan være polar - hvis den er dannet mellom atomer av ikke-metaller av samme type, eller ikke-polar - hvis den dannes mellom atomer av ikke-metaller av forskjellige typer.
Hvis stoffet er komplekst, og alle atomene som er inkludert i det er ikke-metaller, vil dette være en kovalent ikke-polar binding.
Hvis alle atomene i et stoff er metaller, uansett om stoffet er enkelt eller komplekst, vil bindingen være METALL.
Hvis stoffet er komplekst og inneholder både metallatomer og ikke-metallatomer, så oppstår en IONISK binding - en binding mellom atomer av forskjellige typer.
Det var alt for meg.
Svar fra Evgeniy Terentyev[herre]
En kovalent binding (fra latin co - "sammen" og vales - "ha styrke") er en kjemisk binding dannet av overlapping (deling) av et par valenselektronskyer. Elektronskyene (elektronene) som gir kommunikasjon kalles et felles elektronpar.
Begrepet kovalent binding ble først laget av nobelprisvinner Irving Langmuir i 1919. Begrepet refererte til en kjemisk binding som involverer deling av elektroner, i motsetning til en metallisk binding, der elektronene var frie, eller en ionisk binding, der ett av atomene ga fra seg et elektron og ble et kation og det andre atomet aksepterte et elektron og ble et anion.
Senere (1927) ga F. London og W. Heitler, ved å bruke eksemplet med et hydrogenmolekyl, den første beskrivelsen av en kovalent binding fra kvantemekanikkens synspunkt.
Tar man hensyn til den statistiske tolkningen av M. Born-bølgefunksjonen, er sannsynlighetstettheten for å finne bindingselektroner konsentrert i rommet mellom molekylets kjerner (fig. 1). Teorien om elektronparrepulsion vurderer de geometriske dimensjonene til disse parene. For elementer i hver periode er det således en viss gjennomsnittlig radius for et elektronpar (A):
0,6 for elementer opp til neon; 0,75 for elementer opp til argon; 0,75 for elementer opp til krypton og 0,8 for elementer opp til xenon.
De karakteristiske egenskapene til en kovalent binding - retningsbestemt, metning, polaritet, polariserbarhet - bestemmer de kjemiske og fysiske egenskapene til forbindelser.
Retningen til forbindelsen bestemmes av stoffets molekylære struktur og den geometriske formen til molekylet. Vinklene mellom to bindinger kalles bindingsvinkler.
Mettbarhet er atomers evne til å danne et begrenset antall kovalente bindinger. Antall bindinger dannet av et atom er begrenset av antallet ytre atomorbitaler.
Polariteten til bindingen skyldes ujevn fordeling av elektrontetthet på grunn av forskjeller i elektronegativiteten til atomene. På dette grunnlaget deles kovalente bindinger inn i ikke-polare og polare (ikke-polare - et diatomisk molekyl består av identiske atomer (H2, Cl2, N2) og elektronskyene til hvert atom er fordelt symmetrisk i forhold til disse atomene; polar - et diatomisk molekyl består av atomer av forskjellige kjemiske elementer, og totalt forskyver elektronskyen seg mot ett av atomene, og danner derved en asymmetri i fordelingen av elektrisk ladning i molekylet, og genererer et dipolmoment i molekylet).
Svar fra Dinara Zaripova[guru]
Det er 4 typer kjemikalier. tilkoblinger (kanskje flere, men la oss se på de vanligste)
1) kovalent - binding mellom IKKE-METALLER
a) ikke-polar - mellom atomer av samme kjemikalie. element (O2)
b) polar - mellom atomer av forskjellige kjemikalier. elementer (HCl)
2) ionisk - mellom metaller og ikke-metaller
3) metall - mellom METALLER
4) hydrogen (organisk kjemisk) - inntar en spesiell plass blant alle typer kjemiske bindinger. Det leveres av et hydrogenatom som ligger mellom to elektronegative ioner (for eksempel oksygenatomer)
Svar fra Aliya Yesenbaeva[guru]
Det er ionisk, kovalent (polar og ikke-polar)... Ionisk er METALL+IKKE-METALL, for eksempel Slav---NA+CL....Kovalent---Ikke-metall+ikke-metall... det er 2 typer, som jeg allerede sa, kovalente bindinger -polare er når 2 forskjellige grunnstoffer (ikke-metaller) kombineres, for eksempel H+Cl, og ikke-polare er nesten alltid enkle stoffer, for eksempel Cl2.F2.O2 og så videre)) Jeg har 4 i kjemi, men jeg har 5 i forbindelse ))Kontakt oss)) Lykke til Slavik)) Skriv til agenten hvis du ikke forstår))
Svar fra Tatyana Ivanova[guru]
Alt er sant om den metalliske bindingen: det er en binding mellom atomer i en metallkrystall.
Når det gjelder kovalente (ikke-polare og polare) og ioniske bindinger, bestemmes typen binding av forskjellen i elektronegativiteten til elementene (elektronegativitetsverdien kan sees i tabellen eller elektronegativitetsskalaen i referanseboken; den er i noen lærebøker):
- hvis forskjellen i elektronegativitet er 0, så er bindingen COVALENT IKKE-POLAR - mellom atomer av ett ikke-metallisk grunnstoff (Cl2, H2, O2, P4, mellom karbonatomer i grafitt og diamant...);
- hvis forskjellen i elektronegativitet er fra 0 til 2 (ikke inkludert 0 og 2), så er bindingen COVALENT POLAR - mellom atomer av forskjellige ikke-metaller (for eksempel H2O, PCl5, CS2), så vel som i et antall av forbindelser av metaller med ikke-metaller (for eksempel germaniumoksid GeO2 - elektronegativitetsforskjellen er 3,50 - 2,02 = 1,48; magnesiumsilisid Mg2Si - elektronegativitetsforskjellen er 2,25 - 1,23 = 1,02);
- hvis forskjellen i elektronegativitet er større enn eller lik 2, så er den IONISKE bindingen en binding mellom metaller og ikke-metaller som er plassert langt fra hverandre i det periodiske systemet (metaller i gruppe 1 og 2 og ikke-metaller av gruppe 6 og 7, for eksempel: kalsiumoksid CaO - elektronegativitetsforskjellen er lik 3,50 - 0,86 = 2,64 kaliumfluorid KF - elektronegativitetsforskjellen er 4,10 - 0,91 = 3,19;
Dermed kan en kovalent polar binding betraktes som en overgang mellom en kovalent ikke-polar og en ionisk binding. Det er ingen klar grense mellom ioniske og kovalente polare bindinger, siden mekanismen for dannelse av kovalente og ioniske bindinger er den samme, ionisk binding er den ekstreme graden av kovalent polar binding.
Så når du bestemmer bindingstypen, vær veiledet av de tidligere svarene, men hvis du trenger å avklare bindingstypen mellom et metall og et ikke-metall (denne bindingen er ikke alltid ionisk!), så bruk elektronegativitetsskalaen.
170009 0
Hvert atom har et visst antall elektroner.
Når de inngår kjemiske reaksjoner, donerer, får eller deler atomer elektroner, og oppnår den mest stabile elektroniske konfigurasjonen. Konfigurasjonen med lavest energi (som i edelgassatomer) viser seg å være den mest stabile. Dette mønsteret kalles "oktettregelen" (fig. 1).
Ris. 1.
Denne regelen gjelder for alle typer tilkoblinger. Elektroniske forbindelser mellom atomer lar dem danne stabile strukturer, fra de enkleste krystallene til komplekse biomolekyler som til slutt danner levende systemer. De skiller seg fra krystaller i deres kontinuerlige metabolisme. Samtidig foregår mange kjemiske reaksjoner i henhold til mekanismene elektronisk overføring, som spiller en kritisk rolle i energiprosesser i kroppen.
En kjemisk binding er kraften som holder sammen to eller flere atomer, ioner, molekyler eller en kombinasjon av disse.
Naturen til en kjemisk binding er universell: det er en elektrostatisk tiltrekningskraft mellom negativt ladede elektroner og positivt ladede kjerner, bestemt av konfigurasjonen av elektronene til det ytre skallet av atomer. Et atoms evne til å danne kjemiske bindinger kalles valens, eller oksidasjonstilstand. Konseptet med valenselektroner- elektroner som danner kjemiske bindinger, det vil si lokalisert i orbitalene med høyest energi. Følgelig kalles det ytre skallet til atomet som inneholder disse orbitalene valens skall. For øyeblikket er det ikke nok å indikere tilstedeværelsen av en kjemisk binding, men det er nødvendig å avklare typen: ionisk, kovalent, dipol-dipol, metallisk.
Den første typen tilkobling erionisk forbindelse
I følge Lewis og Kossels elektroniske valensteori kan atomer oppnå en stabil elektronisk konfigurasjon på to måter: For det første ved å miste elektroner, bli kationer, for det andre å anskaffe dem, bli til anioner. Som et resultat av elektronoverføring, på grunn av den elektrostatiske tiltrekningskraften mellom ioner med ladninger av motsatte fortegn, dannes en kjemisk binding, kalt av Kossel " elektrovalent"(nå kalt ionisk).
I dette tilfellet danner anioner og kationer en stabil elektronisk konfigurasjon med et fylt ytre elektronskall. Typiske ioniske bindinger dannes fra kationer T- og II-grupper i det periodiske systemet og anioner av ikke-metalliske elementer i gruppene VI og VII (henholdsvis 16 og 17 undergrupper, kalkogener Og halogener). Bindingene til ioniske forbindelser er umettede og ikke-retningsbestemte, så de beholder muligheten for elektrostatisk interaksjon med andre ioner. I fig. Figur 2 og 3 viser eksempler på ioniske bindinger som tilsvarer Kossel-modellen for elektronoverføring.
Ris. 2.
Ris. 3. Ionebinding i et molekyl av bordsalt (NaCl)
Her er det hensiktsmessig å huske noen egenskaper som forklarer oppførselen til stoffer i naturen, spesielt vurdere ideen om syrer Og grunner.
Vandige løsninger av alle disse stoffene er elektrolytter. De skifter farge annerledes indikatorer. Virkningsmekanismen til indikatorer ble oppdaget av F.V. Ostwald. Han viste at indikatorer er svake syrer eller baser, hvis farge er forskjellig i udissosierte og dissosierte tilstander.
Baser kan nøytralisere syrer. Ikke alle baser er løselige i vann (for eksempel er noen organiske forbindelser som ikke inneholder OH-grupper uløselige, spesielt trietylamin N(C 2 H 5) 3); løselige baser kalles alkalier.
Vandige løsninger av syrer gjennomgår karakteristiske reaksjoner:
a) med metalloksider - med dannelse av salt og vann;
b) med metaller - med dannelse av salt og hydrogen;
c) med karbonater - med dannelse av salt, CO 2 og N 2 O.
Egenskapene til syrer og baser er beskrevet av flere teorier. I samsvar med teorien til S.A. Arrhenius, en syre er et stoff som dissosieres for å danne ioner N+ , mens basen danner ioner HAN-. Denne teorien tar ikke hensyn til eksistensen av organiske baser som ikke har hydroksylgrupper.
I samsvar med proton I følge teorien til Brønsted og Lowry er en syre et stoff som inneholder molekyler eller ioner som donerer protoner ( givere protoner), og en base er et stoff som består av molekyler eller ioner som aksepterer protoner ( akseptere protoner). Merk at i vandige løsninger eksisterer hydrogenioner i hydratisert form, det vil si i form av hydroniumioner H3O+ . Denne teorien beskriver reaksjoner ikke bare med vann og hydroksidioner, men også de som utføres i fravær av et løsningsmiddel eller med et ikke-vandig løsningsmiddel.
For eksempel i reaksjonen mellom ammoniakk N.H. 3 (svak base) og hydrogenklorid i gassfasen, dannes fast ammoniumklorid, og i en likevektsblanding av to stoffer er det alltid 4 partikler, hvorav to er syrer, og de to andre er baser:
Denne likevektsblandingen består av to konjugerte par syrer og baser:
1)N.H. 4+ og N.H. 3
2) HCl Og Cl ‑
Her, i hvert konjugert par, skiller syren og basen seg med ett proton. Hver syre har en konjugert base. En sterk syre har en svak konjugert base, og en svak syre har en sterk konjugert base.
Brønsted-Lowry-teorien hjelper til med å forklare vannets unike rolle for biosfærens liv. Vann, avhengig av stoffet som interagerer med det, kan vise egenskapene til enten en syre eller en base. For eksempel, i reaksjoner med vandige løsninger av eddiksyre, er vann en base, og i reaksjoner med vandige løsninger av ammoniakk er det en syre.
1) CH3COOH + H2O ↔ H3O + + CH 3 COO-. Her donerer et eddiksyremolekyl et proton til et vannmolekyl;
2) NH 3 + H2O ↔ NH 4 + + HAN-. Her aksepterer et ammoniakkmolekyl et proton fra et vannmolekyl.
Dermed kan vann danne to konjugerte par:
1) H2O(syre) og HAN- (konjugert base)
2) H 3 O+ (syre) og H2O(konjugert base).
I det første tilfellet donerer vann et proton, og i det andre aksepterer det det.
Denne egenskapen kalles amfiprotonisme. Stoffer som kan reagere som både syrer og baser kalles amfoterisk. Slike stoffer finnes ofte i levende natur. For eksempel kan aminosyrer danne salter med både syrer og baser. Derfor danner peptider lett koordinasjonsforbindelser med metallionene som er tilstede.
En karakteristisk egenskap til en ionisk binding er således den fullstendige bevegelsen av bindingselektronene til en av kjernene. Dette betyr at mellom ionene er det et område hvor elektrontettheten er nesten null.
Den andre typen tilkobling erkovalent forbindelse
Atomer kan danne stabile elektroniske konfigurasjoner ved å dele elektroner.
En slik binding dannes når et elektronpar deles én om gangen fra alle atom. I dette tilfellet er de delte bindingselektronene fordelt likt mellom atomene. Eksempler på kovalente bindinger inkluderer homonukleær diatomisk molekyler H 2 , N 2 , F 2. Samme type forbindelse finnes i allotroper O 2 og ozon O 3 og for et polyatomisk molekyl S 8 og også heteronukleære molekyler hydrogenklorid HCl karbondioksid CO 2, metan CH 4, etanol MED 2 N 5 HAN svovelheksafluorid SF 6, acetylen MED 2 N 2. Alle disse molekylene deler de samme elektronene, og bindingene deres er mettet og rettet på samme måte (fig. 4).
Det er viktig for biologer at dobbelt- og trippelbindinger har reduserte kovalente atomradier sammenlignet med en enkeltbinding.
Ris. 4. Kovalent binding i et Cl 2 molekyl.
Ioniske og kovalente typer bindinger er to ekstreme tilfeller av de mange eksisterende typene kjemiske bindinger, og i praksis er de fleste bindinger mellomliggende.
Forbindelser av to elementer lokalisert i motsatte ender av samme eller forskjellige perioder i det periodiske systemet danner hovedsakelig ioniske bindinger. Når elementer beveger seg nærmere hverandre i løpet av en periode, reduseres den ioniske naturen til forbindelsene deres, og den kovalente karakteren øker. For eksempel danner halogenidene og oksidene til grunnstoffene på venstre side av det periodiske systemet hovedsakelig ioniske bindinger ( NaCl, AgBr, BaSO 4, CaCO 3, KNO 3, CaO, NaOH), og de samme forbindelsene av elementer på høyre side av tabellen er kovalente ( H 2 O, CO 2, NH 3, NO 2, CH 4, fenol C6H5OH glukose C6H12O6 etanol C2H5OH).
Den kovalente bindingen har på sin side en modifikasjon til.
I polyatomiske ioner og i komplekse biologiske molekyler kan begge elektronene bare komme fra en atom. Det heter giver elektronpar. Et atom som deler dette elektronparet med en donor kalles akseptor elektronpar. Denne typen kovalente bindinger kalles koordinering (donor-akseptor, ellerdativ) kommunikasjon(Fig. 5). Denne typen bindinger er viktigst for biologi og medisin, siden kjemien til de d-elementene som er viktigst for stoffskiftet i stor grad beskrives av koordinasjonsbindinger.
Fig. 5.
Som regel fungerer metallatomet i en kompleks forbindelse som en akseptor for et elektronpar; tvert imot, i ioniske og kovalente bindinger er metallatomet en elektrondonor.
Essensen av den kovalente bindingen og dens variasjon - koordinasjonsbindingen - kan avklares ved hjelp av en annen teori om syrer og baser foreslått av GN. Lewis. Han utvidet noe det semantiske konseptet med begrepene "syre" og "base" i henhold til Brønsted-Lowry-teorien. Lewis teori forklarer arten av dannelsen av komplekse ioner og deltakelsen av stoffer i nukleofile substitusjonsreaksjoner, det vil si i dannelsen av CS.
Ifølge Lewis er en syre et stoff som er i stand til å danne en kovalent binding ved å akseptere et elektronpar fra en base. En Lewis-base er et stoff som har et ensomt elektronpar, som ved å donere elektroner danner en kovalent binding med Lewis-syre.
Det vil si at Lewis sin teori utvider rekkevidden av syre-base-reaksjoner også til reaksjoner der protoner ikke deltar i det hele tatt. Dessuten er selve protonet, ifølge denne teorien, også en syre, siden det er i stand til å akseptere et elektronpar.
Derfor, ifølge denne teorien, er kationene Lewis-syrer og anionene er Lewis-baser. Et eksempel kan være følgende reaksjoner:
Det ble bemerket ovenfor at delingen av stoffer i ioniske og kovalente er relativ, siden fullstendig elektronoverføring fra metallatomer til akseptoratomer ikke forekommer i kovalente molekyler. I forbindelser med ioniske bindinger er hvert ion i det elektriske feltet til ioner med motsatt fortegn, så de er gjensidig polarisert, og skallene deres deformeres.
Polariserbarhet bestemt av den elektroniske strukturen, ladningen og størrelsen på ionet; for anioner er det høyere enn for kationer. Den høyeste polariserbarheten blant kationer er for kationer med høyere ladning og mindre størrelse, for eksempel, Hg 2+, Cd 2+, Pb 2+, Al 3+, Tl 3+. Har en sterk polariserende effekt N+ . Siden påvirkningen av ionepolarisering er toveis, endrer den egenskapene til forbindelsene de danner betydelig.
Den tredje typen tilkobling erdipol-dipol forbindelse
I tillegg til de listede kommunikasjonstypene er det også dipol-dipol intermolekylært interaksjoner, også kalt van der Waals .
Styrken til disse interaksjonene avhenger av molekylenes natur.
Det er tre typer interaksjoner: permanent dipol - permanent dipol ( dipol-dipol tiltrekning); permanent dipol - indusert dipol ( induksjon tiltrekning); øyeblikkelig dipol - indusert dipol ( dispersive attraksjon, eller London-styrker; ris. 6).
Ris. 6.
Bare molekyler med polare kovalente bindinger har et dipol-dipolmoment ( HCl, NH 3, SO 2, H 2 O, C 6 H 5 Cl), og bindingsstyrken er 1-2 Debaya(1D = 3,338 × 10-30 coulomb meter - C × m).
I biokjemi er det en annen type forbindelse - hydrogen forbindelse, som er et begrensende tilfelle dipol-dipol tiltrekning. Denne bindingen dannes av tiltrekningen mellom et hydrogenatom og et lite elektronegativt atom, oftest oksygen, fluor og nitrogen. Med store atomer som har lignende elektronegativitet (som klor og svovel), er hydrogenbindingen mye svakere. Hydrogenatomet utmerker seg ved en betydelig egenskap: når bindingselektronene trekkes bort, blir kjernen - protonet - eksponert og er ikke lenger skjermet av elektroner.
Derfor blir atomet til en stor dipol.
En hydrogenbinding, i motsetning til en van der Waals-binding, dannes ikke bare under intermolekylære interaksjoner, men også innenfor ett molekyl - intramolekylært hydrogenbinding. Hydrogenbindinger spiller en viktig rolle i biokjemi, for eksempel for å stabilisere strukturen til proteiner i form av en a-helix, eller for dannelsen av en dobbel helix av DNA (fig. 7).
Fig.7.
Hydrogen- og van der Waals-bindinger er mye svakere enn ioniske, kovalente og koordinasjonsbindinger. Energien til intermolekylære bindinger er angitt i tabellen. 1.
Tabell 1. Energi av intermolekylære krefter
Note: Graden av intermolekylære interaksjoner reflekteres av entalpien for smelting og fordampning (koking). Ioneforbindelser krever betydelig mer energi for å skille ioner enn for å skille molekyler. Entalpien for smelting av ioniske forbindelser er mye høyere enn for molekylære forbindelser.
Den fjerde typen tilkobling ermetallforbindelse
Til slutt er det en annen type intermolekylære bindinger - metall: kobling av positive ioner av et metallgitter med frie elektroner. Denne typen sammenheng forekommer ikke i biologiske objekter.
Fra en kort gjennomgang av bindingstyper blir en detalj klar: en viktig parameter for et metallatom eller ion - en elektrondonor, så vel som et atom - en elektronakseptor, er dens størrelse.
Uten å gå inn på detaljer, legger vi merke til at de kovalente radiene til atomer, de ioniske radiene til metaller og van der Waals-radiene til interagerende molekyler øker når deres atomnummer øker i grupper i det periodiske systemet. I dette tilfellet er verdiene til ioneradiene de minste, og van der Waals-radiene er de største. Som regel, når du beveger deg nedover i gruppen, øker radiene til alle elementene, både kovalente og van der Waals.
Av størst betydning for biologer og leger er koordinasjon(giver-akseptor) bindinger vurdert av koordinasjonskjemi.
Medisinsk bioinorganisk stoff. G.K. Barashkov
 Luminescens: typer, metoder, applikasjoner
Luminescens: typer, metoder, applikasjoner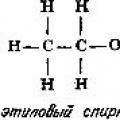 Grunnleggende prinsipper for organisk kjemi Klassifisering av organiske reaksjoner
Grunnleggende prinsipper for organisk kjemi Klassifisering av organiske reaksjoner Forskjellen mellom en lærer og en lærer Hva er forskjellen mellom en lærer og en lærer
Forskjellen mellom en lærer og en lærer Hva er forskjellen mellom en lærer og en lærer