Kirjanduse arvustus. Vesinikside Olulisemad oksüdeerivad ja redutseerivad ained
Keerulised ühendused. Werneri teooria. Roll elusorganismis.



Kompleksühendite dissotsiatsioon. Komplekssete ioonide ebastabiilsuse konstant.


Keemiline side kompleksühendites (näited).
Laetud kompleksidega kristalsetes kompleksühendites on seos kompleksi ja välissfääri ioonide vahel iooniline, ühendused välissfääri ülejäänud osakeste vahel – molekulidevaheline(kaasa arvatud vesinikuga). Enamikus keerukates osakestes on sidemed keskaatomi ja ligandide vahel kovalentne. Kõik need või osa neist moodustatakse vastavalt doonor-aktseptori mehhanismile (selle tagajärjel - formaalsete tasude muutumisega). Kõige vähem stabiilsetes kompleksides (näiteks leelis- ja leelismuldmetallide elementide, aga ka ammooniumi vesikompleksides) hoiab ligande elektrostaatiline külgetõmme. Keerukate osakeste sidumist nimetatakse sageli doonor-aktseptor- või koordineerivaks sidemeks.
Redoksreaktsioonid. Redoksreaktsioonide tüübid.

Redoksreaktsioonide tüübid:
1) Molekulidevaheline- reaktsioonid, mille käigus erinevate ainete molekulides leidub oksüdeerivaid ja redutseerivaid aatomeid, näiteks:
H2S + Cl2 → S + 2HCl
2) Intramolekulaarne- reaktsioonid, mille käigus sama aine molekulides leidub oksüdeerivaid ja redutseerivaid aatomeid, näiteks:
2H2O → 2H2+O2
3) Ebaproportsionaalsus(autooksüdatsioon-iseparanemine) - reaktsioonid, milles sama element toimib nii oksüdeeriva ainena kui ka redutseerijana, näiteks:
Cl 2 + H 2 O → HClO + HCl
4)Ümberproportsionaalsus- reaktsioonid, mille käigus saadakse üks oksüdatsiooniaste sama elemendi kahest erinevast oksüdatsiooniastmest, näiteks:
NH4NO3 → N2O + 2H2O
Olulisemad oksüdeerivad ja redutseerivad ained. Redoks duaalsus.
| Restauraatorid | Oksüdeerivad ained |
| Metallid | Halogeenid |
| Vesinik | Kaaliumpermanganaat (KMnO 4) |
| Kivisüsi | Kaaliummanganaat (K 2 MnO 4) |
| Süsinik(II)monooksiid (CO) | Mangaan(IV)oksiid (MnO 2) |
| Vesiniksulfiid (H2S) | Kaaliumdikromaat (K 2 Cr 2 O 7) |
| Väävel(IV)oksiid (SO2) | Kaaliumkromaat (K 2 CrO 4) |
| Väävelhape H 2 SO 3 ja selle soolad | Lämmastikhape (HNO3) |
| Vesinikhalogenidhapped ja nende soolad | Väävelhape (H 2 SO 4) konts. |
| Metalli katioonid madalamas oksüdatsiooniastmes: SnCl 2, FeCl 2, MnSO 4, Cr 2 (SO 4) 3 | Vask(II)oksiid (CuO) |
| Lämmastikhape HNO 2 | Plii(IV)oksiid (PbO2) |
| Ammoniaak NH3 | Hõbeoksiid (Ag 2 O) |
| Hüdrasiin NH 2 NH 2 | Vesinikperoksiid (H 2 O 2) |
| Lämmastikoksiid (II) (NO) | Raud(III)kloriid (FeCl3) |
| Katood elektrolüüsi ajal | Bertholleti sool (KClO 3) |
| Metallid | Anood elektrolüüsi ajal |

Vesiniksidemed ei ole ainult veele. Need moodustuvad kergesti mis tahes elektronegatiivse aatomi (tavaliselt hapniku või lämmastiku) ja vesinikuaatomi vahel, mis on kovalentselt seotud teise elektronegatiivse aatomiga samas või teises molekulis (joonis 4-3). Väga elektronegatiivsete aatomitega, nagu hapnik, kovalentselt seotud vesinikuaatomid kannavad alati osalisi positiivseid laenguid ja on seetõttu võimelised moodustama vesiniksidemeid, samas kui vesinikuaatomid, mis on kovalentselt seotud süsinikuaatomitega, mis ei ole elektronegatiivsed, ei kanna osalisi positiivseid laenguid ja seetõttu ei saa nad moodustavad vesiniksidemeid. Just see erinevus on põhjus, miks butüülalkoholil, mille molekulis on üks vesinikuaatomitest seotud hapnikuga ja mis võib seega moodustada vesiniksideme teise butüülalkoholi molekuliga, on suhteliselt kõrge keemistemperatuur (+117 °C). . Vastupidi, butaanil, mis ei ole võimeline moodustama molekulidevahelisi vesiniksidemeid, kuna kõik selle molekulide vesinikuaatomid on seotud süsinikuga, on madal keemistemperatuur (-0,5 ° C).
Mõned näited bioloogiliselt olulistest vesiniksidemetest on näidatud joonisel fig. 4-4.

Riis. 4-3. Vesiniksidemed. Seda tüüpi sidemetes jaotub vesinikuaatom kahe elektronegatiivse aatomi vahel ebaühtlaselt. Ja millega vesinik on kovalentselt seotud, toimib vesiniku doonorina ja teise molekuli elektronegatiivne aatom toimib aktseptorina. Bioloogilistes süsteemides on vesiniksidemete moodustumisel osalevad elektronegatiivsed aatomid hapnik ja lämmastik; süsinikuaatomid osalevad vesiniksidemete moodustamises vaid harvadel juhtudel. Kahe vesiniksidemega ühendatud elektronegatiivse agoomi vaheline kaugus varieerub vahemikus 0,26 kuni 0,31 nm. Allpool on näidatud levinumad vesiniksidemete tüübid.
Üks vesiniksidemete iseloomulikke omadusi on see, et need on tugevaimad juhtudel, kus omavahel ühendatud molekulide vastastikune orientatsioon annab maksimaalse elektrostaatilise interaktsiooni energia (joon. 4-5). Teisisõnu iseloomustab vesiniksidet teatud orientatsioon ja selle tulemusena on see võimeline hoidma mõlemaid molekule või sellega seotud rühmi teatud vastastikuses orientatsioonis. Allpool näeme, et just see vesiniksidemete omadus aitab kaasa suurel hulgal molekulisiseseid vesiniksidemeid sisaldavatele valgumolekulidele ja nukleiinhapetele iseloomulike rangelt määratletud ruumiliste struktuuride stabiliseerumisele (peatükid 7, 8 ja 27).
Vesiniksideme mõiste
Tugevalt elektronegatiivse aatomiga (hapnik, fluor, kloor, lämmastik) seotud vesinikuaatom võib interakteeruda selle või mõne teise molekuli teise tugevalt elektronegatiivse aatomi üksikelektronipaariga, moodustades nõrga lisasideme – vesiniksideme. Sel juhul saab tasakaalu luua
Pilt 1.
Vesiniksideme välimus on eelnevalt määratud vesinikuaatomi eksklusiivsusega. Vesiniku aatom on palju väiksem kui teised aatomid. Selle ja elektronegatiivse aatomi moodustatud elektronipilv on tugevalt nihkunud viimase poole. Selle tulemusena jääb vesiniku tuum nõrgalt varjestatuks.
Karboksüülhapete, alkoholide või fenoolide kahe molekuli hüdroksüülrühmade hapnikuaatomid võivad vesiniksidemete moodustumise tõttu läheneda üksteisele.
Vesiniku aatomi tuuma positiivne laeng ja teise elektronegatiivse aatomi negatiivne laeng tõmbavad teineteist. Nende vastasmõju energia on võrreldav eelmise sideme energiaga, seega on prooton seotud kahe aatomiga korraga. Side teise elektronegatiivse aatomiga võib olla tugevam kui algne side.
Prooton võib liikuda ühelt elektronegatiivselt aatomilt teisele. Energiabarjäär sellise ülemineku jaoks on tähtsusetu.
Vesiniksidemed kuuluvad keskmise tugevusega keemiliste sidemete hulka, kuid kui selliseid sidemeid on palju, siis aitavad need kaasa tugevate dimeersete või polümeersete struktuuride tekkele.
Näide 1
Vesiniksideme moodustumine desoksüribonukleiinhappe $\alfa $-spiraalses struktuuris, kristallilise jää teemanditaoline struktuur jne.
Hüdroksüülrühmas oleva dipooli positiivne ots on vesinikuaatomi juures, seega võib vesiniku kaudu tekkida side anioonide või elektronegatiivsete aatomitega, mis sisaldavad üksikuid elektronpaare.
Peaaegu kõigis teistes polaarsetes rühmades paikneb dipooli positiivne ots molekuli sees ja on seetõttu raskesti ligipääsetav sidumiseks. Karboksüülhapetes $(R=RCO)$, alkoholides $(R=Alk)$, fenoolides $(R=Ar)$ asub dipooli $OH$ positiivne ots väljaspool molekuli:
Näited $C-O, S-O, P-O$ dipooli positiivse otsa leidmiseks molekulis:

Joonis 2. Atsetoon, dimetüülsulfoksiid (DMSO), heksametüülfosfortriamiid (HMPTA)
Kuna puuduvad steerilised takistused, on vesiniksidemeid lihtne moodustada. Selle tugevuse määrab peamiselt asjaolu, et ta on oma olemuselt valdavalt kovalentne.
Tavaliselt tähistatakse vesiniksideme olemasolu punktiirjoonega doonori ja aktseptori vahel, näiteks alkoholides

Joonis 3.
Tavaliselt on kahe hapnikuaatomi ja vesiniksideme vaheline kaugus väiksem kui hapnikuaatomite van der Waalsi raadiuste summa. Hapnikuaatomite elektronkestad peavad vastastikuselt tõrjuma. Tõrkejõud saab aga üle vesiniksideme jõuga.
Vesiniksideme olemus
Vesinikside on oma olemuselt elektrostaatiline ja doonor-aktseptor. Põhiroll vesiniksideme energia moodustumisel on elektrostaatilisel interaktsioonil. Molekulidevahelise vesiniksideme moodustumisel osalevad kolm aatomit, mis paiknevad peaaegu samal sirgel, kuid nendevahelised kaugused on erinevad. (erandiks on $F-H\cdots F-$ ühendus).
Näide 2
Molekulidevaheliste vesiniksidemete puhul jääs, $-O-H\cdots OH_2$, on $O-H$ kaugus $0.097$ nm ja $H\cdots O$ kaugus $0.179$ nm.
Enamiku vesiniksidemete energia jääb vahemikku $10-40$ kJ/mol ja see on palju väiksem kui kovalentse või ioonse sideme energia. Sageli võib täheldada, et vesiniksidemete tugevus suureneb koos doonori happesuse ja prootoni aktseptori aluselisusega.
Molekulidevahelise vesiniksideme tähtsus
Vesinikside mängib olulist rolli ühendi füüsikaliste ja keemiliste omaduste avaldumises.
Vesiniksidemetel on ühenditele järgmine mõju:
Intramolekulaarsed vesiniksidemed
Juhtudel, kui on võimalik kuue- või viieliikmelise tsükli sulgemine, tekivad molekulisisesed vesiniksidemed.
Molekulisiseste vesiniksidemete olemasolu salitsüülaldehüüdis ja o-nitrofenoolis on põhjus, miks nende füüsikalised omadused erinevad vastavatest omadustest. meta- Ja paar- isomeerid.
$o$-Hüdroksübensaldehüüd ehk salitsüülaldehüüd $(A)$ ja $o$-nitrofenool (B) ei moodusta molekulidevahelisi assotsiatsioone, seetõttu on neil madalam keemistemperatuur. Need lahustuvad vees halvasti, kuna ei osale molekulidevaheliste vesiniksidemete moodustamises veega.

Joonis 5.
$o$-nitrofenool on ainuke kolmest nitrofenoolide isomeersest esindajast, mis on võimeline aurudestillatsiooniks. See omadus on aluseks selle eraldamisele nitrofenooli isomeeride segust, mis moodustub fenoolide nitreerimise tulemusena.
Vesiniksidemed on spetsiifiline side, mille loob H-aatom, mida leidub rühmades OH, NH, FH, ClH ja mõnikord SH, ning H seob need rühmad valentsiga küllastunud aatomitega N2, O2 ja F.
Vesiniksidemed määravad vee kui kõige olulisema ja põhilisema lahusti bioloogilistes süsteemides struktuuri ja omadused. Vesiniksidemed osalevad makromolekulide, biopolümeeride, aga ka sidemete moodustumisel väikeste molekulidega.
Uvesi = 4-29 kJ/mol
Põhiline panus vesiniksidemetesse tuleneb elektrostaatilistest interaktsioonidest, kuid need ei piirdu nendega. Prooton liigub mööda elektronegatiivseid aatomeid ühendavat sirgjoont ja kogeb nendelt aatomitelt erinevaid mõjusid.
See graafik on erijuhtum, seos N-H...N ja N...H-N vahel. R on interakteeruvate osakeste vaheline kaugus. 2 vaba energia miinimumi asuvad esimese või teise interakteeruva lämmastiku aatomi läheduses.
-
Vesinik side- spetsiifiline ühendus, mille tekitab H-aatom, mis paikneb rühmades OH, NH, FH, ClH ja mõnikord SH, ning H seob need rühmad valentsiga küllastunud aatomitega N2, O2 ja F. -
Vesinik ühendus Ja teda rolli V bioloogiline süsteemid. Vesinik side- spetsiifiline ühendus, mille loob rühmas olev H-aatom. -
Vesinik ühendus Ja teda rolli V bioloogiline süsteemid.
Ta ehitatud valgufibrillaarsete molekulide võrgustiku kujul, mille hulgas on märkimisväärne rolli mängib alfa-aktiniini. -
Vesinik ühendus Ja teda rolli V bioloogiline süsteemid. Vesinik side- spetsiifiline ühendus -
Vesinik ühendus Ja teda rolli V bioloogiline süsteemid. Vesinik side- spetsiifiline ühendus, mille tekitab H-aatom, mis on OH-rühmades, ... rohkem ». -
Vesinik ühendus Ja teda rolli V bioloogiline süsteemid. Vesinik side- spetsiifiline ühendus, mille tekitab H-aatom, mis on OH-rühmades, ... rohkem ». -
Roll V bioloogiline süsteemid.
vesinik ühendus Keemiline side -
2) intermolekulaarne, kui EA ja EV aatomid on erinevates molekulides. Intramolekulaarne vesinik side mängida kõige tähtsamat bioloogiline rolli, kuna need määravad näiteks polümeersete valgumolekulide spiraalse struktuuri. -
Süstikute ülekandemehhanismid vesinik. Kodu rolli TCA tsükkel on suure hulga ATP moodustumine.
Selles transpordis süsteem vesinik tsütoplasmaatilisest NAD-st kandub üle mitokondriaalsele NAD-ile, mistõttu tekib mitokondrites 3 ATP molekuli ja... -
Roll difusioon aine ülekandeprotsessides V bioloogiline süsteemid.
Intermolekulaarne ja intramolekulaarne vesinik ühendus Keemiline side molekulides on tavaliselt väga pro... rohkem ».
Leitud sarnaseid lehti:10
Artikli sisu
VESINIKSIIDEMINE(H-side) on spetsiifiline interaktsiooni tüüp reaktiivsete rühmade vahel, kusjuures üks rühmadest sisaldab vesinikuaatomit, mis on sellisele interaktsioonile kalduv. Vesinikside on ülemaailmne nähtus, mis hõlmab kogu keemiat. Erinevalt tavalistest keemilistest sidemetest ei teki H-side sihipärase sünteesi tulemusena, vaid tekib sobivates tingimustes ise ja avaldub molekulidevahelise või molekulisisese interaktsioonina.
Vesiniksideme omadused.
Vesiniksideme eripäraks on suhteliselt madal tugevus, selle energia on 5–10 korda madalam keemilise sideme energiast. Energia osas on see vahepealne positsioon keemiliste sidemete ja van der Waalsi interaktsioonide vahel, need, mis hoiavad molekule tahkes või vedelas faasis.
H-sideme tekkimisel mängib määravat rolli sidemes osalevate aatomite elektronegatiivsus - võime tõmmata keemilise sideme elektrone selles sidemes osalevast partneraatomist. Selle tulemusena tekib aatomile A suurenenud elektronegatiivsusega osaline negatiivne laeng d- ja partneraatomile positiivne laeng d+ ning keemiline side polariseerub: A d- –H d+.
Saadud vesinikuaatomi osaline positiivne laeng võimaldab sellel meelitada ligi teist molekuli, mis sisaldab ka elektronegatiivset elementi, seega annavad elektrostaatilised interaktsioonid peamise panuse H-sideme moodustumisse.
H-sideme tekkimine hõlmab kolme aatomit, kahte elektronegatiivset (A ja B) ning nende vahel asuvat vesinikuaatomit H sellise sideme struktuuri võib kujutada järgmiselt: B···H d+ –A d- (; vesinikside on tavaliselt tähistatud punktiirjoonega ). Aatomit A, mis on keemiliselt seotud H-ga, nimetatakse prootonidoonoriks (ladina keeles donare – anna, anneta) ja B on selle aktseptor (ladina keeles aktsepteerija – vastuvõtja). Enamasti puudub tõeline "annetus" ja H jääb A-ga keemiliselt seotuks.
H-sidemete moodustamiseks H varustavaid doonor-aatomeid A pole palju, praktiliselt ainult kolm: N, O ja F, samas on aktseptor-aatomite hulk B väga lai.
Selle mõiste ja termini “vesinikside” võtsid kasutusele W. Latimer ja R. Rodebush 1920. aastal, et selgitada vee, alkoholide, vedela HF ja mõnede teiste ühendite kõrgeid keemistemperatuure. Võrreldes sarnaste ühendite H 2 O, H 2 S, H 2 Se ja H 2 Te keemistemperatuure, märkasid nad, et selle seeria esimene liige - vesi - keeb palju kõrgemal, kui see tulenes ülejäänud liikmete moodustatud mustrist. sarjast. Sellest mustrist järeldub, et vesi peaks keema 200 °C madalamal kui vaadeldud tegelik väärtus.
Täpselt sama hälvet täheldatakse ammoniaagi puhul reas sarnastes ühendites: NH 3, H 3 P, H 3 As, H 3 Sb. Selle tõeline keemistemperatuur (–33 °C) on oodatust 80 °C kõrgem.
Kui vedelik keeb, hävivad ainult van der Waalsi interaktsioonid, need, mis hoiavad molekule vedelas faasis. Kui keemistemperatuurid on ootamatult kõrged, siis järelikult seovad molekulid lisaks veel mingid muud jõud. Sel juhul on need vesiniksidemed.
Samamoodi on alkoholide kõrgem keemistemperatuur (võrreldes ühenditega, mis ei sisalda -OH rühma) vesiniksidemete moodustumise tagajärg.
Praegu pakuvad spektraalmeetodid (kõige sagedamini infrapunaspektroskoopia) usaldusväärset viisi H-sidemete tuvastamiseks. Vesiniksidemetega ühendatud AN-rühmade spektraalsed omadused erinevad oluliselt nendest juhtudest, kui selline side puudub. Lisaks, kui struktuuriuuringud näitavad, et B-H-aatomite vaheline kaugus on väiksem kui van der Waalsi raadiuste summa, loetakse H-sideme olemasolu kindlaks tehtud.
Lisaks tõusnud keemistemperatuurile avalduvad vesiniksidemed ka aine kristalse struktuuri kujunemisel, suurendades selle sulamistemperatuuri. Jää kristallstruktuuris moodustavad H-sidemed kolmemõõtmelise võrgustiku, mille veemolekulid on paigutatud nii, et ühe molekuli vesinikuaatomid on suunatud naabermolekulide hapnikuaatomite poole:

Boorhape B(OH) 3 on kihilise kristallstruktuuriga, iga molekul on vesiniksidemetega ühendatud kolme teise molekuliga. Molekulide pakkimine kihti moodustab kuusnurkadest kokkupandud parketi mustri:

Enamik orgaanilisi aineid on vees lahustumatud, kui seda reeglit rikutakse, on see enamasti vesiniksidemete sekkumise tagajärg.
Hapnik ja lämmastik on peamised prootonite doonorid, mis täidavad aatomi A funktsiooni triaadis B···H d+ –A d-, millest oli juttu varem. Enamasti toimivad nad aktseptoridena (aatom B). Tänu sellele võivad mõned orgaanilised ained, mis sisaldavad O ja N aatomina B, vees lahustuda (aatomi A rolli täidab vees olev hapnik). Vesiniksidemed orgaanilise aine ja vee vahel aitavad "lahti tõmmata" orgaanilise aine molekule, viies selle vesilahusesse.
Kehtib rusikareegel: kui orgaaniline aine ei sisalda rohkem kui kolm süsinikuaatomit hapnikuaatomi kohta, siis on see vees kergesti lahustuv:

Benseen lahustub vees väga vähe, kuid kui asendada üks CH rühm N-ga, saame püridiini C 5 H 5 N, mis seguneb veega mis tahes vahekorras.
Vesiniksidemed võivad avalduda ka mittevesilahustes, kui vesinikul tekib osaline positiivne laeng ja läheduses on molekul, mis sisaldab “head” aktseptorit, tavaliselt hapnikku. Näiteks kloroform HCCl3 lahustab rasvhappeid ja atsetüleen HCєCH lahustub atsetoonis:
See asjaolu on leidnud olulist tehnilist rakendust, rõhu all olev atsetüleen on kergete löökide suhtes väga tundlik ja plahvatab kergesti ning selle lahust rõhu all olevas atsetoonis on ohutu käsitseda.
Vesiniksidemed mängivad polümeerides ja biopolümeerides olulist rolli. Puidu põhikomponendis tselluloosis paiknevad hüdroksüülrühmad tsüklilistest fragmentidest kokku pandud polümeerahela külgrühmadena. Hoolimata iga üksiku H-sideme suhteliselt nõrgast energiast, viib nende interaktsioon kogu polümeeri molekulis nii võimsa molekulidevahelise interaktsioonini, et tselluloosi lahustumine on võimalik ainult eksootilise ülipolaarse lahusti – Schweitzeri reaktiivi (vaskhüdroksiidi ammoniaagikompleksi) kasutamisel.
Polüamiidides (nailon, nailon) tekivad H-sidemed karbonüül- ja aminorühmade vahel >C=O···H–N
See toob kaasa kristalsete piirkondade moodustumise polümeeri struktuuris ja selle mehaanilise tugevuse suurenemise.
Sama juhtub polüuretaanidega, mille struktuur on polüamiididele lähedane:
NH-C(O)O-(CH2)4-OC(O)-NH-(CH2)n-NH-C(O)O-
Kristalliliste piirkondade moodustumine ja sellele järgnev polümeeri tugevnemine toimub H-sidemete moodustumise tõttu karbonüül- ja aminorühmade vahel >C=O···H–N<.>
Sarnaselt ühendatakse valkudes paralleelselt asetsevad polümeeriahelad, kuid H-sidemed tagavad ka erineva pakkimisviisiga valgumolekulide - spiraali kujul, samal ajal kui spiraali pöörded on kindlustatud samade vesiniksidemetega, mis tekivad karbonüül- ja aminorühmade vahel:

DNA molekul sisaldab kogu teavet konkreetse elusorganismi kohta vahelduvate tsükliliste fragmentide kujul, mis sisaldavad karbonüül- ja aminorühmi. Selliseid fragmente on nelja tüüpi: adeniin, tümiin, tsütosiin ja guaniin. Need paiknevad külgmiste ripatsitena kogu DNA polümeeri molekulis. Nende fragmentide vaheldumise järjekord määrab iga elusolendi individuaalsuse Paaristamisel tekivad NH-i karbonüül-C=O ja aminorühmade, samuti NH-i aminorühmade ja vesinikku mittesisaldavate lämmastikuaatomite vastastikmõjul H-sidemed. just need hoiavad kahte DNA molekuli tuntud topeltspiraalide kujul:

Mõnede siirdemetallide kompleksid võivad moodustada H-sidemeid (prootoni aktseptoritena); Kõige tõenäolisemalt osalevad H-sidumises VI–VIII rühma metallide kompleksid. Sellise sideme tekkimiseks on mõnel juhul vajalik võimsa prootonidoonori, näiteks trifluoroäädikhappe osalemine. Esimeses etapis (vt joonist allpool) tekib H-side iriidiumi metalli aatomi (kompleks I) osalusel, mis mängib aktseptori B rolli.
Seejärel, kui temperatuur langeb (toatemperatuurilt –50 ° C-ni), läheb prooton metalliks ja tekib tavaline M-H side. Kõik transformatsioonid on olenevalt temperatuurist pöörduvad, prooton võib liikuda kas metallile või selle doonorile – happeanioonile.
Teises etapis võtab metall (kompleks II) vastu prootoni ja koos sellega positiivse laengu ning muutub katiooniks. Tekib tavaline ioonühend (nagu NaCl). Kuid pärast metallile üleminekut säilitab prooton pideva külgetõmbe erinevate aktseptorite, antud juhul happeaniooni vastu. Selle tulemusena ilmub H-side (tähistatud tärnidega), mis pingutab ioonipaari veelgi:

Vesinikuaatom võib osaleda aatomi B rollis ehk prootoni aktseptorina, kui sellele on koondunud negatiivne laeng, see realiseerub metallhüdriidides: M d+ –H d-, metalli – vesinikku sisaldavad ühendid võlakiri. Kui metallhüdriid reageerib mõõdukalt tugeva prootoni doonoriga (näiteks fluoritud hõõrub-butanool), siis tekib ebatavaline divesiniksild, kus vesinik moodustab endaga H-sideme: M d+ –H d- ···H d+ –A d- :
Näidatud kompleksis näitavad tahke täidisega või ristviirutusega kiilukujulised jooned keemilisi sidemeid, mis on suunatud oktaeedri tippudele.
Mihhail Levitski
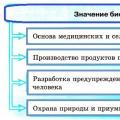 "Bioloogia koostis, meetodid ja roll
"Bioloogia koostis, meetodid ja roll Kuidas komasid õigesti panna
Kuidas komasid õigesti panna Moses Solomonovitš Uritsky: elulugu Haridus ei mänginud erilist rolli
Moses Solomonovitš Uritsky: elulugu Haridus ei mänginud erilist rolli