Люминесценция основные понятия упоминание о люминесценции датируется. Люминесценция: виды, методы, применение
Флуоресценция - это физический внутримолекулярный процесс, в результате которого молекула за время, составляющее 10~8-10~9 с, переходит в основное состояние с испусканием кванта света. Принцип Франка - Кондона. Часть электронной энергии при поглощении и испускании света должна расходоваться на увеличение колебаний структуры, превращаться в тепло. Явление наблюдается в результате резкого изменения градиента электронной энергии около ядер при возбуждении и релаксации. (закон Стокса). Спектр флуоресценции относительно спектра поглощения сдвинут в более длинноволновую сторону. Данное правило принято объяснять потерей некоторой части поглощённой энергии на тепловое движение молекул. Так как в зависимости от подведенной энергии частица может перейти в энергетически разные возбужденные состояния, можно было ожидать прямой зависимости спектров люминесценции от спектра возбуждения источника. Правило Стокса используется в осветительной технике для преобразования ультрафиолетового излучения в видимый свет. Примером является ртутная лампа, в которой пары ртути, возбуждаемые электрическим разрядом, излучают ультрафиолет. На внутреннюю поверхность лампы нанесен слой люминофора с подходящим спектром люминесценции в видимой области. По сравнению с лампами накаливания такие лампы более экономичны. Правило Каши. Спектры флуоресценции не зависят от длины волны возбуждающего света. С точки зрения энергетических уровней, верхние возбужденные состояния, как правило, расположены более близко друг к другу, чем наинизшее возбужденное состояние (синглетное или триплетное) и основное состояние. В результате этого малого расстояния скорости безызлучательного перехода между верхними возбужденными состояниями значительно превышают скорость люминесценции с этих состояний, таким образом, люминесценция с верхних уровней не происходит. Только в нижнем возбужденном состоянии скорость излучательной релаксации становится сравнима со скоростью безызлучательной релаксации, в результате чего только низшее возбужденное состояние способно к люминесценции. Правило зеркальной симметрии (Левшина) выражает тот факт, что спектры поглощения и флуоресценции, построенные в шкале частот, приближенно симметричны относительно прямой, проходящей через точку их пересечения. В основе этого правила лежит часто наблюдающаяся на практике близость структуры и взаимного расположения колебательных подуровней основного и первого возбужденного электронных состояний молекул, а также практически одинаковый характер относительного изменения вероятностей переходов в пределах полос поглощения и флуоресценции. Закон Вавилова. Устанавливает зависимость выхода фотолюминесценции от длины волны возбуждающего света. Квантовый выход люминесценции - квантовый выход - отношение числа излученных квантов к числу поглощенных. Метод спектрофлуориметрии характеризуется исключительно высокой чувствительностью и специфичностью и и даёт универсальные возможности для изучения возбужденных состояний молекул, фотохимических реакций, динамики быстрых молекулярных процессов, структуры и свойств сложных химических и биологических объектов. С помощью данного метода можно изучать свойства флуоресцирующих веществ при концентрациях, гораздо ниже тех, которые требуются для измерения спектров поглощения. Измерение спектров флуоресценции проводят с помощью прибора, называемого спектрофлуориметром. Принцип работы спектрофлуориметра основан на выделении узких участков спектра как возбуждающего, так и испускаемого света и на выборе длин волн возбуждения и испускания с помощью монохроматоров при автоматизированном управлении работой прибора, регистрации и обработке результатов флуоресцентных измерений.
75. Фотобиологические процессы: классификация.
Фотобиологические процессы - процессы, которые начинаются с поглощения квантов света биологически функциональными молекулами и заканчиваются соответствующей физиологической реакцией в организме или тканях. К фотобиологическим процессам относятся: фотосинтез - синтез органических молекул за счет энергии солнечного света; фототаксис - движение организмов (например, бактерий) к свету или от света; фототропизм - поворот листьев (стеблей) растений к свету или от него; фотопериодизм - регуляция суточных и годовых циклов животных путем циклических воздействий «свет - темнота»; зрение - восприятие света глазом, сопровождающееся превращением световой энергии в энергию нервного импульса; помутнение хрусталика; изменения состояния кожи под воздействием света: эритема, эдема, загар, пигментация, ожог, рак кожи.
76. Фотодиструктивные процессы, их общая характеристика. Фотосенсибилизация, её виды и механизм.
К фотодеструктивным процессам относятся инициируемые светом в молекулах биосубстрата реакции, приводящие к образованию таких химических изменений молекулы, которые сопровождаются нарушением или даже полной потерей их функциональных свойств и в конечном счёте обуславливают проявление повреждающих эффектов на клеточном и организменном уровнях. Фотодеструктивные реакции наиболее эффективно индуцируются в биологических системах коротковолновым ультрафиолетовым (УФ) излучением (< 290 нм), что связано с прямым поглощением этого излучения нуклеиновыми кислотами, белками и некоторыми другими биологически важными внутриклеточными компо-нентами.При определенных условиях фотодеструктивные процессы могут протекать и под действием света более длинноволнового диапазона оптического спектра, который подразделяется на три области: средневолновую УФ (290320 нм), длинноволновую УФ (320-400 нм) и видимую (400-700 нм). Длинноволновое УФ-излучение и видимый свет практически не поглощаются нуклеиновыми кислотами и белками. Поэтому инициация в них деструктивных реакций при действии этих видов оптического излучения осуществляется преимущественно с участием других молекул, выступающих в качестве первичных фо-торецепторов. Такие вещества называются фотосенсибилизаторами, а процессы, в которых они участвуют, - фотосенсибилизированными. Известно несколько типов первичных фотохимических превращений молекул, ответственных за деструктивное действие оптического излучения. К ним относятся реакции фотоокисления, фотоионизации, фотодиссоциации и фотоприсоединения. Основной первичной фотореакцией при УФ-фотолизе остатков триптофана (АН) в белках является его фотоионизация с образованием катион- радикала (АН+) и сольватированного электрона (е-s): АН AH+ + е-s. В цистиновых остатках белков первичная фотохимическая реакция заключается в фотодиссоциации S -S-связей: т. е. фотолиз цистина идет через стадию свободных радикалов с локализацией неспаренного электрона на атоме серы. При относительно низких интенсивностях УФ-света основными фотохимическими реакциями, в которые вступают основания нуклеиновых кислот, являются реакции фотоприсоединения - димеризация, гидратация и образование (6-4) пиримидиновых аддуктов. Фотосенсибилизированные деструктивные реакции в большинстве случаев протекают с участием кислорода.
Эти процессы, получившие название фотодинамических, по своему механизму разделяют на два типа в зависимости от того, каким способом энергия светового возбуждения передается от сенсибилизатора к биологическому субстрату. В реакциях типа I фотовозбужденный сенсибилизатор может вступать в оки-слительно-восстановительные реакции с различными биологически важными моле-кулами, участвуя в переносе электрона либо атома водорода. В результате образуются реакционноспособные радикалы (и/или ион-радикалы) сенсибилизатора и молекул биологического субстрата, вступающие в дальнейшие химические реакции с кислородом. В фотодинамических реакциях типа II происходит перенос энергии от возбу-жденной в триплетное состояние молекулы сенсибилизатора к кислороду с образованием его электронно-возбужденной формы 1О2; образовавшийся синглетный кислород затем окисляет молекулы биологического субстрата. С меньшей эффективностью некоторые триплетные сенсибилизаторы способны осуществлять одноэлектронное восстановление молекулярного кислорода с образованием супероксидного анион-радикала 0-2 Наряду с фотодинамическими деструктивными процессами известны механизмы фотосенсибилизации, не требующие участия кислорода. Такие фотосенсибилизированные реакции, протекающие, в частности, в ДНК, реализуются с участием молекул-сенсибилизаторов, которые либо передают энергию возбуждения на азотистые основания, обеспечивая тем самым их последующую димеризацию, либо в возбужденном состоянии реагируют с мононуклеотидами, образуя аддукты. К пер-вой группе фотосенсибилизаторов относятся некоторые кетоны; вторую группу составляют производные фурокумаринов (псоралены). При фотосенсибилизации с помощью псораленов в ДНК образуются два типа фотопродуктов: (1) моноаддукты (молекула псоралена ковалентно связана с одним пиримидином) и (2) диаддукты, или межнитевые ковалентные сшивки (молекула псоралена ковалентно связана с двумя пиримидинами).
Понятие “люминесценция” включает в себя множество различных явлений. Существует несколько систем их классификации.

В аналитической химии чаще всего используется молекулярная фотолюминесценция. В зависимости от природы основного и возбуждённого состояния молекулы её подразделяют на флуоресценцию и фосфоресценцию.
Основные характеристики и закономерности люминесценции
Основными характеристиками люминесценции являются:
· спектр возбуждения ,
· спектр испускания (спектр люминесценции),
· квантовый и энергетический выходы ,
· поляризация , время жизни и т.д.
Спектр возбуждения люминесценции (флуоресценции, фосфоресценции) - зависимость интенсивности испускаемого света с фиксированной длиной волны от длины волны или другой волновой характеристики возбуждающего света .
Возбуждая молекулу вещества светом с длиной волны, соответствующей l max спектра возбуждения, можно получить флуоресценцию с максимальной интенсивностью. В разбавленных растворах спектр возбуждения флуоресценции совпадает со спектром поглощения вещества.
Спектр люминесценции - зависимость интенсивности испускаемого света от его длины волны при фиксированной длине волны возбуждающего света .
В табл. 21.1 приведены основные свойства, присущие спектрам люминесценции.
Основные свойства спектров люминесценции
| Свойство | Объяснение |
| Спектр люминесценции не зависит от длины волны возбуждающего света (правило М.Каши) | Независимо от того, в какое возбуждённое состояние перешла молекула при поглощении фотона, испускание всегда происходит при переходе между первым возбуждённым и основным энергетическими уровнями |
| Как правило, спектр люминесценции в целом и его максимум всегда сдвинуты по сравнению со спектром поглощения и его максимумом в сторону больших длин волн (меньших энергий) - правило Стокса-Ломмеля | Часть поглощённой энергии теряется за счёт колебательной релаксации при столкновении с другими молекулами, кроме того, растворитель стабилизирует возбуждённое состояние и уменьшает его энергию |
| Для многих веществ нормированные спектры поглощения (только самая длинноволновая полоса) и флуоресценции, изображённые в функции частот или волновых чисел, симметричны относительно прямой, проходящей перпендикулярной оси абсцисс через точку пересечения этих спектров (правило В.Л. Лёвшина) | Поглощение (самая длинноволновая полоса) и испускание вызваны одними и теми же переходами (S 0 S 1 для флуоресценции) |
Квантовый выход (обозначение В кв, Q, f) - отношение числа испускаемых фотонов к числу поглощаемых
Энергетический выход (В эн) - отношение энергии излучаемого света к энергии поглощаемого


Между В кв и В эн существует следующая взаимосвязь
Поскольку обычно n исп < n погл, то В эн < В кв
Квантовый выход люминесценции не зависит от l возб вплоть до некоторой l, находящейся в области наложения спектров поглощения и испускания, после чего резко уменьшается.Энергетический выход зависит от l возб: вначале он увеличивается прямо пропорционально l возб, затем на некотором интервале не изменяет своей величины, после чего резко уменьшается (закон Вавилова ).
Влияние различных факторов на интенсивность флуоресценции растворов
Люминесценция и, в частности, флуоресценция в гораздо большей степени подвержена влиянию различных факторов, чем поглощение света. Интенсивность флуоресценции зависит от:
· природы вещества ;
· концентрации вещества в растворе ;
· условий, в которых находится флуоресцирующее вещество (температура, растворитель, рН, наличие в растворе других веществ, способных влиять на флуоресценцию).
Природа вещества
Неорганические соединения (за исключением некоторых соединений урана, лантанидов) обычно не способны флуоресцировать в растворе. В то же время среди органических соединений флуоресцирующих веществ достаточно много.
Необходимым (но не достаточным!) условием для фотолюминесценции является способность вещества поглощать электромагнитное излучение УФ- или видимого диапазона . Обычно вещества, обладающие интенсивной флуоресценцией, имеют длинную систему сопряжённых связей. Наиболее часто флуоресцирующие вещества встречаются среди ароматических соединений. Введение в бензольное кольцо электронодонорных заместителей увеличивает способность вещества флуоресцировать . Например, многие фенолы и ароматические амины обладают интенсивной флуоресценцией. Введение электроноакцепторных заместителей , за некоторым исключением, уменьшает флуоресценцию . Атомы тяжёлых галогенов (Br, I) увеличивают скорость интеркомбинационной конверсии и, тем самым, уменьшают квантовый выход флуоресценции . Однако введение тяжёлых галогенов увеличивает способность вещества фосфоресцировать. Способность вещества к флуоресценции в растворе увеличивается при конденсации ароматических колец и увеличении «жёсткости» молекулы . Например

Концентрация вещества
Зависимость между интенсивностью флуоресценции и концентрацией флуоресцирующего вещества в растворе более сложная, чем между поглощением света и концентрацией. Это связано с тем, что процесс излучения является вторичным и зависит от предшествующего ему процесса поглощения света.
Рассмотрим простейший случай, когда в растворе находится только одно флуоресцирующее вещество.
Таким образом:
Следовательно, зависимость между интенсивностью флуоресценции и концентрацией флуоресцирующего вещества не является линейной.
Функцию можно разложить в ряд Маклорена
Если произведение (оптическая плотность раствора) невелико, то и тогда
Таким образом, при малых значениях оптической плотности (при l возб) зависимость интенсивности флуоресценции от концентрации можно считать линейной , что и используется в количественном анализе. При более высоких значениях A зависимость интенсивности флуоресценции от концентрации становится более сложной и отклоняется от линейной. При A = 0,01 отклонение от линейности составляет 1%, 0,05 - 5%; 0,5 - около 35% (рис. 21.4).

Рис. 21.4. Зависимость между интенсивностью флуоресценции и оптической плотностью раствора
1) рассчитанная по упрощённой формуле I = KC; 2) реальная
Влияние оптической плотности раствора на интенсивность флуоресценции называется «эффектом внутреннего фильтра ». Этот эффект обусловлен двумя причинами:
· поглощением возбуждающего света , вследствие чего частицы, находящиеся дальше от источника излучения, будут получать меньше возбуждающего излучения;
· поглощением одними частицами вещества излучения , испускаемого другими частицами этого же вещества.
Люминесценция. Спектры люминесценции. Виды люминесценции. Закон Стокса для фотолюминесценции. Хемилюминесценция. Люминесцентная микроскопия.
Люминесценцией называют избыточное над тепловым излучение тела, имеющее длительность, значительно превышающую период (~10 -15 с) излучаемых световых волн.
Первая часть определения отделяет люминесценцию от равновесного теплового излучения. Люминесценция обычно наблюдается в видимой или ультрафиолетовых областях спектра. Тепловое излучение в этой области возникает только при температуре в несколько сотен или тысяч градусов, тогда как люминесценция наблюдается при любых температурах, поэтому люминесценцию часто называют холодным свечение.
Признак длительности в этом определении был предложен С. И. Вавиловым для того, чтобы отличить люминесценцию от некоторых других явлений вторичного свечения, например отражения или рассеяния света.
Люминесцируют электронно-возбужденные молекулы (атомы). В зависимости от способа возбуждения различают несколько типов люминесценции.
Люминесценция, вызванная заряженными частицами: ионами – ионолюминесценция, электронами – катодолюминесценция, ядерным излучением – радиолюминесценция. Люминесценцию под воздействием рентгеновского и Y(гамма)-излучения называют рентгенолюминесценцией, фотонов видимого света – фотолюминесценция. При растирании, раздавливании или раскалывании некоторых кристаллов возникает триболюминесценция. Электрическим полем возбуждается электролюминесценция, частным случаем которой является свечение газового разряда. Люминесценцию, сопровождающую экзотермическую химическую реакцию, называют хемилюминесценцией.
Спектры Люминесценции
Спектром люминесценции называют зависимость интенсивности люминесцентного излучения от длины волны испускаемого света. Наиболее простые - атомные спектры, в которых указанная выше зависимость определяется только электронным строением атома. Спектры молекул гораздо более сложные вследствие того, что в молекуле реализуются различные деформационные и валентные колебания. При охлаждении до сверхнизких температур сплошные спектры люминесценции органических соединений, растворенных в определенном растворителе, превращаются в квазилинейчатые. Это явление получило название эффекта Шпольского. Это ведёт к снижению предела обнаружения и повышению избирательности определений, расширению числа элементов, которые можно определять люминесцентным методом анализа.
Фотолюминесценцией называется излучение электромагнитной энергии, возбуждаемое в веществе под действием оптического излучения ультрафиолетового или видимого диапазонов, избыточное по сравнению с тепловым излучением, при условии, что такое избыточное излучение имеет длительность, превышающую период электромагнитных колебаний (люминесценция) и время релаксационных процессов. Если облучить вещество (люминофор) в любом агрегатном состоянии ультрафиолетовым или видимым электромагнитным излучением, то возможно появление задержанного не менее, чем на 10-12 - 10-10 с, люминесцентного излучения. Максимум спектра этого излучения сдвинут относительно максимума спектра возбуждающего излучения в сторону меньших частот (закон Стокса - Ломмеля).
Хемилюминесценция - люминесценция (свечение) тел, вызванная химическим воздействием или при протекании химической реакции.Хемилюминесценция связана с экзотермическими химическими процессами.
Хемилюминесценция применяется для оценки состава сложных газовых смесей, в частности, наличия примесей в атмосфере. Достоинством этого метода является легкость автоматизации измерения и высокая селективность. Недостаток - ограниченный перечень анализируемых веществ.
Люминесцентная микроскопия – метод микроскопии, позволяющий наблюдать первичную или вторичную люминесценцию микроорганизмов, клеток, тканей или отдельных структур, входящих в их состав.
Цвет люминесценции, т.е. длина волны излучаемого света зависит от химической структуры и от физико–химического состояния микроскопируемого объекта, что и обусловливает возможность использования л.м. в целях микробиологической и цитологической диагностики, для дифференцирования отдельных компонентов клеток.
Люминесцентный микроскоп снабжен мощным источником освещения с большой поверхностной яркостью, максимум излучения которого находится в коротковолновой области видимого спектра, системой светофильтров, а также интерференционной светоделительной пластинкой, применяемой при возбуждении люминесценции падающим светом.
Источниками освещения для люминесцентного микроскопа чаще являются ртутно-кварцевые лампы сверхвысокого давления, а также лампы накаливания: ксеноновые и кварцево-галогенные.
Для возбуждения люминесценции при люминесцентной микроскопии обычно используют длинноволновую ультрафиолетовую, сине-фиолетовую, а иногда и зелёную область спектра, в люминесцентном микроскопе применяют обычно стеклянную оптику и обычные предметные и покровные стёкла, пропускающие излучение в этой части спектра и не обладающие собственной люминесценцией. Иммерсионные и заключающие среды также должны соответствовать этим требованиям.
Основными преимуществами Люминесцентной микроскопии являются высокая чувствительность (чувствительнее обычных цито- и гистохим. методов не менее чем в 1000 раз), легкость количественного измерения содержания различных хим. компонентов ткани и клеток, доступность аппаратуры. Для Л. м. органов и тканей используют первичную и вторичную люминесценцию.
Спектрофотометрия. Спектрофлуориметрия.
Спектрофотометрия - физико-химический метод исследования растворов и твёрдых веществ, основанный на изучении спектров поглощения в ультрафиолетовой (200-400 нм), видимой (400-760 нм) и инфракрасной (>760 нм) областях спектра. Основная зависимость, изучаемая в спектрофотометрии зависимость интенсивности поглощения падающего света от длины волны. Спектрофотометрия применяется при изучении строения и состава различных соединений, для качественного и количественного определения веществ (определения следов элементов в металлах, сплавах, технических объектах). Приборы спектрофотометрии - спектрофотометры.
Спектрофлуориметрия . Принцип - испускание света, длина волны которого больше чем длина волны поглощенного света. . Применение - количественный анализ, кинетика, качественный анализ.
Лазер. Распределение Больцмана. Понятия инверсной заселённости, вынужденного излучения. Рабочее вещество лазера. Виды источников энергетической накачки. Основные компоненты конструкции лазера. Особенности лазерного излучения.
Лазер – квантовый генератор видимого диапазона излучения.
Виды рабочего вещества лазера: газовые, жидкостные, полупроводниковые и твердотельные.
Виды источников энергетической накачки: возбуждение очень интенсивным светом – « оптическая накачка», электрическим газовым разрядом, в полупроводниковых лазерах – электрическим током.
Распределение Больцмана
Распределение частиц по потенциальным энергиям в силовых полях – гравитационном, электрическом и др. – называют распределение Больцмана.
Применительно к гравитационному полю это распределение может быть записано в виде зависимости концентрации n молекул от высоты h над уровнем Земли или от потенциальной энергии молекулы m 0 gh:
Это выражение справедливо для частиц идеального газа.
Основными компонентами конструкции лазерной установки являются активная среда лазера, лазерная энергия накачки, высокий отражатель, прибор сцепки и лазерный луч. Активная среда лазера расположена в рефлексивной оптической впадине, куда направляется энергия накачки. Активная среда лазера – это материал, обладающий определенными свойствами, которые позволяют усиливать свет стимулируемой эмиссией. В своей самой простой форме эта впадина активной среды состоит из двух зеркал (одно из которых прозрачно), расположенных таким образом, что свет прыгает назад-вперед, каждый раз проходя через активную среду.
Свет, проходя через активную среду, неоднократно усиливается, выходя пучком лучей со стороны прозрачного зеркала. Энергия накачки лазера, как правило, поставляется как электрический ток или как свет волнами различной длины. Такой свет может быть обеспечен лампой или другим лазером. Большинство практических лазеров содержит дополнительные элементы, которые отвечают за такие свойства, как длина волны излучаемого света или форма луча.
Лазерное излучение уникально благодаря трем только ему присущим свойствам.
1) Когерентность. В физике существует 2 типа когерентности - пространственная и временная. Пространственная когерентность выражается в однотипности волнового фронта, т. е. пики и спады волн располагаются параллельно, когда свет выходит из лазера. Это обеспечивает синхронизацию фаз и фокусировку на очень маленькие участки.
2) Монохромность (временная когерентность). Это означает, что световые волны имеют одинаковую длину. Некоторые лазеры испускают лучи разной длины волны. Но явление это предсказуемо, и лазеры излучают свет только той длины, которая предусмотрена используемой в лазере средой.
3) Коллимация . Это означает, что все лучи, испускаемые лазером, параллельны и не рассеиваются с расстоянием.
51. Виды радиоактивных излучений. Радиоактивность. Закон радиоактивного распада. Радиоактивность-явление самопроизвольного превращения одних атомных ядер в другие, сопровождающееся испусканием различных видов ионизирующих излучений.
Основные типы радиоактивного распада:
А льфа-распад состоит в самопроизвольном превращении одно ядра в другое с испусканием α-частиц.
Пример альфа-распада для изотопа 238 U
Бета-распад заключается во внеядерном взаимном превращении нейтрона и протона.
 Закон радиоактивного распада: число радиоактивных ядер, которые ещ не распались, убывает со временем по экспоненциальному закону:
Закон радиоактивного распада: число радиоактивных ядер, которые ещ не распались, убывает со временем по экспоненциальному закону:
52.Ионизирующим излучением называется любое излучение, взаимодействие которого с веществом приводит к образованию ионов разных знаков.
Взаимодействие с веществом α– излучения
α-частицы сильно взаимодействуют с различными веществами, т. е. легко поглощаются ими. Тонкий лист бумаги или слой воздуха толщиной несколько сантиметров достаточны для того, чтобы полностью поглотить α-частицы.
При прохождении через вещество a-частицы почти полностью отдают свою энергию в результате электростатического взаимодействия с электронами оболочек атомов.
Энергия α-частиц идет на ионизацию и возбуждение атомов поглощающей среды (ионизационные потери). Этот процесс может рассматриваться как упругое столкновение α-частицы с электронами, при котором a-частица теряет часть своей энергии.
Взаимодействие с веществом β- излучения
β-частицы - это электроны (или позитроны), испускаемые ядрами радонуклидов при β-распаде.
Вероятность взаимодействия β-частиц с веществом меньше, чем для α-частиц, так как β-частицы имеют в два раза меньший заряд и приблизительно в 7300 раз меньшую массу.
Взаимодействие электронов и позитронов с веществом качественно одинаково и складывается из трех основных процессов:
упругого рассеяния на атомных ядрах;
рассеяния на орбитальных электронах;
неупругих столкновений с атомным ядром.
В случае применения тяжелых материалов возникает тормозное (вторичное) излучение , которое является рентгеновским и обладает большой проникающей способностью.
Статистика.
1.Случайное событие – это событие, которое при данных условиях может произойти, либо не произойти. Относительная частота событий называется вероятностью и показывает отношение числа ожидаемых событий к числу возможных.Статистическое определение вероятности подразумевает под собой вероятность как предел, к которому стремится относительная частота. При классическом определении отн. частота и вероятность совпадают. В этом случае должно быть известно должны быть известны полное число возможных событий и число ожидаемых событий (орёл-решка, кубики и тп).Совместные события могут происходить параллельно друг другу; несовместные события исключают появление друг друга в ходе проводимого опыта. Зависимым называется событие, на вероятность которого оказывает влияние исход какого-либо иного события. Независимые наоборот.
2.Теорема сложение вероятностей : вероятность появление какого-либо события из нескольких несовместных равна сумме их вероятностей (или то, или другое)Теорема умножения вероятностей : Вероятность совместного появления независимых событий равна произведению их вероятностей(и то и другое).Условная вероятность - вероятность одного события при условии, что другое событие уже произошло(опыт с шариками в мешке, которые вытаскивают и не возвращают)
3. Дискретные. Соотношение между возможными значениями случайной величины и их вероятностями называется законом распределения дискретной случайной величины(возможные значения которой образуют конечную или бесконечную последовательность чисел). Закон распределения может быть задан аналитически, в виде таблицы или графически. Математическое ожидание Дисперсия
4. Непрерывные случайные величины всегда имеют вероятность равную нулю, поскольку количество её возможных численных значений бесконечно велико.Математическое ожидание имеет смысл среднего значения случайной величины. Для дискретных случ. величин оно определяется как сумма произведений случ. величины на вероятность её появления. Дисперсия описывает разброс случ. величин относительно математического ожидания. Дисперсия дискретных случ. величин определяется, как сумма квадратов разности случ. величин и математического ожидания на соответствующие вероятности появления этих случайных величин.Среднее квадратичное отклонение - это квадратный корень из среднего арифметического всех квадратов разностей между данными величинами и их средним арифметическим.
5. Случайная величина называется дискретной случайной величиной , если она принимает не более чем счетное число значений. Примеры :
1) дискретная случайная величина Бернулли(закон распределения Бернулли). Закон распределения дискретной случайной величины Бернулли имеет следующий вид: 0 Такому распределению соответствует бросание монеты, на одной стороне которой - 0, а на второй - 1. 2) дискретная биномиальная случайная величина (биномиальное распределение). Закон распределения данной дискретной случайной величины запишется следующим образом: Число успехов в n испытаниях схемы Бернулли имеет биномиальное распределение. 3) дискретная случайная величина Пуассона(пуассоновское распределение с параметром). Закон распределения дискретной случайной величины Пуассона задается следующим образом: Где - параметр. Закон распределения случайной величины Пуассона носит название закона редких событий, например, число вызовов, поступивших на телефонную станцию, число распавшихся нестабильных частиц и т.д. 4) дискретная геометрическая случайная величина (геометрическое распределение). Закон распределения геометрической дискретной случайной величины имеет вид Пусть производятся независимые испытания, причем в каждом испытании возможны два исхода - "успех" с вероятностью p или "неуспех" с вероятностью 1 - p , 0 < p < 1 . Обозначим через число испытаний до первого появления "успеха", тогда будет дискретной геометрической случайной величиной. Распределение случайной величины называется непрерывным
, а сама случайная величина - непрерывной случайной величиной, если для любого Примеры
1) нормальная непрерывная случайная величина, или непрерывная случайная величина Гаусса(нормальное распределение).Важная роль этого распределения объясняется тем, что оно обычно возникает в явлениях, подверженных действию большого числа малых случайных величин. Так, математическая теория выборочного метода в статистике для расчета некоторых показателей широко использует нормальное распределение. 2)экспоненциальная (показательная) непрерывная случайная величина(экспоненциальное распределение).Экспоненциальному распределению подчиняется время распада ядер атомов различных элементов. Оно обладает важным свойством - отсутствием последствия. Несложно убедиться в том, что вероятность распада ядра за время при условии, что перед этим оно уже прожило время, совпадает с безусловной вероятностью распада того же самого ядра за время. Именно это свойство и представляет собой отсутствие последствия. 3) Равномерная на непрерывная случайная величина(равномерное на отрезке распределение).Равномерное распределение реализует принцип геометрической вероятности при бросании точки на отрезок . Закон Бернулли
: число ожидаемых событий, появляющихся в опытах с n независимыми испытаниями, в которых ожидаемые события характеризуются одинаковой вероятностью p или: Математическое ожидание Пусть - случайная величина, определённая на некотором вероятностном пространстве. Тогда где символ M обозначает математическое ожидание. 6. смотри билет 5 Закон распределения Пуассона:
удовлетворяет вероятности появления заданного количества редко происходящих случайных событий, наблюдаемых в серии из большого количества независимых повторных опытов. Вероятность намного меньше 1. Где m-число ожидаемых событий, а- параметр распределения, совпадающий с математическим ожиданием, е-основание натурального логарифма. Распределению Пуассона удовлетворяют числа редких событий, происходящих за определённый промежуток времени. 7. Непрерывные и дискретные случайные величины. Плотность вероятности. Нормальный закон распределения. Математическое ожидание и дисперсия. Графическое представление. Примеры
. Дискретные случайные величины – величины, которые могут принимать счетное количество значений конечное или бесконечное. Непрерывные случайные величины- величины. Которые принимают бесконечное число возможных значений в конечном, или в бесконечном интервалах изменения Плотностью вероятности f(x) непрерывной случайной величины Х называется производная функции распределения F(X) этой величины: f(x)=F’(X) Основные свойства плотности: 3).определенный интеграл в пределах от минус бесконечности до плюс бесконечности от плоности вероятности непрерывной случайной величины равен единице.. 4)определенный интеграл в пределах от «–« бесконечности до х от плотности вероятности непрерывной случайной величины равен функции распределения этой величины. где параметр μ
σ
² - дисперсия. 8. Стандартное нормальное распределение. Стандартные интервалы. Понятия доверительного интервала и доверительной вероятности
. Доверительный интервал - это интервал, построенный с помощью случайной выборки из распределения с неизвестным параметром, такой, что он содержит данный параметр с заданной вероятностью. Пусть - выборка из некоторого распределения с плотностью , зависящей от параметра , который может изменяться в интервале . Пусть - некоторая статистика и - функция распределения случайной величины выполняются с вероятностью , близкой к единице. Перепишем неравенства (1) в другом виде: (2) Обозначим , и запишем (2) в следующем виде: Интервал называется доверительным интервалом для параметра
, а вероятность - доверительной вероятностью
. Нормальное распределение, также называемое распределением Гаусса - распределение вероятностей, которое задается функцией плотности распределения: где параметр μ
- среднее значение (математическое ожидание) случайной величины и указывает координату максимума кривой плотности распределения, а σ
² - дисперсия. Графики нормального распределения 9.
Понятие генеральной совокупности и выборки. Объём выборки, репрезентативость. Статистическое распределение (вариационный ряд). Примеры. Характеристики выборки.
Генеральная совокупность – множество каких-либо однородных элементов, которые предстоит изучить статистическими методами; множество всех значений случайной величины, а варианта – одно из значений генеральной совокупности. Выборка – это некоторая часть элементов, выделяемая по определенному правилу из ген. совокупности. Объём выборки – это число выделяемых элементов в генеральной совокупности. Минимальным, статистическим допустимым объёмом выборки, считается три элемента. Выборка производится с целью описания генеральной совокупности. Если это описание является полным и корректным, то выборка является репрезентативной. Результаты повторных измерений какой-либо физической величины х, проводимых в одинаковых условиях, часто называют выборкой из бесконечной генеральной совокупности, поскольку считается, что в опыте теоретически возможно произвести сколь угодно большое число измерений при одинаковых условиях, а множество всех возможных результатов измерений и образуют данную генеральную совокупность. Математическое ожидание такой генеральной совокупности считается истинным значением измеряемой величины.Таким образом, в ходе нескольких повторных измерений физической величины получают набор результатов, являющийся выборкой объёма n:х 1 , х 2 ,…..,х n , где n-число повторных измерений.Как дискретные, так и непрерывные, случайные величины могут быть получены в результате опыта – наблюдения – то есть в виде вариационнго ряда: 4,67; 5,49; 5351 и так далее. Однако такой способ задания является малоинформативным – требующим дополнительной обработки, для какого-либо даже поверхностного представления о случайной величине. К выборочным характеристикам отнтсятся: · среднее значение (Х ср), как оценка математического ожидания · выборочное среднеквадратическое отклонение (S x), как оценка генерального значения среднеквадратического отклонения (σ) выборочная дисперсия (S x 2) N- число элементов выборки № 10 Точечные оценки параметров генеральной совокупности.
Пусть выборка объема n
представлена в виде вариационного ряда. Назовем выборочной средней
величину Величина называется относительной частотой
значения признака x i
. Если значения признака, полученные из выборки не группировать и не представлять в виде вариационного ряда, то для вычисления выборочной средней нужно пользоваться формулой . Выборочную дисперсию Приведем еще один пример точечной оценки. Пусть каждый объект генеральной совокупности характеризуется двумя количественными признаками x
и y
. Например, деталь может иметь два размера – длину и ширину. Можно в различных районах измерять концентрацию вредных веществ в воздухе и фиксировать количество легочных заболеваний населения в месяц. Можно через равные промежутки времени сопоставлять доходность акций данной корпорации с каким-либо индексом, характеризующим среднюю доходность всего рынка акций. В этом случае генеральная совокупность представляет собой двумерную случайную величину x,h.
Эта случайная величина принимает значения x
, y
на множестве объектов генеральной совокупности. Не зная закона совместного распределения случайных величин x иh, мы не можем говорить о наличии или глубине корреляционной связи между ними, однако некоторые выводы можно сделать, используя выборочный метод. Выборку объема n
в этом случае представим в виде таблицы, где Выборочный коэффициент корреляции рассчитывается по формуле Выборочный коэффициент корреляции можно рассматривать как точечную оценку коэффициента корреляции r x h , характеризующего генеральную совокупность. Выборочные параметры или любые другие зависят от того, какие объекты генеральной совокупности попали в выборку и различаются от выборки к выборке. Поэтому они сами являются случайными величинами. Пусть выборочный параметр dрассматривается как выборочная оценка параметра D генеральной совокупности и при этом выполняется равенство M
d =
D.
Такая выборочная оценка называется несмещенной.
Для доказательства несмещённости некоторых точечных оценок будем рассматривать выборку объема n
как систему n
независимых случайных величин x 1 ,x 2 ,... x n
, каждая из которых имеет тот же закон распределения с теми же параметрами, что и случайная величина x
, представляющая генеральную совокупность. При таком подходе становятся очевидными равенства: Mx i
= M
x i
=M
x; Интервальные оценки.
Точечные оценки параметров генеральной совокупности могут быть приняты в качестве ориентировочных, первоначальных результатов обработки выборочных данных. Их недостаток заключается в том, что неизвестно, с какой точностью оценивается параметр. Если для выборок большого объема точность обычно бывает достаточной (при условии несмещенности, эффективности и состоятельности оценок), то для выборок небольшого объема вопрос точности оценок становится очень важным. Введем понятие интервальной оценки неизвестного параметра генеральной совокупности (или случайной величины x
, определенной на множестве объектов этой генеральной совокупности). Обозначим этот параметр черезD
. По сделанной выборке по определенным правилам найдем числа D
1 и D
2 , так чтобы выполнялось условие: P
(D
1 <D
<D
2) =P
(D
Î(D
1 ; D
2)) = g Числа D
1 и D
2 называются доверительными границами
, интервал (D
1 , D
2) - доверительным интервалом
для параметра D
. Число g называется доверительной вероятностью
или надежностью
сделанной оценки. Сначала задается надежность. Обычно ее выбирают равной 0,95, 0,99 или 0,999. Тогда вероятность того, что интересующий нас параметр попал в интервал (D
1 , D
2) достаточно высока. Число (D
1 + D
2) / 2 – середина доверительного интервала – будет давать значение параметра D
с точностью
(D
2 – D
1) / 2, которая представляет собой половину длины доверительного интервала. Границы D
1 и D
2 определяются из выборочных данных и являются функциями от случайных величин x
1 , x
2 ,...,x n
, а следовательно – сами случайные величины. Отсюда – доверительный интервал (D
1 , D
2) тоже случаен. Он может покрывать параметр D
или нет. Именно в таком смысле нужно понимать случайное событие, заключающееся в том, что доверительный интервал покрывает число D.
11. Графические характеристики случайных величин. Гистограмма. Характеристики положения (мода, медиана, выборочная средняя).
Люминесценция: основные понятия ■ Упоминание о люминесценции датируется XV веком, когда было описано свечение неорганических кристаллов. Возникновение люминесценции многие связывают с моментом выхода работы Давида Брустера, который в 1833 году описал красную флуоресценцию хлорофилла. ■ The Hound of the Baskervilles (Конан Дойл Артур). Src="https://present5.com/presentation/37574361_76674408/image-5.jpg" alt="Классификация видов люминесценции n По длительности свечения: флуоресценция (~10 -8 c), фосфоресценция (>10 -6">
Классификация видов люминесценции n По длительности свечения: флуоресценция (~10 -8 c), фосфоресценция (>10 -6 с). n По способу возбуждения (таблица). n По механизму свечения: свечение дискретных центров – поглощающими и излучающими центрами являются одни и те же частицы (атомы, молекулы, ионы); рекомбинационное свечение – процессы поглощения и излучения разделены во времени и в пространстве. В процессе возбуждения происходит разделение частицы вещества на две противоположно заряженные части. Последующая их рекомбинация сопровождается выделением энергии. Люминесценция - это излучение света определенными материалами в относительно холодном состоянии. Она отличается от излучения раскаленных тел, например или угля, расплавленного железа и проволоки, нагреваемой электрическим током. Излучение люминесценции наблюдается: Во всех этих явлениях световое излучение не является результатом нагревания материала выше комнатной температуры, поэтому его называют холодным светом. Практическая ценность люминесцентных материалов заключается в их способности трансформировать невидимые формы энергии в Явление люминесценции происходит в результате поглощения материалом энергии, например, от источника ультрафиолетового или рентгеновского излучения, пучков электронов, химических реакций и т. д. Это приводит атомы вещества в возбужденное состояние. Так как оно неустойчиво, материал возвращается в свое исходное состояние, а поглощенная энергия выделяется в виде света и/или тепла. В процессе задействованы только внешние электроны. Эффективность люминесценции зависит от степени превращения энергии возбуждения в свет. Число материалов, обладающих достаточной для практического применения эффективностью, относительно небольшое. Возбуждение люминесценции не связано с возбуждением атомов. Когда горячие материалы начинают светиться в результате накаливания, их атомы находятся в возбужденном состоянии. Хотя они вибрируют уже при комнатной температуре, этого достаточно, чтобы излучение происходило в дальней инфракрасной области спектра. С повышением температуры частота электромагнитного излучения смещается в видимую область. С другой стороны, при очень высоких температурах, которые создаются, например, в ударных трубах, столкновения атомов могут быть настолько сильными, что электроны отделяются от них и рекомбинируют, испуская свет. В этом случае люминесценция и накаливание становятся неразличимыми. Обычные пигменты и красители обладают цветом, так как они отражают ту часть спектра, которая комплементарна поглощенной. Небольшая часть энергии преобразуется в тепло, но заметного излучения не происходит. Если, однако, люминесцентный пигмент поглощает дневной свет на определенном участке спектра, он может излучать фотоны, отличающиеся от отраженных. Это происходит в результате процессов внутри молекулы красителя или пигмента, благодаря которым ультрафиолет может быть преобразован в видимый, например, синий свет. Такие методы люминесценции используются в наружной рекламе и в стиральных порошках. В последнем случае «осветлитель» остается в ткани не только для отражения белого, но и для преобразования ультрафиолетового излучения в синий цвет, компенсирующий желтизну и усиливающий белизну. Хотя молнии, северное сияние и тусклое свечение светлячков и грибов всегда были известны человечеству, первые исследования люминесценции начались с синтетического материала, когда Винченцо Каскариоло, алхимик и сапожник из Болоньи (Италия), в 1603 г. нагрел смесь сульфата бария (в виде барита, тяжелого шпата) с углем. Порошок, полученный после охлаждения, ночью испускал голубоватое свечение, и Каскариоло заметил, что оно может быть восстановлено путем воздействия на порошок солнечного света. Вещество было названо «ляпис солярис», или солнечный камень, потому что алхимики надеялись, что оно способно превращать металлы в золото, символом которого является солнце. Послесвечение вызвало интерес многих ученых того периода, дававших материалу и другие названия, в том числе «фосфор», что означает «носитель света». Сегодня название «фосфор» используется только для химического элемента, в то время как микрокристаллические люминесцирующие материалы называются люминофором. «Фосфор» Каскариоло, по-видимому, был сульфидом бария. Первым коммерчески доступным люминофором (1870 г.) стала «краска Бальмена» - раствор сульфида кальция. В 1866 году был описан первый стабильный люминофор из сульфида цинка - один из важнейших в современной технике. Одно из первых научных исследований люминесценции, проявляющейся при гниении древесины или плоти и в светлячках, было выполнено в 1672 году английским ученым Робертом Бойлем, который, хотя и не знал о биохимическом происхождении этого света, тем не менее установил некоторые из основных свойств биолюминесцентных систем: В 1885-1887 годах было замечено, что неочищенные экстракты, полученные из вест-индийских светлячков (огненосных щелкунов) и из моллюсков фолад, при смешивании производят свет. Первыми эффективными хемилюминесцентными материалами были небиологические синтетические соединения, такие как люминола, открытая в 1928 году. Большая часть энергии, выделяющейся в химических реакциях, особенно реакциях окисления, имеет форму тепла. В некоторых реакциях, однако, ее часть используется для возбуждения электронов до более высоких уровней, а во флуоресцентных молекулах до возникновения хемилюминесценции (ХЛ). Исследования показывают, что ХЛ является универсальным явлением, хотя интенсивность люминесценции бывает настолько мала, что требуется использование чувствительных детекторов. Есть, однако, некоторые соединения, которые демонстрируют яркую ХЛ. Наиболее известным из них является люминол, который при окислении пероксидом водорода может давать сильный синий или сине-зеленый свет. Другие сильные ХЛ-вещества - люцигенин и лофин. Несмотря на яркость их ХЛ, не все они эффективны при преобразовании химической энергии в световую, т. к. менее 1 % молекул излучают свет. В 1960-е годы было обнаружено, что сложные эфиры щавелевой кислоты, окисленные в безводных растворителях в присутствии сильно флуоресцирующих ароматических соединений, излучают яркий свет с эффективностью до 23 %. Биолюминесценция представляет собой особый тип ХЛ, катализируемой ферментами. Выход люминесценции таких реакций может достигать 100 %, что означает, что каждая молекула реагирующего люциферина переходит в излучающее состояние. Все известные сегодня биолюминесцентные реакции катализируются реакциями окисления, протекающими в присутствии воздуха. Термолюминесценция означает не температурное излучение, но усиление светового излучения материалов, электроны которых возбуждены под действием тепла. Термостимулированная люминесценция наблюдается у некоторых минералов и прежде всего у кристаллофосфоров после того, как они были возбуждены светом. Фотолюминесценция, которая возникает под действием электромагнитного излучения, падающего на вещество, может производиться в диапазоне от видимого света через ультрафиолетовый до рентгеновского и гамма-излучения. В люминесценции, вызванной фотонами, длина волны излучаемого света, как правило, равна или больше длины волны возбуждающего (т. е. равной или меньшей энергии). Эта разница в длине волны обусловлена преобразованием поступающей энергии в колебания атомов или ионов. Иногда, при интенсивном воздействии лучом лазера, испускаемый свет может иметь более короткую длину волны. Тот факт, что ФЛ может возбуждаться под действием ультрафиолетового излучения, был обнаружен немецким физиком Иоганном Риттером в 1801 г. Он заметил, что люминофоры ярко светятся в невидимой области за фиолетовой частью спектра, и таким образом открыл УФ-излучение. Превращение УФ в видимый свет имеет большое практическое значение. При высоком давлении частота увеличивается. Спектры больше не состоят из одной спектральной линии 254 нм, а энергия излучения распределена по спектральным линиям, соответствующим различным электронным уровням: 303, 313, 334, 366, 405, 436, 546 и 578 нм. Ртутные лампы высокого давления используют для освещения, так как 405-546 нм соответствуют видимому голубовато-зеленому свету, а при трансформации части излучения в красный свет с помощью люминофора в итоге получается белый. Когда молекулы газа возбуждаются, их спектры люминесценции показывают широкие полосы; не только электроны поднимаются на уровни более высокой энергии, но одновременно возбуждаются колебательные и вращательные движения атомов в целом. Это происходит потому, что колебательные и вращательные энергии молекул составляют 10 -2 и 10 -4 от энергий переходов, которые, складываясь, образуют множество немного отличающихся длин волн, составляющих одну полосу. В более крупных молекулах есть несколько перекрывающих друг друга полос, по одной для каждого вида перехода. Излучение молекул в растворе преимущественно лентовидное, что вызвано взаимодействием относительно большого числа возбужденных молекул с молекулами растворителя. В молекулах, как и в атомах, в люминесценции участвуют внешние электроны молекулярных орбиталей. Эти термины можно различать не только на основании длительности свечения, но и по способу его производства. Когда электрон возбуждается до синглетного состояния со сроком пребывания в нем 10 -8 с, из которого он может легко вернуться в основное, вещество излучает свою энергию в виде флуоресценции. Во время перехода спин не изменяется. Базовое и возбужденное состояния имеют подобную кратность. Электрон, однако, можно поднять на более высокий энергетический уровень (называемый "возбужденное триплетное состояние") с обращением его спина. В квантовой механике переходы из триплетных состояний в синглетные запрещены, и, следовательно, время их жизни значительно больше. Поэтому люминесценция в этом случае имеет гораздо более длительный срок: наблюдается фосфоресценция.![]() где - интегрируемая по Лебегу функция. Функция называется плотностью распределения случайной величины.
где - интегрируемая по Лебегу функция. Функция называется плотностью распределения случайной величины.![]()
![]()
пример: количество пассажиров в транспорте.
пример: время, масса, объем, температура тела.
1). Плотность вероятности является неотрицательной функцией: f(x)>0
2) вероятность того, что в результате испытания непрерыв. Случ. Величина примет какое-либо значение из интервала(а,b), равна определенному интегралу(в пределах от а до b) от плотности вероятности этой случайной величины. ![]()
![]()
![]() , когда выборка имеет распределение с плотностью
, когда выборка имеет распределение с плотностью ![]() . Предположим, что есть убывающая функция от параметра . Обозначим квантиль распределения , тогда есть возрастающая функция от . Зафиксируем близкое к нулю положительное число (например, 0,05 или 0,01). Пусть . При каждом неравенства
. Предположим, что есть убывающая функция от параметра . Обозначим квантиль распределения , тогда есть возрастающая функция от . Зафиксируем близкое к нулю положительное число (например, 0,05 или 0,01). Пусть . При каждом неравенства![]()
![]()

i
-тый отобранный объект (i
= 1,2,...n
)представлен парой чисел x i
, y i
: x
1
x
2
...
x n
y
1
y
2
...
y n

 ,
,  ,
, .
.
Dx i
= D
x i
s
n
параметра D
генеральной совокупности называетсясостоятельной
, если она сходится по вероятности к D.
Это означает, что для любых положительных чисел e
иg
найдется такое число n e g
, что для всех чисел n
, удовлетворяющих неравенству n > n e g
выполняется условие ![]() . и являются несмещёнными, состоятельными и эффективными оценками величин Mx
и Dx
.
. и являются несмещёнными, состоятельными и эффективными оценками величин Mx
и Dx
.
 Люминесцения: основные понятия ■ Итак, что такое люминесценция? Определение этого понятия довольно сложно и исходит из сопоставления свойств люминесцентного излучения и законов теплового равновесного излучения. Под тепловым излучением понимают электромагнитное излучение, обусловленное возбуждением частиц вещества (атомов, молекул, ионов) вследствие их теплового движения. Чтобы вызвать люминесценцию вещества к нему необходимо подвести извне определенное количество энергии. ■ Люминесценция – это свечение атомов, молекул и других более сложных комплексов, возникающего в результате электронного перехода в этих частицах при их возвращении из возбужденного состояния в нормальное (В. Л. Левшин).
Люминесцения: основные понятия ■ Итак, что такое люминесценция? Определение этого понятия довольно сложно и исходит из сопоставления свойств люминесцентного излучения и законов теплового равновесного излучения. Под тепловым излучением понимают электромагнитное излучение, обусловленное возбуждением частиц вещества (атомов, молекул, ионов) вследствие их теплового движения. Чтобы вызвать люминесценцию вещества к нему необходимо подвести извне определенное количество энергии. ■ Люминесценция – это свечение атомов, молекул и других более сложных комплексов, возникающего в результате электронного перехода в этих частицах при их возвращении из возбужденного состояния в нормальное (В. Л. Левшин). Люминесцения: основные понятия ■ Люминесценция – это излучение (B`v, T), представляющее собой избыток над тепловым излучением (Bv, T) вещества при данной температуре и имеющее длительность (>10 -10 c), значительно превышающую период световых волн (Видеман - Вавилов).
Люминесцения: основные понятия ■ Люминесценция – это излучение (B`v, T), представляющее собой избыток над тепловым излучением (Bv, T) вещества при данной температуре и имеющее длительность (>10 -10 c), значительно превышающую период световых волн (Видеман - Вавилов).


 Основные характеристики люминесценции n Спектры поглощения: A = f(λ); A = f(v); T, % = f(λ); T, % = f(v). n Cпектры люминесценции: I = f(λ); I = f(v). n Спектры возбуждения: зависимости интенсивности люминесценции (I) от частоты (волнового числа) или длины волны возбуждающего света; у частиц, люминесцирующих по типу дискретных центров, спектры возбуждения идентичны спектрам поглощения. n Энергетический выход люминесценции. n Квантовый выход люминесценции. n Время жизни возбужденного люминесцентного центра.
Основные характеристики люминесценции n Спектры поглощения: A = f(λ); A = f(v); T, % = f(λ); T, % = f(v). n Cпектры люминесценции: I = f(λ); I = f(v). n Спектры возбуждения: зависимости интенсивности люминесценции (I) от частоты (волнового числа) или длины волны возбуждающего света; у частиц, люминесцирующих по типу дискретных центров, спектры возбуждения идентичны спектрам поглощения. n Энергетический выход люминесценции. n Квантовый выход люминесценции. n Время жизни возбужденного люминесцентного центра.






 Выход люминесценции n Способность вещества к люминесценции в данной среде характеризуется величиной выхода люминесценции. n Различают абсолютный квантовый и энергетический выходы люминесценции и относительный выход люминесценции. n Абсолютным квантовым выходом люминесценции (φкв) называют отношение числа квантов Nл, излученных веществом, к числу поглощенных квантов возбуждающего света Nп: φкв = Nл / Nп ■ φкв определяется соотношением между вероятностями излучательного (α) и безызлучательного (β): φкв = α / α + β
Выход люминесценции n Способность вещества к люминесценции в данной среде характеризуется величиной выхода люминесценции. n Различают абсолютный квантовый и энергетический выходы люминесценции и относительный выход люминесценции. n Абсолютным квантовым выходом люминесценции (φкв) называют отношение числа квантов Nл, излученных веществом, к числу поглощенных квантов возбуждающего света Nп: φкв = Nл / Nп ■ φкв определяется соотношением между вероятностями излучательного (α) и безызлучательного (β): φкв = α / α + β Выход люминесценции n Абсолютным энергетическим выходом люминесценции (φэн) называют отношение излучаемой веществом энергии Ел к поглощенной энергии возбуждения Еп: φэн = Ел / Еп ■ Абсолютный энергетический и квантовые выходы связаны простым соотношением: φэн = Ел / Еп = Nл hvл / Nп hvп = φкв (vл / vп) или φэн = φкв (λп / λл); φкв = φэн (λл / λп) ■ Измерение абсолютных выходов люминесценции представляет трудную задачу, поэтому на практике чаще измеряют относительный выход люминесценции.
Выход люминесценции n Абсолютным энергетическим выходом люминесценции (φэн) называют отношение излучаемой веществом энергии Ел к поглощенной энергии возбуждения Еп: φэн = Ел / Еп ■ Абсолютный энергетический и квантовые выходы связаны простым соотношением: φэн = Ел / Еп = Nл hvл / Nп hvп = φкв (vл / vп) или φэн = φкв (λп / λл); φкв = φэн (λл / λп) ■ Измерение абсолютных выходов люминесценции представляет трудную задачу, поэтому на практике чаще измеряют относительный выход люминесценции. Время жизни возбужденного люминесцентного центра n В случае люминесцентных дискретных центров число возбужденных центров n после прекращения возбуждения в отсутствии безызлучательных процессов дезактивации будет уменьшаться со временем: -dn/dt = k 1 n, где k 1 – константа скорости мономолекулярного излучательного процесса. ■ Среднее излучательное время жизни (τ0) люминесцентного центра определяется выражением: τ0 = 1/ k 1
Время жизни возбужденного люминесцентного центра n В случае люминесцентных дискретных центров число возбужденных центров n после прекращения возбуждения в отсутствии безызлучательных процессов дезактивации будет уменьшаться со временем: -dn/dt = k 1 n, где k 1 – константа скорости мономолекулярного излучательного процесса. ■ Среднее излучательное время жизни (τ0) люминесцентного центра определяется выражением: τ0 = 1/ k 1 Время жизни возбужденного люминесцентного центра n Для грубых оценок применимо соотношение: 10 -4 τ0 ≈ ---- ε(λmax) n Таким образом, среднее излучательное время жизни возбужденного состояния тем меньше, чем интенсивнее поглощение, приводящее к его возникновению. n Поскольку имеют место безызлучательные процессы, измеряемые времена жизни τ всегда меньше τ0: 1 τ = ------ k 1 + k 2 + k 3
Время жизни возбужденного люминесцентного центра n Для грубых оценок применимо соотношение: 10 -4 τ0 ≈ ---- ε(λmax) n Таким образом, среднее излучательное время жизни возбужденного состояния тем меньше, чем интенсивнее поглощение, приводящее к его возникновению. n Поскольку имеют место безызлучательные процессы, измеряемые времена жизни τ всегда меньше τ0: 1 τ = ------ k 1 + k 2 + k 3 Энергетические переходы в молекуле n При комнатной температуре молекула обычно находится в n n основном S 0 синглетном состоянии. При поглощении энергии молекула оказывается в возбужденном электронном состоянии S 2. Далее практически мгновенно (~10 -12 с) в результате колебательной релаксации (КР) достигается невозбужденный колебательный уровень S 2. Далее также практически мгновенно (~10 -11 с) вследствие внутренней конверсии молекула перейдет в более низкое электронно-возбужденное состояние S 1. Переход S 1 → S 0 с испусканием фотона (10 -6 - 10 -9 с) – флуоресценция.
Энергетические переходы в молекуле n При комнатной температуре молекула обычно находится в n n основном S 0 синглетном состоянии. При поглощении энергии молекула оказывается в возбужденном электронном состоянии S 2. Далее практически мгновенно (~10 -12 с) в результате колебательной релаксации (КР) достигается невозбужденный колебательный уровень S 2. Далее также практически мгновенно (~10 -11 с) вследствие внутренней конверсии молекула перейдет в более низкое электронно-возбужденное состояние S 1. Переход S 1 → S 0 с испусканием фотона (10 -6 - 10 -9 с) – флуоресценция.



 Энергетические переходы в молекуле ■ Безызлучательный переход S 1 → T 1 с изменением спина электрона – интеркомбинационная конверсия. n Переход T 1 → S 0 с испусканием фотона (>10 -4 c) – фосфоресценция.
Энергетические переходы в молекуле ■ Безызлучательный переход S 1 → T 1 с изменением спина электрона – интеркомбинационная конверсия. n Переход T 1 → S 0 с испусканием фотона (>10 -4 c) – фосфоресценция. Замедленная флуоресценция n Помимо флуоресценции и фосфоресценции существует еще один вид люминесценции – замедленная флуоресценция. n Этот вид молекулярной люминесценции наблюдается в весьма ограниченных диапазонах температур, вязкостей и концентраций растворов. n По сравнению с флуоресценцией и фосфоресценцией ее интенсивность невелика и достигает максимальных значений при комнатной и более высоких температурах, заметно ослабевая с понижением температуры. n Различают замедленную флуоресценцию Е – типа.
Замедленная флуоресценция n Помимо флуоресценции и фосфоресценции существует еще один вид люминесценции – замедленная флуоресценция. n Этот вид молекулярной люминесценции наблюдается в весьма ограниченных диапазонах температур, вязкостей и концентраций растворов. n По сравнению с флуоресценцией и фосфоресценцией ее интенсивность невелика и достигает максимальных значений при комнатной и более высоких температурах, заметно ослабевая с понижением температуры. n Различают замедленную флуоресценцию Е – типа. Замедленная флуоресценция Е - типа n Замедленная флуоресценция Е – типа: за счет термической активации молекул в состоянии Т 1 происходит их переход на более высокие колебательные уровни, которые могут перекрываться с колебательными уровнями S 1 и и становится возможным переход Т 1 → S 1.
Замедленная флуоресценция Е - типа n Замедленная флуоресценция Е – типа: за счет термической активации молекул в состоянии Т 1 происходит их переход на более высокие колебательные уровни, которые могут перекрываться с колебательными уровнями S 1 и и становится возможным переход Т 1 → S 1. Замедленная флуоресценция n Замедленная флуоресценция Р - типа (наблюдаемая у молекул пирена и других ароматических соединений): возникает при переносе энергии в результате столкновений
Замедленная флуоресценция n Замедленная флуоресценция Р - типа (наблюдаемая у молекул пирена и других ароматических соединений): возникает при переносе энергии в результате столкновений Диаграмма потенциальной энергии n При рассмотрении люминесценции полезно рассмотрение диаграммы потенциальной энергии. n Ограничимся двумерными диаграммами, относящимися, строго говоря, к случаю двухатомной молекулы.
Диаграмма потенциальной энергии n При рассмотрении люминесценции полезно рассмотрение диаграммы потенциальной энергии. n Ограничимся двумерными диаграммами, относящимися, строго говоря, к случаю двухатомной молекулы. Диаграмма потенциальной энергии n Кривые потенциальной энергии состояний S 1 и T 1 пересекаются в некоторой точке. n В этой точке положение и импульсы атомных ядер одни и те же, т. е. возможен S 1 → T 1 переход. n В сложных многоатомных молекулах многомерные потенциальные поверхности могут пересекаться во многих точках, что увеличивает вероятность ИК. n Принцип Франка – Кондона. Согласно этому принципу электронные переходы являются настолько быстрыми процессами (10 -13 с) по сравнению с движением ядер (10 -12 с), что за время электронного перехода ядра не успевают изменить ни своей скорости ни своего взаимного расположения.
Диаграмма потенциальной энергии n Кривые потенциальной энергии состояний S 1 и T 1 пересекаются в некоторой точке. n В этой точке положение и импульсы атомных ядер одни и те же, т. е. возможен S 1 → T 1 переход. n В сложных многоатомных молекулах многомерные потенциальные поверхности могут пересекаться во многих точках, что увеличивает вероятность ИК. n Принцип Франка – Кондона. Согласно этому принципу электронные переходы являются настолько быстрыми процессами (10 -13 с) по сравнению с движением ядер (10 -12 с), что за время электронного перехода ядра не успевают изменить ни своей скорости ни своего взаимного расположения. Принцип Франка - Кондона n Поэтому прежнее положение ядер будет соответствовать изменившимся в результате электронного перехода силам только в том случае, если молекула будет совершать достаточные колебания. n Так, при электронном возбуждении молекулы прочность связи мгновенно ослабевает, а ядра в первый момент продолжают занимать прежнее близкое друг к другу положение (сжатая молекула). n Такое несоответствие приводит к тому, что молекула начинает совершать колебания. n За короткое время жизни возбужденного состояния (10 -9 с) избыточная колебательная энергия успевает распределиться между многочисленными колебаниями молекулы или передаться окружающей среде.
Принцип Франка - Кондона n Поэтому прежнее положение ядер будет соответствовать изменившимся в результате электронного перехода силам только в том случае, если молекула будет совершать достаточные колебания. n Так, при электронном возбуждении молекулы прочность связи мгновенно ослабевает, а ядра в первый момент продолжают занимать прежнее близкое друг к другу положение (сжатая молекула). n Такое несоответствие приводит к тому, что молекула начинает совершать колебания. n За короткое время жизни возбужденного состояния (10 -9 с) избыточная колебательная энергия успевает распределиться между многочисленными колебаниями молекулы или передаться окружающей среде. Принцип Франка - Кондона n В результате молекула из неравновесного Франк – Кондоновского состояния переходит в равновесное, в котором ядра в соответствии с ослабленной связью разнесены друг от друга и совершают относительно этого положения колебания. n Далее – при испускании кванта люминесценции прочность связи в молекуле мгновенно усиливается, ядра же в первый момент продолжают занимать прежнее, далекое друг от друга положение (растянутая молекула). n И снова – переход из неравновесного Франк - Кондоновского состояния в равновесное осуществляется в результате колебаний.
Принцип Франка - Кондона n В результате молекула из неравновесного Франк – Кондоновского состояния переходит в равновесное, в котором ядра в соответствии с ослабленной связью разнесены друг от друга и совершают относительно этого положения колебания. n Далее – при испускании кванта люминесценции прочность связи в молекуле мгновенно усиливается, ядра же в первый момент продолжают занимать прежнее, далекое друг от друга положение (растянутая молекула). n И снова – переход из неравновесного Франк - Кондоновского состояния в равновесное осуществляется в результате колебаний. Принцип Франка - Кондона n Итак, согласно принципу Франка - Кондона, при электронном возбуждении внутримолекулярные связи, как правило, ослабляются. n Это приводит к тому, что минимум потенциальной кривой возбужденного состояния расположен при несколько большем межъядерном расстоянии, чем у основного состояния. n Как следует из квантовой механики, наиболее вероятное межъядерное расстояние для молекулы с нулевой колебательной энергией соответствует средней точке АВ или CD.
Принцип Франка - Кондона n Итак, согласно принципу Франка - Кондона, при электронном возбуждении внутримолекулярные связи, как правило, ослабляются. n Это приводит к тому, что минимум потенциальной кривой возбужденного состояния расположен при несколько большем межъядерном расстоянии, чем у основного состояния. n Как следует из квантовой механики, наиболее вероятное межъядерное расстояние для молекулы с нулевой колебательной энергией соответствует средней точке АВ или CD. Принцип Франка - Кондона n Наиболее вероятными будут переходы, отвечающие вертикальным линиям, проведенным из середины отрезков АВ (поглощение)или CD (испускание) до пересечения с соответствующими потенциальными кривыми:
Принцип Франка - Кондона n Наиболее вероятными будут переходы, отвечающие вертикальным линиям, проведенным из середины отрезков АВ (поглощение)или CD (испускание) до пересечения с соответствующими потенциальными кривыми:
 Фотолюминесценция n Способность веществ к люминесценции, как и к поглощению излучения, связана с их электронным строением. n Например, если низшее возбужденное синглетное состояние органической молекулы обусловлено π → π* переходом, то она часто имеет высокие выходы и флуоресценции и фосфоресценции. n В тех же случаях, когда низшее возбужденное синглетное состояние возникает в результате n → π* перехода, то молекула обычно обладает малым выходом флуоресценции, но может обладать высоким выходом фосфоресценции при низкой температуре. n Обычно переход n → π* является наиболее длинноволновым переходом.
Фотолюминесценция n Способность веществ к люминесценции, как и к поглощению излучения, связана с их электронным строением. n Например, если низшее возбужденное синглетное состояние органической молекулы обусловлено π → π* переходом, то она часто имеет высокие выходы и флуоресценции и фосфоресценции. n В тех же случаях, когда низшее возбужденное синглетное состояние возникает в результате n → π* перехода, то молекула обычно обладает малым выходом флуоресценции, но может обладать высоким выходом фосфоресценции при низкой температуре. n Обычно переход n → π* является наиболее длинноволновым переходом.

 Фотолюминесценция n Вероятность такого перехода мала (ε λmax ~ (1 - 2) 103 M -1 см-1), а время жизни возбужденного синглетного состояния n , π*, а значит и вероятность безызлучательной дезактивации велики. n Экспериментально установлено, что разница в энергиях S 1 ↔ T 1 для состояния n , π* в 2 - 4 раза меньше, чем для состояния π, π*. n Все это приводит к тому, что часто соединения, содержащие n - электроны, слабо или вовсе не флуоресцируют, но сильно фосфоресцируют.
Фотолюминесценция n Вероятность такого перехода мала (ε λmax ~ (1 - 2) 103 M -1 см-1), а время жизни возбужденного синглетного состояния n , π*, а значит и вероятность безызлучательной дезактивации велики. n Экспериментально установлено, что разница в энергиях S 1 ↔ T 1 для состояния n , π* в 2 - 4 раза меньше, чем для состояния π, π*. n Все это приводит к тому, что часто соединения, содержащие n - электроны, слабо или вовсе не флуоресцируют, но сильно фосфоресцируют.
 Структура и оптические свойства молекул n Замечено, что наибольшей способностью к люминесценции обладают симметричные молекулы с протяженной системой сопряженных связей, склонные к образованию орто - и пара - хиноидных колец. n Одним из наиболее важных факторов, обуславливающих люминесценцию, является требование о наличии жесткой и плоской структуры. n По - видимому, относительное вращение частей «гибкой» молекулы возмущает электронные оболочки и облегчает безызлучательные переходы. n Например, известный гормон адреналин не люминесцирует, но при окислении превращается в ярко люминесцирующий триоксидон.
Структура и оптические свойства молекул n Замечено, что наибольшей способностью к люминесценции обладают симметричные молекулы с протяженной системой сопряженных связей, склонные к образованию орто - и пара - хиноидных колец. n Одним из наиболее важных факторов, обуславливающих люминесценцию, является требование о наличии жесткой и плоской структуры. n По - видимому, относительное вращение частей «гибкой» молекулы возмущает электронные оболочки и облегчает безызлучательные переходы. n Например, известный гормон адреналин не люминесцирует, но при окислении превращается в ярко люминесцирующий триоксидон.
 Структура и оптические свойства молекул n Люминесцирующий флуоресцеин отличается от нелюминесцирующего фенолфталеина только тем, что в молекуле флуоресцеина кислородный мостик жестко удерживает два кольца в одной плоскости: флуоресцеин фенолфталеин
Структура и оптические свойства молекул n Люминесцирующий флуоресцеин отличается от нелюминесцирующего фенолфталеина только тем, что в молекуле флуоресцеина кислородный мостик жестко удерживает два кольца в одной плоскости: флуоресцеин фенолфталеин Основные закономерности молекулярной люминесценции n Правило Каши: форма спектра люминесценции не зависит от длины волны возбуждающего света. n Закон Стокса - Ломмеля: спектр люминесценции в целом и его максимум сдвинут со спектром поглощения и его максимумом в длинноволновую область. n Правило Левшина (правило зеркальной симметрии): нормированные спектры поглощения и флуоресценции, представленные в виде графиков ε = f(v) и I/v = f(v), зеркально симметричны относительно прямой, перпендикулярной к оси частот и проходящей через точку пересечения спектров v 0.
Основные закономерности молекулярной люминесценции n Правило Каши: форма спектра люминесценции не зависит от длины волны возбуждающего света. n Закон Стокса - Ломмеля: спектр люминесценции в целом и его максимум сдвинут со спектром поглощения и его максимумом в длинноволновую область. n Правило Левшина (правило зеркальной симметрии): нормированные спектры поглощения и флуоресценции, представленные в виде графиков ε = f(v) и I/v = f(v), зеркально симметричны относительно прямой, перпендикулярной к оси частот и проходящей через точку пересечения спектров v 0. Основные закономерности молекулярной люминесценции n Правило Левшина: va + vf = 2 v 0, где va, vf – симметричные частоты поглощения и флуоресценции; v 0 – частота чисто электронного перехода, т. е. перехода между нулевыми колебательными уровнями S 0 ↔ S 1; ∆v = va - vf = 2(va - v 0)
Основные закономерности молекулярной люминесценции n Правило Левшина: va + vf = 2 v 0, где va, vf – симметричные частоты поглощения и флуоресценции; v 0 – частота чисто электронного перехода, т. е. перехода между нулевыми колебательными уровнями S 0 ↔ S 1; ∆v = va - vf = 2(va - v 0) Основные закономерности молекулярной люминесценции n Закон Вавилова: по мере увеличения λв энергетический выход флуоресценции возрастает, сохраняет постоянную величину и затем уменьшается.
Основные закономерности молекулярной люминесценции n Закон Вавилова: по мере увеличения λв энергетический выход флуоресценции возрастает, сохраняет постоянную величину и затем уменьшается.
 Закон затухания люминесценции n Для интенсивности люминесценции Iл, определяемой скоростью испускания квантов люминесценции, имеем: dn Iл = - --- = k 1 n 0 e-k 1 t = Iл 0 e-k 1 t, dt где Iл 0 – интенсивность люминесценции в первый момент после прекращения возбуждения. n Таким образом, интенсивность люминесценции дискретного центра уменьшается со временем по экспоненциальному закону. n Затухание рекомбинационного свечения происходит по более сложному гиперболическому закону.
Закон затухания люминесценции n Для интенсивности люминесценции Iл, определяемой скоростью испускания квантов люминесценции, имеем: dn Iл = - --- = k 1 n 0 e-k 1 t = Iл 0 e-k 1 t, dt где Iл 0 – интенсивность люминесценции в первый момент после прекращения возбуждения. n Таким образом, интенсивность люминесценции дискретного центра уменьшается со временем по экспоненциальному закону. n Затухание рекомбинационного свечения происходит по более сложному гиперболическому закону. Зависимость интенсивности люминесценции от концентрации n При стационарном (непрерывном) возбуждении образца и отсутствии тушения: Iл = k 1 φкв Nп (Nп – число поглощенных квантов); Nп = k 2 (I 0 – I); I = I 0 10 -εℓC; Iл = k φкв I 0 (1 - 10 -εℓC), где k – коэффициент пропорциональности; Разложение 10 -εℓC в ряд дает: (2, 3εℓC) 2 (2, 3εℓC)3 1 - 2, 3εℓC + ---- - ---- + ……. ; 2! 3!
Зависимость интенсивности люминесценции от концентрации n При стационарном (непрерывном) возбуждении образца и отсутствии тушения: Iл = k 1 φкв Nп (Nп – число поглощенных квантов); Nп = k 2 (I 0 – I); I = I 0 10 -εℓC; Iл = k φкв I 0 (1 - 10 -εℓC), где k – коэффициент пропорциональности; Разложение 10 -εℓC в ряд дает: (2, 3εℓC) 2 (2, 3εℓC)3 1 - 2, 3εℓC + ---- - ---- + ……. ; 2! 3! Зависимость интенсивности люминесценции от концентрации ■ При εℓC ≤ 10 -2 вклад третьего и последующих членов разложения незначительны: Iл = 2, 3 k φкв I 0 ε ℓ C; Iл = k C; обычно ε ~ 103 – 104, тогда при ℓ = 1 см Сi = 10 -5 – 10 -6 M
Зависимость интенсивности люминесценции от концентрации ■ При εℓC ≤ 10 -2 вклад третьего и последующих членов разложения незначительны: Iл = 2, 3 k φкв I 0 ε ℓ C; Iл = k C; обычно ε ~ 103 – 104, тогда при ℓ = 1 см Сi = 10 -5 – 10 -6 M Причины отклонения зависимости Iл = k. C от линейности ■ Эффект внутреннего фильтра связан с поглощением части возбуждающего излучения при прохождении через слой люминофора; ■ Самопоглощение – поглощение люминофором части люминесцентного излучения; ■ Тушение люминесценции: концентрационное тушение (образование нелюминесцирующих агрегатов, миграция энергии от возбужденных молекул к невозбужденным); температурное тушение (внутримолекулярный процесс, обусловленный значительным увеличением колебательной энергии при повышении Т);
Причины отклонения зависимости Iл = k. C от линейности ■ Эффект внутреннего фильтра связан с поглощением части возбуждающего излучения при прохождении через слой люминофора; ■ Самопоглощение – поглощение люминофором части люминесцентного излучения; ■ Тушение люминесценции: концентрационное тушение (образование нелюминесцирующих агрегатов, миграция энергии от возбужденных молекул к невозбужденным); температурное тушение (внутримолекулярный процесс, обусловленный значительным увеличением колебательной энергии при повышении Т); Тушение люминесценции ■ Тушение люминесценции: тушение посторонними веществами (тяжелые ионы: I-, Br-, Cs+, Cu+; парамагнитные Mn 2+, O 2; молекулы растворителя); статическое тушение (примесное вещество образует с невозбужденным люминофором нелюминесцирующие продукты); динамическое тушение (примесное вещество образует с возбужденным люминофором нелюминесцирующие продукты).
Тушение люминесценции ■ Тушение люминесценции: тушение посторонними веществами (тяжелые ионы: I-, Br-, Cs+, Cu+; парамагнитные Mn 2+, O 2; молекулы растворителя); статическое тушение (примесное вещество образует с невозбужденным люминофором нелюминесцирующие продукты); динамическое тушение (примесное вещество образует с возбужденным люминофором нелюминесцирующие продукты). Тушение люминесценции ■ Уравнение Штерна - Фольмера: φкв(Q) = k 1 / (k 1 + k 2 + k 3 [Q];
Тушение люминесценции ■ Уравнение Штерна - Фольмера: φкв(Q) = k 1 / (k 1 + k 2 + k 3 [Q];



 Практическое применение люминесценции Флуориметрические определения: cобственная люминесценция (UO 22+, комплексные галогениды тяжелых металлов Tl+, Sn 2+, Sb 3+, Te(IV), Pb 2+, Bi 3+, In 3+ и др. , кристаллофосфоры, органические соединения); флуоресценция комплексных соединений ионов металлов с органическими реагентами. ■ Фосфориметрические определения. ■ Временная селекция. ■ Синхронное сканирование спектров (производные спектры). ■ Хемилюминесцентный анализ. ■
Практическое применение люминесценции Флуориметрические определения: cобственная люминесценция (UO 22+, комплексные галогениды тяжелых металлов Tl+, Sn 2+, Sb 3+, Te(IV), Pb 2+, Bi 3+, In 3+ и др. , кристаллофосфоры, органические соединения); флуоресценция комплексных соединений ионов металлов с органическими реагентами. ■ Фосфориметрические определения. ■ Временная селекция. ■ Синхронное сканирование спектров (производные спектры). ■ Хемилюминесцентный анализ. ■
 Синхронные спектры ■ Синхронные спектры получают при одновременном (синхронном) сканировании (изменении) длин волн возбуждения и испускания с постоянным сдвигом Δλ между ними. ■ При этом наблюдается значительное упрощение спектров люминесценции сложных молекул, сужение их полос и, как следствие, повышение селективности определений, а также уменьшение фонового свечения за счет подавления релеевского и комбинационного рассеяния растворителя. ■ Оптимальным условием для достижения наиболее интенсивного сигнала и наименьшей полуширины линии является синхронное сканирование с условием: Δλ = λисп (макс.) - λвозб (макс.)
Синхронные спектры ■ Синхронные спектры получают при одновременном (синхронном) сканировании (изменении) длин волн возбуждения и испускания с постоянным сдвигом Δλ между ними. ■ При этом наблюдается значительное упрощение спектров люминесценции сложных молекул, сужение их полос и, как следствие, повышение селективности определений, а также уменьшение фонового свечения за счет подавления релеевского и комбинационного рассеяния растворителя. ■ Оптимальным условием для достижения наиболее интенсивного сигнала и наименьшей полуширины линии является синхронное сканирование с условием: Δλ = λисп (макс.) - λвозб (макс.)
 Трехмерные спектры ■ Трехмерные спектры представляют собой зависимость интенсивности люминесценции как от длины волны возбуждения, так и от длины волны испускания. ■ Трехмерные спектры имеют вид «горной гряды» . Каждая строка такой гряды представляет собой спектр излучения, а каждый столбец – спектр возбуждения. ■ Такие спектры получают из большого числа (обычно не менее 50) индивидуальных спектров люминесценции, записанных через определенные промежутки длин волн возбуждения. ■ Трехмерные спектры дают полную картину спектральных свойств исследуемого образца.
Трехмерные спектры ■ Трехмерные спектры представляют собой зависимость интенсивности люминесценции как от длины волны возбуждения, так и от длины волны испускания. ■ Трехмерные спектры имеют вид «горной гряды» . Каждая строка такой гряды представляет собой спектр излучения, а каждый столбец – спектр возбуждения. ■ Такие спектры получают из большого числа (обычно не менее 50) индивидуальных спектров люминесценции, записанных через определенные промежутки длин волн возбуждения. ■ Трехмерные спектры дают полную картину спектральных свойств исследуемого образца.
 Контурные (двумерные) спектры ■ Использование трехмерных спектров для анализа смесей, содержащих более трех компонентов, и имеющих широкие размытые полосы в одной и той же спектральной области, представляет неразрешимую задачу. ■ В данном случае более перспективным является использование контурных спектров – результат сечения трехмерного спектра плоскостями, параллельными плоскости ХОУ, с последующим объединением полученных сечений в одной плоскости ХОУ. ■ Получающиеся изображения напоминают контурные карты (контурные спектры), которые являются «отпечатками пальцев» индивидуального соединения.
Контурные (двумерные) спектры ■ Использование трехмерных спектров для анализа смесей, содержащих более трех компонентов, и имеющих широкие размытые полосы в одной и той же спектральной области, представляет неразрешимую задачу. ■ В данном случае более перспективным является использование контурных спектров – результат сечения трехмерного спектра плоскостями, параллельными плоскости ХОУ, с последующим объединением полученных сечений в одной плоскости ХОУ. ■ Получающиеся изображения напоминают контурные карты (контурные спектры), которые являются «отпечатками пальцев» индивидуального соединения.

 Хемилюминесцентный анализ ■ Хемилюминесцентный анализ основан на явлении хемилюминесценции (ХЛ). Этот вид свечения не требует внешнего источника возбуждения, а возникает за счет энергии экзотермических химических процессов: A + B → P* + C P* → P + hvcl n В растворах ХЛ наблюдается главным образом в реакциях окисления органических веществ кислородом или пероксидом водорода. n Образование продуктов реакции происходит чаще всего по сложному радикально-цепному механизму. n Так, многие полагают, что окисление люминола (I) протекает с участием радикалов HO 2*, HO*, O 2*.
Хемилюминесцентный анализ ■ Хемилюминесцентный анализ основан на явлении хемилюминесценции (ХЛ). Этот вид свечения не требует внешнего источника возбуждения, а возникает за счет энергии экзотермических химических процессов: A + B → P* + C P* → P + hvcl n В растворах ХЛ наблюдается главным образом в реакциях окисления органических веществ кислородом или пероксидом водорода. n Образование продуктов реакции происходит чаще всего по сложному радикально-цепному механизму. n Так, многие полагают, что окисление люминола (I) протекает с участием радикалов HO 2*, HO*, O 2*. Хемилюминесцентный анализ ■ Основные группы определяемых соединений: хемилюминесцентные соединения, которые при окислении излучают свет (люминол, люцигенин, лофин и др.); окислители (пероксид водорода, гипохлориты, гипобромиты, персулфаты, перманганат калия, молекулярный кислород и др.); катализаторы индикаторных реакций (ионы меди, кобальта, марганца, никеля, железа и др.); ингибиторы индикаторных реакций (ароматические соединения, содержащие фенольные и аминогруппы); соединения, изменяющие р. Н среды (щелочи, карбонаты, органические основания и др.). ■ Сортовой ХЛ анализ и индикаторные методы.
Хемилюминесцентный анализ ■ Основные группы определяемых соединений: хемилюминесцентные соединения, которые при окислении излучают свет (люминол, люцигенин, лофин и др.); окислители (пероксид водорода, гипохлориты, гипобромиты, персулфаты, перманганат калия, молекулярный кислород и др.); катализаторы индикаторных реакций (ионы меди, кобальта, марганца, никеля, железа и др.); ингибиторы индикаторных реакций (ароматические соединения, содержащие фенольные и аминогруппы); соединения, изменяющие р. Н среды (щелочи, карбонаты, органические основания и др.). ■ Сортовой ХЛ анализ и индикаторные методы.
 Хемилюминесцентный анализ ■ Сортовой ХЛ анализ применяется при испытаниях вин, соков плодов и овощей, мясных экстрактов и т. д. Так, по реакции окисления люминола в присутствии катализатора - комплекса ионов меди с α-аминокислотами, содержащимися в соке картофеля, можно улавливать сортовые различия картофеля: сорта различаются по содержанию аминокислот. ■ К индикаторным методам ХЛ анализа относятся различные виды титрования с использованием хемилюминесцентных индикаторов (ХЛИ). В отличии от флуоресцентных индикаторов для работы с ХЛИ не требуется источника возбуждения.
Хемилюминесцентный анализ ■ Сортовой ХЛ анализ применяется при испытаниях вин, соков плодов и овощей, мясных экстрактов и т. д. Так, по реакции окисления люминола в присутствии катализатора - комплекса ионов меди с α-аминокислотами, содержащимися в соке картофеля, можно улавливать сортовые различия картофеля: сорта различаются по содержанию аминокислот. ■ К индикаторным методам ХЛ анализа относятся различные виды титрования с использованием хемилюминесцентных индикаторов (ХЛИ). В отличии от флуоресцентных индикаторов для работы с ХЛИ не требуется источника возбуждения. Хемилюминесцентный анализ (аналитические характеристики) ■ Большей частью ХЛ – определения отличаются высокой чувствительностью: пределы обнаружения 10 -10 – 10 -4 г/мл при конечном объеме 2 – 5 мл. ■ Селективность ХЛ – определений, как правило, невысока, так как многие вещества влияют на скорость индикаторной реакции. Однако варьирование условий определения или применение маскирующих агентов позволяет «смягчить» этот недостаток. ■ Простота, доступность и дешевизна аппаратуры, используемой в ХЛ, в сочетании с возможностью экспрессного, высокочувствительного, а при определенных условиях, и селективного определения большого круга соединений обуславливает распространенность ХЛ.
Хемилюминесцентный анализ (аналитические характеристики) ■ Большей частью ХЛ – определения отличаются высокой чувствительностью: пределы обнаружения 10 -10 – 10 -4 г/мл при конечном объеме 2 – 5 мл. ■ Селективность ХЛ – определений, как правило, невысока, так как многие вещества влияют на скорость индикаторной реакции. Однако варьирование условий определения или применение маскирующих агентов позволяет «смягчить» этот недостаток. ■ Простота, доступность и дешевизна аппаратуры, используемой в ХЛ, в сочетании с возможностью экспрессного, высокочувствительного, а при определенных условиях, и селективного определения большого круга соединений обуславливает распространенность ХЛ.Источники и процесс
Люминесценция и накаливание
Люминесцентные пигменты и красители

Ранние исследования

Хеми- и биолюминесценция

Термостимулированная люминесценция
Фотолюминесценция
Флуоресценция и фосфоресценция
 Люминесценция: виды, методы, применение
Люминесценция: виды, методы, применение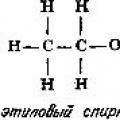 Основные положения органической химии Классификация органических реакций
Основные положения органической химии Классификация органических реакций Отличие учителя от преподавателя Чем отличается учитель от преподавателя
Отличие учителя от преподавателя Чем отличается учитель от преподавателя