الخصائص الفيزيائية وصور الكبريت. الخصائص الفيزيائية وصور الكبريت كيف يبدو الكبريت الطبيعي
البطاقة التشخيصية.
بلورات الكبريت من كوزوديسي (أجريجنتو)
س
نظام معيني أو أحادي الميل
صلابة 2
الثقل النوعي 2-2.1
الانقسام غير كامل
كسر محاري
اللون أصفر، بني
لون المسحوق أبيض
لمعان من القطران إلى دهني

الكبريت الأصلي - S. بريقه دهني إلى ما يشبه الماس، والمعدن شفاف إلى شفاف. الألوان: أصفر، عند تعرضه للعوامل الجوية يصبح رمادياً أو بنياً إلى أسود. الخط أصفر فاتح، الكسر محاري، غير متساوي. هشة للغاية. الانقسام غير كامل. يتشكل الكبريت كمنتج للتسامي البركاني ويوجد أيضًا في الرواسب الرسوبية الحيوية.
البلورات (النظام المعيني) هرمية الشكل. المفاصل شائعة. الركام صلب، خشن الحبيبات، كثيف، ترابي في بعض الأحيان (توجد تصريفات على شكل عنقودي وعلى شكل كلية)، رواسب مسحوقية. يستخدم لتحضير حامض الكبريتيك وفي صناعة المطاط ومكافحة الآفات الزراعية. أماكن التوزيع: جزيرة صقلية (إيطاليا)، إسبانيا. بولندا، رابطة الدول المستقلة، اليابان، أجهزة الكمبيوتر. لويزيانا (الولايات المتحدة الأمريكية)، المكسيك.
الكبريت هو مثال على تعدد الأشكال. في المرحلة المستقرة (حتى 95 درجة مئوية) يصبح النظام المعيني التقويمي، في نطاق يصل إلى 119 درجة مئوية، أحادي الميل. يذوب مع ارتفاع درجة الحرارة. في الطبيعة، بسبب هذا، يتم العثور عليه بشكل رئيسي في شكل معين. يشكل الكبريت بلورات ثنائية الهرم ومجموعات حبيبية. اللون المميز لهذا المعدن هو الأصفر الليموني، والذي يمكن أن يتغير إلى اللون الأسود تقريبًا بسبب التلوث بالقار.

الكبريت (الأصفر). جزيرة غوام، المحيط الهادئ، الولايات المتحدة الأمريكية. 10 سم الصورة: أ.أ. إيفسيف.
 الكبريت (الإنجليزية الكبريت، الفرنسية Sufre، الألمانية Schwefel) في حالته الأصلية، وكذلك في شكل مركبات الكبريت، معروفة منذ العصور القديمة. ربما أصبح الإنسان على دراية برائحة الكبريت المحترق والتأثير الخانق لثاني أكسيد الكبريت ورائحة كبريتيد الهيدروجين المثيرة للاشمئزاز في عصور ما قبل التاريخ. ما يقرب من نصف إنتاج الكبريت في العالم يأتي من المحميات الطبيعية.
الكبريت (الإنجليزية الكبريت، الفرنسية Sufre، الألمانية Schwefel) في حالته الأصلية، وكذلك في شكل مركبات الكبريت، معروفة منذ العصور القديمة. ربما أصبح الإنسان على دراية برائحة الكبريت المحترق والتأثير الخانق لثاني أكسيد الكبريت ورائحة كبريتيد الهيدروجين المثيرة للاشمئزاز في عصور ما قبل التاريخ. ما يقرب من نصف إنتاج الكبريت في العالم يأتي من المحميات الطبيعية.
علامات التشخيص.
هشة، موصل للحرارة الفقراء. في بعض الأحيان تكون لمسة اليد كافية لتسبب تشقق البلورة. مشحونة بالكهرباء عند فركها. ينصهر عند درجة حرارة منخفضة ويحترق في الهواء، ويطلق غازًا سامًا من أنهيدريد الكبريتيك.
أصل.
الكبريت هو أحد الخصائص المعدنية للرواسب الرسوبية مثل المتبخرات والتسامي البركاني المباشر ("الجاف")، كما أنه أحد عناصر الينابيع الكبريتية البركانية (الحرارية) (المياه السامة والأبخرة الساخنة للكبريت والحامض). ويعتقد أنه يتشكل أثناء تحلل الكبريتات، وخاصة الجبس (الذي يوجد معه في أغلب الأحيان معًا)، تحت تأثير البكتيريا، وفي المقام الأول "ثيوبكتيريا". تتشكل المرحلة أحادية الميل أثناء تسامي بخار حامض الكبريتيك في البيئة البركانية (في السولفاتارات). تُظهر الصورة تجمعات من بلورات الكبريت، والتي يطلق عليها عادة "أزهار الكبريت".
الودائع والتطبيقات.
تم العثور على رواسب كبيرة من الكبريت في تكساس ولويزيانا في أسطح القباب الملحية (رواسب التبخر) المغطاة بطبقات طينية. لا يحتوي الكبريت الموجود في هذه الرواسب على أي شوائب تقريبًا، ويتم استخراجه عن طريق حفر الآبار التي يتم حقن الماء المغلي فيها. يقوم بإذابة الكبريت، ومن ثم يتم ضخه إلى السطح (طريقة الفلاش).
الكبريت شائع أيضًا في إيطاليا على طول نتوءات الطبقات الحاملة للكبريت الجبس التي تحدد جبال الأبينيني، خاصة في رومانيا وماركي وكالابريا وصقلية. الكبريت هناك متداخل مع الصخور الطينية، لذا فإن استخراجه (الذي توقف الآن) يتطلب طريقة معقدة إلى حد ما. في مناجم الكبريت في صقلية استخدموا طريقة البثق. تم إذابة الكبريت المستخرج من المنجم وصبه في أوعية كبيرة.


الودائع الأخرى معروفة في اليابان وإندونيسيا. في إيطاليا، تُعرف بلورات الكبريت المعينية الجميلة جدًا من رومانيا وماركي (بيرتيكارا) وصقلية، حيث ترتبط بالسيلستين والأراجونيت. تم إنشاء الكبريت أحادي الميل في كامبي فليجيري وفي جزيرة فولكانو. ويستخدم الكبريت في الصناعة الكيميائية وفي إنتاج الأسمدة المعدنية.

الكبريت (الكريستال). صقلية، إيطاليا. 5x2.5 سم الصورة: أ.أ. إيفسيف.

فرشاة من بلورات الكبريت (60x40 سم) من جزيرة صقلية (إيطاليا). الصورة: ف. دفوريادكين.

الكبريت. دروز بلورات ثنائية الهرم على بلورة من الجبس عديم اللون
وداخله. صقلية، إيطاليا. الصورة: أ.أ. إيفسيف.
الكبريت هو "معدن الجمال" (نكتة في "المناطق" السوفيتية، 1939-1969 في القرن العشرين، حيث تعرض السجناء للكبريت، من بين أشياء أخرى). يبلغ محتوى الكبريت في جسم الشخص البالغ حوالي 0.16٪ (110 جرام لكل 70 كجم من وزن الجسم). يوجد الكبريت في جميع أنسجة الجسم، ويوجد الكثير منه في العضلات والهيكل العظمي والكبد والأنسجة العصبية والدم - التمثيل الغذائي النشط. الطبقات السطحية من الجلد غنية بالكبريت الأصفر، حيث يشكل الكبريت جزءاً من الكيراتين والميلانين. هذه هي الكبريتيدات. يدخل الكبريت الجسم مع المنتجات الغذائية كجزء من المركبات غير العضوية والعضوية. يدخل معظم الكبريت الجسم كجزء من الأحماض الأمينية.
المظاهر الرئيسية للكبريت الزائد: الحكة، والطفح الجلدي، والدمل، واحمرار وتورم الملتحمة. ظهور عيوب نقطة صغيرة على القرنية. ألم في الحاجبين ومقل العيون، والشعور بالرمل في العينين. رهاب الضوء، الدمع، الضعف العام، الصداع، الدوخة، الغثيان، نزلات الجهاز التنفسي العلوي، التهاب الشعب الهوائية. فقدان السمع، واضطرابات الجهاز الهضمي، والإسهال، وفقدان الوزن. فقر الدم، الاضطرابات النفسية، انخفاض الذكاء. الكبريت - البراكين والينابيع الكبريتية، تبخر الكبريت (99.3%). تتراكم - المنتجات. أحد مصادر تناول الكبريت الزائد هو المركبات المحتوية على الكبريت (الكبريتيت)، وزيادة استهلاك الكبريتيت هو المسؤول عن زيادة حالات الربو القصبي.
علامات نقص الكبريت: الإمساك، الحساسية، بلادة وتساقط الشعر، هشاشة الأظافر، ارتفاع ضغط الدم، آلام المفاصل، عدم انتظام دقات القلب، ارتفاع نسبة السكر في الدم وارتفاع مستويات الدهون الثلاثية في الدم. الكبد الدهني، ونزيف في الكلى، واضطرابات استقلاب البروتين والكربوهيدرات، والإفراط في إثارة الجهاز العصبي، والتهيج. الكبريت هو المعدن الذي يجعل الثوم "ملك النباتات".
تعتبر ذرات الكبريت جزءا لا يتجزأ من جزيئات الأحماض الأمينية الأساسية (السيستين، السيستين، الميثيونين)، والهرمونات (الأنسولين، الكالسيتونين)، والفيتامينات (البيوتين، الثيامين)، الجلوتاثيون، التورين وغيرها من المركبات المهمة للجسم. ويشارك الكبريت في تركيبته في تفاعلات الأكسدة والاختزال، وعمليات تنفس الأنسجة، وإنتاج الطاقة، ونقل المعلومات الوراثية، ويقوم بالعديد من الوظائف المهمة الأخرى. الكبريت هو أحد مكونات بروتين الكولاجين الهيكلي. توجد كبريتات الكوندرويتين في الجلد والغضاريف والأظافر والأربطة وصمامات عضلة القلب. المستقلبات المحتوية على الكبريت هي الهيموجلوبين والهيبارين والسيتوكروم والفيبرينوجين والسولفوليبيدات.
يتم إخراج الكبريت في البول على شكل كبريت محايد وكبريتات غير عضوية، ويفرز جزء أصغر من الكبريت عبر الجلد والرئتين، ويفرز بشكل رئيسي في البول على شكل SO42–. يشارك حمض الكبريتيك الداخلي المنشأ في الجسم في تحييد المركبات السامة (الفينول، الإندول، وما إلى ذلك) التي تنتجها البكتيريا المعوية، ويربط أيضًا المواد الغريبة عن الجسم، بما في ذلك الأدوية ومستقلباتها. في هذه الحالة، يتم تشكيل مركبات غير ضارة - اتحادات، والتي تفرز بعد ذلك من الجسم. يتم التحكم في استقلاب الكبريت من خلال تلك العوامل التي لها تأثير تنظيمي على استقلاب البروتين (هرمونات الغدة النخامية والغدة الدرقية والغدد الكظرية والغدد التناسلية).
أدر 2.1
الغازات القابلة للاشتعال
خطر الحريق. خطر الانفجار. قد يكون تحت الضغط. خطر الاختناق. قد يسبب حروقًا و/أو قضمة الصقيع. يمكن أن تنفجر الحاويات عند تسخينها (خطير للغاية - لا تحترق عمليًا)
أدر 2.2
اسطوانة غازغازات غير قابلة للاشتعال وغير سامة.
خطر الاختناق. قد يكون تحت الضغط. يمكن أن تسبب قضمة الصقيع (على غرار الحروق - الشحوب والبثور والغرغرينا الغازية السوداء - الصرير). يمكن أن تنفجر الحاويات عند تسخينها (خطيرة للغاية - انفجار من شرارة، لهب، تطابق، عمليا لا تحترق)
استخدم الغطاء. تجنب المناطق السطحية المنخفضة (الثقوب والأراضي المنخفضة والخنادق)
الماس الأخضر، رقم ADR، أسطوانة غاز سوداء أو بيضاء (الأسطوانة، نوع الترمس)
أدر 2.3
الغازات السامة. الجمجمة والعظمتين المتقاطعتين
خطر التسمم. قد يكون تحت الضغط. قد يسبب حروقًا و/أو قضمة الصقيع. يمكن أن تنفجر الحاويات عند تسخينها (خطير للغاية - انتشار فوري للغازات في جميع أنحاء المنطقة المحيطة)
استخدم الكمامة عند مغادرة السيارة في حالة الطوارئ. استخدم الغطاء. تجنب المناطق السطحية المنخفضة (الثقوب والأراضي المنخفضة والخنادق)
الماس الأبيض، رقم ADR، جمجمة سوداء وعظمتين متقاطعتين
أدر 3
السوائل القابلة للاشتعال
خطر الحريق. خطر الانفجار. يمكن أن تنفجر الحاويات عند تسخينها (خطير للغاية - يحترق بسهولة)
استخدم الغطاء. تجنب المناطق السطحية المنخفضة (الثقوب والأراضي المنخفضة والخنادق)
الماس الأحمر، رقم ADR، لهب أسود أو أبيض
أدر 4.1
المواد الصلبة القابلة للاشتعالوالمواد ذاتية التفاعل والمتفجرات الصلبة منزوعة الحساسية
خطر الحريق. قد تشتعل المواد القابلة للاشتعال أو القابلة للاشتعال عن طريق الشرر أو اللهب. قد تحتوي على مواد ذاتية التفاعل قادرة على التحلل طاردة للحرارة عند التسخين أو التلامس مع مواد أخرى (مثل الأحماض أو مركبات المعادن الثقيلة أو الأمينات) أو الاحتكاك أو الصدمة.
قد يؤدي ذلك إلى إطلاق غازات أو أبخرة ضارة أو قابلة للاشتعال أو احتراق ذاتي. يمكن أن تنفجر الحاويات عند تسخينها (فهي خطيرة للغاية - فهي لا تحترق عمليا).
خطر انفجار المتفجرات المنزوعة الحساسية بعد فقدان مادة إزالة الحساسية
سبعة خطوط حمراء عمودية على خلفية بيضاء، متساوية في الحجم، رقم ADR، لهب أسود
أدر 8
المواد المسببة للتآكل (الكاوية).
خطر الحروق بسبب تآكل الجلد. قد تتفاعل بعنف مع بعضها البعض (المكونات) ومع الماء والمواد الأخرى. قد تؤدي المواد المنسكبة/المتناثرة إلى إطلاق أبخرة مسببة للتآكل.
خطرة على البيئة المائية أو نظام الصرف الصحي
النصف العلوي الأبيض من المعين، أسود - أقل، متساوي الحجم، رقم ADR، أنابيب الاختبار، الأيدي
| اسم البضائع الخطرة بشكل خاص أثناء النقل | رقم الأمم المتحدة | فصل حل النزاع البديل |
| أنهيدريد الكبريتيك، ثالث أكسيد الكبريت المستقر، المستقر | 1829 | 8 |
| أنهيدريد الكبريت ثاني أكسيد الكبريت | 1079 | 2 |
| ثاني كبريتيد الكربون ثاني كبريتيد الكربون | 1131 | 3 |
| غاز سداسي فلوريد الكبريت | 1080 | 2 |
| حامض الكبريتيك المستهلك | 1832 | 8 |
| حمض الكبريتيك، مدخن | 1831 | 8 |
| حمض الكبريتيك، الذي لا يحتوي على حمض أكثر من 51%، أو سائل حمض البطارية | 2796 | 8 |
| حمض الكبريتيك المتجدد من حمض القطران | 1906 | 8 |
| - حمض الكبريتيك والذي يحتوي على أكثر من 51% حمض | 1830 | 8 |
| حمض الكبريتيك | 1833 | 8 |
| الكبريت | 1350 | 4.1 |
| الكبريت منصهر | 2448 | 4.1 |
| كلوريد الكبريت كلوريد الكبريت | 1828 | 8 |
| سداسي فلوريد الكبريت سداسي فلوريد الكبريت | 1080 | 2 |
| ثنائي كلوريد الكبريت | 1828 | 8 |
| ثاني أكسيد الكبريت | 1079 | 2 |
| رابع فلوريد الكبريت | 2418 | 2 |
| استقر أكسيد الكبريت | 1829 | 8 |
| كلوريد الكبريت | 1828 | 8 |
| كبريتيد الهيدروجين | 1053 | 2 |
| ثاني كبريتيد الكربون | 1131 | 3 |
| أعواد كبريت آمنة في الصناديق والكتب والكرتون | 1944 | 4.1 |
| مباريات البارافين "فيستا" | 1945 | 4.1 |
| مباريات البارافين مباريات البارافين "فيستا" | 1945 | 4.1 |
| مباريات الألغام | 2254 | 4.1 |
حجر، معدني، معادن، أحجار، كريستال، سلالة، أحجار كريمة، أحجار طبيعية، صخور، حجر كريم، صخر، حجر بري، أحجار ومعادن، اسم الحجارة، حجر طبيعي، حجر طبيعي، أحجار معدنية، حجر شبه كريم، المعادن هذه هي كتالوج الحجارة، علم المعادن، معنى الحجارة، ما هي المعادن، خصائص الحجارة، أسماء الحجارة والمعادن، أسماء الحجارة الطبيعية وصورها، الحجارة الطبيعية، الحجارة المعدنية، الحجارة الطبيعية، صور الحجارة وأسماءها، أسماء المعادن، صور الحجر البري، الصخور والمعادن، المعادن والأحجار، التركيب الكيميائي للمعادن، مما يتكون الحجر، أروع الأحجار والمعادن، قائمة المعادن، كتالوج المعادن، الحجارة وخواصها، معادن ثمينة، حجر طبيعي , أنواع المعادن , أنواع المعادن , الكريستال الحجري , خواص الحجر , جيولوجيا الحجارة , المعادن الرئيسية , المعادن وتصنيفها , أجمل المعادن , تعريف المعادن , أصل الحجارة , معدن الكريستال , الأحجار العادية , تصنيف المعادن , وصف الأحجار , كيف تبدو الأحجار الكريمة في الطبيعة، ما هو الحجر، أنواع الحجر الطبيعي، المعادن الثمينة، علم المعادن، التصنيف الكيميائي للمعادن، الخواص المغناطيسية للمعادن، عالم المعادن، الصخور المعدنية، ما هي الصخور والمعادن، أنواع الحجارة، تكوين الحجر، وصف المعادن، الحجارة في الطبيعة، الحجارة المفيدة، التعرف على الحجارة، كثافة المعادن، صلابة الصخور، صور الحجارة وأسمائها، تصنيف المعادن، الجيولوجيا والصخور والمعادن، أسماء الأحجار شبه الكريمة والصور، خصائص المعادن، هيكل الحجر، المعادن في الطبيعة.
الكبريت (من اللات. مصل"المصل") هو معدن من فئة العناصر الأصلية، وهو غير معدني. يرتبط الاسم اللاتيني بـ الهندو أوروبيةاجتياح الجذر - "حرق". الصيغة الكيميائية: س.
يحتوي الكبريت، على عكس العناصر المحلية الأخرى، على شبكة جزيئية تحدد صلابته المنخفضة (1.5-2.5)، ونقص الانقسام، والهشاشة، والكسر غير المستوي والبقع الدهنية الناتجة؛ فقط على سطح البلورات يتم ملاحظة لمعان زجاجي. الثقل النوعي 2.07 جم/سم3. لديها موصلية كهربائية ضعيفة، موصلية حرارية ضعيفة، نقطة انصهار منخفضة (112.8 درجة مئوية) ونقطة اشتعال (248 درجة مئوية). يضيء بسهولة باستخدام عود ثقاب ويحترق بلهب أزرق؛ وهذا ينتج ثاني أكسيد الكبريت، الذي له رائحة نفاذة وخانقة. لون الكبريت الأصلي هو أصفر فاتح، أصفر قش، عسلي أصفر، مخضر. تكتسب المواد العضوية المحتوية على الكبريت اللون البني والرمادي والأسود. الكبريت البركاني أصفر ساطع، برتقالي، مخضر. في بعض الأماكن عادة ما يكون لها لون أصفر. تم العثور على المعدن على شكل كتل متواصلة كثيفة ومتكلسة وترابية وبودرة. هناك أيضًا بلورات وعقيدات ولويحات وقشور وشوائب وأشكال زائفة من المخلفات العضوية متضخمة. التزامن المعيني.
ميزات مميزة: يتميز الكبريت الأصلي بأنه: ذو بريق غير معدني وكونه يشتعل بعود كبريت فيحترق ويطلق ثاني أكسيد الكبريت الذي له رائحة خانقة حادة. اللون الأكثر تميزًا للكبريت الأصلي هو الأصفر الفاتح.
متنوع:
الفلكانيت(كبريت السيلينيوم). اللون البرتقالي والأحمر والأحمر والبني. الأصل بركاني.
الكبريت أحادي الميل الكبريت البلوري الكبريت البلوري الكبريت السيلينوسي - الفلكانيت
الخواص الكيميائية للكبريت
يشتعل بعود ثقاب ويحترق بلهب أزرق، فينتج ثاني أكسيد الكبريت، الذي له رائحة خانقة حادة. يذوب بسهولة (نقطة الانصهار 112.8 درجة مئوية). درجة حرارة الاشتعال 248 درجة مئوية. يذوب الكبريت في ثاني كبريتيد الكربون.
أصل الكبريت
تم العثور على الكبريت الأصلي من أصل طبيعي وبركاني. تعيش بكتيريا الكبريت في أحواض مائية غنية بكبريتيد الهيدروجين بسبب تحلل المخلفات العضوية - في قاع المستنقعات ومصبات الأنهار والخلجان البحرية الضحلة. تعتبر مصبات البحر الأسود وخليج سيفاش أمثلة على هذه المسطحات المائية. وينحصر تركيز الكبريت ذو الأصل البركاني في الفتحات البركانية وفي فراغات الصخور البركانية. أثناء الانفجارات البركانية، يتم إطلاق مركبات الكبريت المختلفة (H 2 S، SO 2)، والتي تتأكسد في الظروف السطحية، مما يؤدي إلى اختزالها؛ بالإضافة إلى ذلك، يتم تسامي الكبريت مباشرة من البخار.
في بعض الأحيان، أثناء العمليات البركانية، يتم إخراج الكبريت في شكل سائل. ويحدث هذا عندما يذوب الكبريت، المترسب سابقًا على جدران الحفر، مع ارتفاع درجة الحرارة. يترسب الكبريت أيضًا من المحاليل المائية الساخنة نتيجة لتحلل كبريتيد الهيدروجين ومركبات الكبريت المنبعثة خلال إحدى المراحل اللاحقة للنشاط البركاني. يتم ملاحظة هذه الظواهر الآن بالقرب من فتحات السخان في متنزه يلوستون (الولايات المتحدة الأمريكية) وأيسلندا. تم العثور عليه مع الجبس والأنهيدريت والحجر الجيري والدولوميت وأملاح الصخور والبوتاسيوم والطين والرواسب البيتومينية (الزيت والأوزوكيريت والأسفلت) والبيريت. ويوجد أيضًا على جدران الفوهات البركانية، وفي شقوق الحمم البركانية والطفات المحيطة بفتحات البراكين النشطة والمنقرضة، بالقرب من الينابيع المعدنية الكبريتية.
الأقمار الصناعية. ومن الصخور الرسوبية: الجبس، الأنهيدريت، الكالسيت، الدولوميت، السدريت، الملح الصخري، السلفيت، الكرناليت، الأوبال، العقيق الأبيض، البيتومين (الأسفلت، الزيت، الأوزوكيريت). في الرواسب التي تكونت نتيجة أكسدة الكبريتيد، يوجد البيريت بشكل رئيسي. ومن منتجات التسامي البركاني: الجبس، الريجار، الأوربيمنت.
طلب
تستخدم على نطاق واسع في الصناعة الكيميائية. ويستخدم ثلاثة أرباع إنتاج الكبريت لإنتاج حامض الكبريتيك. كما يستخدم في مكافحة الآفات الزراعية، بالإضافة إلى صناعة الورق والمطاط (فلكنة المطاط)، وفي إنتاج البارود، وأعواد الثقاب، والأدوية، والزجاج، والصناعات الغذائية.
رواسب الكبريت
على أراضي أوراسيا، جميع الرواسب الصناعية للكبريت الأصلي هي من أصل سطحي. يقع بعضها في تركمانستان، في منطقة الفولغا، إلخ. تمتد الصخور المحتوية على الكبريت على طول الضفة اليسرى من نهر الفولغا من مدينة سمارة في شريط بعرض عدة كيلومترات إلى قازان. من المحتمل أن الكبريت قد تشكل في البحيرات خلال العصر البرمي نتيجة للعمليات البيوكيميائية. توجد رواسب الكبريت في رازدول (منطقة لفيف ومنطقة الكاربات) ويافوروفسك (أوكرانيا) ومنطقة أورال إمبينسكي. يوجد الكبريت في جبال الأورال (منطقة تشيليابينسك) والذي يتكون نتيجة أكسدة البيريت. تم العثور على الكبريت من أصل بركاني في كامتشاتكا وجزر الكوريل. وتقع الاحتياطيات الرئيسية في العراق والولايات المتحدة (لويزيانا ويوتا) والمكسيك وتشيلي واليابان وإيطاليا (صقلية).
الكبريت هو معدن محلي شائع تم استخدامه للأغراض الطبية والصناعية منذ العصور القديمة.
ويتشكل في مناجم الملح، على شكل رواسب حول البراكين وداخل الطبقات الرسوبية. ويعد حمض الكبريتيك، المشتق الرئيسي للكبريت، من أهم المواد الكيميائية غير العضوية المستخدمة في التجارة والكيمياء وإنتاج الأسمدة. كان من المعتاد أن يكون استهلاك الأحماض أحد أفضل مؤشرات التنمية الصناعية في أي بلد.
ويشبه لون المعدن لون سطح قمر المشتري آيو، وهو ما يفسره العمليات البركانية التي ينتج عنها تكوين الكبريت.

الاسم الإنجليزي الكبريت يأتي من الكلمة اللاتينية، وهو ما يعني "الكبريت".
وفقًا للتصنيف، تنتمي فئة دانا إلى فئة العناصر الأصلية ذات العناصر شبه المعدنية وغير المعدنية، وهي مجموعة من الأشكال المتعددة.
تصنيف
هناك نوع فرعي من الكبريت هو روسيتسكيت، وهو متعدد الأشكال غير عادي من المعدن. يتبلور في نظام أحادي الميل، في حين أن بلورات الكبريت تكون معينية تقويمية.
التركيب الكيميائي
يتكون الكبريت الأصلي من العنصر الكيميائي الذي يحمل نفس الاسم (S8). في الجدول الدوري للعناصر الكيميائية له العدد الذري 16. الوزن الجزيئي هو 256.53 جم.
الخصائص الفيزيائية
- مقياس موس لصلابة المعادن: 2 (مشابه للجبس)؛
- الثقل النوعي: 2؛
- الكثافة: 2.05-2.09 (متوسط - 2.06)؛
- الشفافية: شذرات شفافة إلى شفافة؛
- اللون: الأصفر والبني أو الأخضر والأصفر والبرتقالي والأبيض.
- لون الشرطة: أبيض؛
- تألق من الزجاج إلى الفراولة.
- الانقسام (الكسر): محاري (محاري)، غير متساو؛
- العادة: منشورية، مسحوقية، على شكل الكلى (مثل الهيماتيت)؛
- التلألؤ: ليس الفلورسنت.
الأداء البصري
وتجدر الإشارة إلى أن انخفاض معامل التوصيل الكهربائي يؤثر على هشاشة المعدن عند تسخينه.
الإنتاج (المجال)
يأتي الاستخراج الأولي للكبريت الأصلي في المقام الأول من رواسب الصخور ذات القبة الملحية التي تحتوي على المعدن. ويتشكل أيضًا من البيريت (كبريتيد الحديد، FeS2)، من رواسب الرمال في كندا ويتم استخلاصه كمنتج ثانوي في المصاهر والمنشآت الصناعية وتكرير البترول والبنزين والغاز الطبيعي.

بلغ إجمالي إنتاج الكبريت العالمي في عام 2013 69 مليون طن، تم الحصول على حوالي 50٪ منه كمنتج ثانوي من تطوير حقول النفط والغاز الطبيعي. وتبلغ الحصة المباشرة لاستخراج المعادن 30% من حجم الإنتاج.
ينتشر الكبريت على نطاق واسع باعتباره رواسب محلية بالقرب من البراكين والينابيع الساخنة. وهو أحد مكونات معادن الكبريتيد، على سبيل المثال، الجالينا، والبيريت، والسفاليريت، وما إلى ذلك، ويوجد أيضًا في النيازك. توجد رواسب كبيرة على طول ساحل الخليج، وكذلك في رواسب كبيرة من مجموعات الرواسب المتبخرة في أوروبا الشرقية وغرب آسيا، والتي من المرجح أن تكون نتيجة التدمير البكتيري لمعادن الكبريتات.
منجم الفانيليا في مقاطعة قادس، الأندلس، إسبانيا، هو مستودع أوروبي تاريخي للمعدن.
والمنجمان الآخران هما منجم موتشو في تارنوبرزيج في بولندا ومنجم فوينسكوي في منطقة سامارا في روسيا.
تم العثور على رواسب المعدن بالقرب من الينابيع الساخنة والمناطق البركانية في أجزاء كثيرة من العالم، وخاصة على طول حزام النار في المحيط الهادئ. ويجري حاليًا تطوير مثل هذه الودائع في إندونيسيا وشيلي واليابان. وهذه الرواسب متعددة البلورات، وكانت أبعاد العينة الأكبر 22*16*11 سم.

تاريخيًا، كانت صقلية موردًا رئيسيًا للمعادن خلال الثورة الصناعية. على الأرض، وكذلك على قمر المشتري آيو، يتشكل العنصر أثناء الانبعاثات البركانية، بما في ذلك الانبعاثات من الفتحات الحرارية المائية.
خلال عام 2015، تم إنتاج 70 مليون طن من الكبريت في جميع أنحاء العالم. وتشمل أكبر 12 دولة منتجة للمعادن الصين والولايات المتحدة وروسيا وكندا وألمانيا واليابان والمملكة العربية السعودية والهند وكازاخستان وإيران والإمارات العربية المتحدة والمكسيك.
التاريخ (الأساطير)
ولكونه سهل الوصول إليه، فقد كان المعدن معروفًا في العصور القديمة، بل وقد تم ذكره في الكتاب المقدس. يذكر نص الكتاب المقدس الكبريت فيما يتعلق بـ "خطبة النار" التي يتم فيها تذكير أبناء الرعية باللعنة الأبدية على غير المؤمنين وغير التائبين.
وفقا لبردية إيبرس (واحدة من أقدم المخطوطات الطبية الباقية)، تم استخدام مرهم الكبريت في مصر القديمة لعلاج الجفون الحبيبية. تذكر ملحمة هوميروس أن المعدن كان يستخدم للتطهير. في الكتاب 35 من التاريخ الطبيعي، يفحص بليني الأكبر المعدن، مشيرًا إلى أن أفضل مصادره موجودة في جزيرة ميلوس. وأشار إلى أنه يستخدم في التطهير وفي الطب وفي تبييض الملابس.

الكبريت الأصلي في شكله الطبيعي معروف في الصين منذ القرن السادس قبل الميلاد. هناك تم اكتشافه لأول مرة في هانتشونغ. بحلول القرن الثالث، اكتشف الصينيون أنه يمكن استخراج المعدن من البيريت.
أعطى الكيميائيون الأوائل للمعدن رمزًا كيميائيًا خاصًا به - صليب به مثلث في الأعلى.
في علاجات الجلد التقليدية ما قبل الحديثة، تم استخدام المعدن في الكريمات لتخفيف حالات مثل الجرب والقوباء الحلقية والصدفية والأكزيما وحب الشباب.
النطاق والنطاق
الاستخدام التجاري الرئيسي للمعدن هو في إنتاج حامض الكبريتيك H2SO4. ويستخدم بدوره لإنتاج الأسمدة وهو أساس العديد من عمليات الإنتاج. استخدامات أخرى:
- مبيدات الفطريات.
- المبيدات الحشرية.
- مكون من البارود المدفعية.
الكبريت النقي عديم الرائحة، وتتكون رائحة البيض الفاسد المميزة المرتبطة بالمعدن عندما يخلط المسحوق مع الماء، مما يؤدي إلى إنتاج غاز كبريتيد الهيدروجين (H2S).
الخصائص الطبية
يلعب الكبريت دورًا حاسمًا في إزالة السموم، لأنه جزء من أحد أهم مضادات الأكسدة التي ينتجها الجسم - الجلوتاثيون.
الكبريت هو جزء من بعض الأحماض الأمينية في جسم الإنسان ويدخل في تخليق البروتين، بالإضافة إلى العديد من التفاعلات الإنزيمية. ويشارك في إنتاج الكولاجين، وهي المادة التي تشكل الأنسجة الضامة والخلايا وجدران الشرايين. بالإضافة إلى أنه جزء من الكيراتين الذي يعطي القوة للشعر والجلد والأظافر.
التهاب المفاصل
وفقا لجامعة ميريلاند بالولايات المتحدة الأمريكية، فإن مكملات الكبريت لها تأثير إيجابي على علاج هشاشة العظام والتهاب المفاصل الروماتويدي والتهاب المفاصل الصدفي. تعمل حمامات الكبريت أو الطين على تخفيف التورم الناتج عن التهاب المفاصل. إن وضع كريم يحتوي على ثنائي ميثيل سلفوكسيد قد يقلل الألم في بعض أنواع التهاب المفاصل. تناول مكمل غذائي يحتوي على 6 ملغ من كبريت ميثيل سلفنيل ميثان يخفف من آلام التهاب المفاصل، وعندما يقترن بالجلوكوزامين يكون تأثيره أكبر.
أمراض جلدية
وقد ثبت التأثير الإيجابي لاستخدام الكبريت على الأمراض الجلدية، بما في ذلك حب الشباب والصدفية والثآليل والقشرة والأكزيما والتهاب الجريبات. يتم استخدام الكريمات والمستحضرات والصابون التي تحتوي على الكبريت لتخفيف التورم والاحمرار الناجم عن حب الشباب. يتم علاج التهاب الجلد والجرب باستخدام مرهم كبريتيد متخصص.
المكملات الغذائية
لا توجد متطلبات محددة لتناول كميات إضافية من الكبريت في الطعام، حيث يتم امتصاص الكمية المطلوبة مع الطعام العادي. ويوجد في الأطعمة الغنية بالبروتين الحيواني مثل منتجات الألبان والبيض ولحم البقر والدواجن والمأكولات البحرية. على وجه الخصوص، يعد صفار البيض أحد المصادر عالية الجودة للكبريت. يمكنك أيضًا زيادة استهلاكه عن طريق إضافة البصل والثوم واللفت والملفوف والأعشاب البحرية والتوت إلى طعامك. المكسرات هي مصدر إضافي للكبريت النباتي.

ويدرك العلماء أن نقص هذا العنصر في الجسم قد يكون أحد أسباب الإصابة بمرض الزهايمر الذي تتزايد حالات الإصابة به كل عام.
تجدر الإشارة إلى أنه بدون كمية كافية من الكبريت، يتم انتهاك عملية التمثيل الغذائي. وهذا بدوره يؤدي إلى تلف الخلايا العضلية والدهنية، ونتيجة لذلك، يسبب عدم تحمل الجلوكوز. تحدث حالة خطيرة في الجسم تُعرف باسم المتلازمة الأيضية عندما يعوض الجسم الخلل في استقلاب الجلوكوز ويكتسب الوزن.
ويربط بعض الباحثين بين نقص الكبريت في الجسم وانتشار أمراض القلب.
الآثار الصحية لاستهلاك الأطعمة التي تحتوي على الكبريت
يتم تصنيف البلدان التي يستهلك سكانها المزيد من الكبريت في طعامهم من بين البلدان الأكثر صحة
تعد اليونان وإيطاليا واليابان الموردين الرئيسيين للكبريت للعالم كله. أليس من قبيل الصدفة أن هذه البلدان لديها أدنى معدلات الإصابة بأمراض القلب والسمنة؟ على الأرجح لا. الأيسلنديون هم الأقل عرضة للمعاناة من الاكتئاب والسمنة والسكري وأمراض القلب والأوعية الدموية.
ويربط بعض الباحثين هذه المؤشرات بالحزام البركاني في البلاد. تغطي الانفجارات الدورية الأرض بصخور تحتوي على الكبريتات. تسمح هذه التربة المخصبة للنباتات والحيوانات بالنمو. في المقابل، فإن سكان البلاد الذين يتناولون المنتجات المغسولة يحسنون صحتهم بشكل كبير.

وكان يُعتقد في السابق أن النظام الغذائي للآيسلنديين يحميهم من الأمراض المزمنة بفضل الأسماك. ومع ذلك، لم يتم تأكيد النظرية، حيث أن الآيسلنديين الذين انتقلوا إلى كندا واستمروا في تناول كميات كبيرة من الأسماك كانوا أكثر عرضة للإصابة بالأمراض مقارنة بالسكان الذين لم يهاجروا. وهكذا تلعب التربة الأيسلندية المخصبة بالكبريت دورًا حاسمًا في ضمان المناعة وحصول الجسم على ما يكفي من المعدن.
الاستخدام المنزلي
يستخدم الكبريت في المقام الأول كمقدمة للمواد الكيميائية الأخرى. يتم تحويل ما يقرب من 85٪ من المنتج إلى حمض الكبريتيك. ونظرًا لأهميتها بالنسبة للاقتصاد العالمي، فإن إنتاجها واستهلاكها يعد مؤشرًا على التطور الصناعي لأي بلد.
الاستخدام الرئيسي للحمض هو في استخراج خامات الفوسفات لإنتاج الأسمدة. كما أنها تستخدم لتكرير النفط ومعالجة مياه الصرف الصحي والتعدين. يتفاعل الكبريت مباشرة مع الميثان ليشكل ثاني كبريتيد الكربون، الذي يستخدم في صناعة السيلوفان والرايون.

أحد التطبيقات المهمة للمعدن هو في فلكنة المطاط، حيث تشكل البوليسلفيدات بوليمرات عضوية مرتبطة. وهي تستخدم على نطاق واسع في تبييض الورق وكمواد حافظة في الفواكه المجففة. العديد من المواد الخافضة للتوتر السطحي ومشتقاتها، مثل كبريتات لوريل الصوديوم، هي مشتقات كبريتات.
على الرغم من أن المعدن غير قابل للذوبان في الماء، إلا أنه أحد العناصر الأكثر تنوعًا في تكوين المركبات. يتفاعل الكبريت ويكوّن مركبات مع جميع العناصر الكيميائية ما عدا الذهب واليود والإيريديوم والنيتروجين والبلاتين والتيلوريوم والغازات النبيلة.

المعلومات أدناه ستقنع الجميع بأن المعدن منتشر على نطاق واسع وموجود حرفيًا في كل مكان:
- يحتل المرتبة 11 من حيث الكمية في جسم الإنسان؛
- يحتل المركز السادس في تكوين مياه البحر.
- 14- حسب الانتشار في القشرة الأرضية و 9- على الكوكب؛
- يُغلق العناصر العشرة الأكثر شيوعًا في النظام الشمسي والكون.
رعاية الحجر
عندما تتبلل العينات المعدنية، فإنها تشكل كبريتيد الهيدروجين، مما يؤدي إلى تدميرها. ولمنع ذلك، لا ينصح بتخزين المعدن في ظروف رطبة. يمكن أن يتسبب الماء الدافئ في تحطيم شذرات.

عند تعرضها للحرارة، قد تتشقق العينات. عند العمل مع المعدن، يجب عليك تجنب الاتصال المفرط به، وكذلك تخزينه في غرفة مظلمة.
الكبريت الأصفر النقي
معدن من فئة العناصر الأصلية. يعد الكبريت مثالاً على تعدد الأشكال التماثلية المحددة جيدًا. في الطبيعة يشكل تعديلين متعددي الأشكال: الكبريت أ-مقوم العظام والكبريت أحادي الميل. عند الضغط الجوي ودرجة الحرارة 95.6 درجة مئوية، يتحول الكبريت أ إلى الكبريت ب. يعتبر الكبريت عنصراً حيوياً لنمو النباتات والحيوانات، فهو جزء من الكائنات الحية ومنتجات تحللها، ويوجد بكثرة فيه، على سبيل المثال، في البيض، والملفوف، والفجل، والثوم، والخردل، والبصل، والشعر، والصوف وغيرها؛ . كما أنه موجود في الفحم والنفط.
أنظر أيضا:
بناء

عادة ما يتم تمثيل الكبريت الأصلي بالكبريت، الذي يتبلور في النظام المعيني، نوع التماثل المعيني ثنائي الهرم. الكبريت البلوري له تعديلان؛ إحداها، المعينية التقويمية، يتم الحصول عليها من محلول الكبريت في ثاني كبريتيد الكربون (CS 2) عن طريق تبخير المذيب في درجة حرارة الغرفة. في هذه الحالة، يتم تشكيل بلورات شفافة على شكل الماس من اللون الأصفر الفاتح، قابلة للذوبان بسهولة في CS 2. هذا التعديل مستقر حتى 96 درجة مئوية؛ عند درجات حرارة أعلى يكون الشكل أحادي الميل مستقرًا. مع التبريد الطبيعي للكبريت المنصهر في البوتقات الأسطوانية، تنمو بلورات كبيرة من تعديل تقويم العظام ذات شكل مشوه (أوكتاهيدرا بزوايا أو وجوه "مقطوعة" جزئيًا). وتسمى هذه المادة في الصناعة بالكبريت المقطوع. التعديل أحادي الميل للكبريت عبارة عن بلورات إبرة صفراء داكنة طويلة وشفافة، قابلة للذوبان أيضًا في CS 2. عندما يتم تبريد الكبريت أحادي الميل إلى أقل من 96 درجة مئوية، يتم تشكيل كبريت أصفر محدد أكثر استقرارا.
ملكيات

الكبريت الأصلي أصفر اللون، في وجود شوائب يكون أصفر-بني، برتقالي، بني إلى أسود؛ يحتوي على شوائب من البيتومين والكربونات والكبريتات والطين. تكون بلورات الكبريت النقي شفافة أو نصف شفافة، وتكون الكتل الصلبة شفافة عند الحواف. اللمعان راتنجي إلى دهني. صلابة 1-2، لا انقسام، كسر محاري. الكثافة 2.05-2.08 جم/سم3، هشة. قابل للذوبان بسهولة في كندا البلسم وزيت التربنتين والكيروسين. غير قابلة للذوبان في حمض الهيدروكلوريك وH2SO4. يقوم HNO 3 والماء الملكي بأكسدة الكبريت وتحويله إلى H 2 SO 4. ويختلف الكبريت بشكل كبير عن الأكسجين في قدرته على تكوين سلاسل ودورات مستقرة من الذرات.
الأكثر استقرارًا هي جزيئات S8 الحلقية، التي لها شكل التاج، وتشكل كبريتًا معينيًا وكبريتًا أحادي الميل. هذا كبريت بلوري - مادة صفراء هشة. بالإضافة إلى ذلك، من الممكن وجود جزيئات ذات سلاسل مغلقة (S 4، S 6) وسلاسل مفتوحة. تحتوي هذه التركيبة على كبريت بلاستيكي، وهو مادة بنية يتم الحصول عليها عن طريق التبريد الحاد للكبريت المنصهر (يصبح الكبريت البلاستيكي هشًا بعد بضع ساعات، ويكتسب لونًا أصفر ويتحول تدريجيًا إلى معيني). غالبًا ما تتم كتابة صيغة الكبريت ببساطة S، لأنه على الرغم من أن له بنية جزيئية، إلا أنه عبارة عن خليط من مواد بسيطة مع جزيئات مختلفة.
ويصاحب ذوبان الكبريت زيادة ملحوظة في الحجم (حوالي 15٪). الكبريت المنصهر هو سائل أصفر اللون سهل الحركة، ويتحول عند درجة حرارة أعلى من 160 درجة مئوية إلى كتلة بنية داكنة شديدة اللزوجة. يكتسب ذوبان الكبريت أعلى لزوجة عند درجة حرارة 190 درجة مئوية؛ ويصاحب الزيادة الإضافية في درجة الحرارة انخفاض في اللزوجة وفوق 300 درجة مئوية يصبح الكبريت المنصهر متحركًا مرة أخرى. وذلك لأنه عندما يتم تسخين الكبريت، فإنه يتبلمر تدريجياً، مما يزيد طول السلسلة مع زيادة درجة الحرارة. عندما يتم تسخين الكبريت فوق 190 درجة مئوية، تبدأ وحدات البوليمر في الانهيار.
يمكن أن يكون الكبريت بمثابة أبسط مثال على الإلكتريت. عند فرك الكبريت يكتسب شحنة سالبة قوية.
مورفولوجية

تشكل بلورات هرمية ثنائية مبتورة ، وفي كثير من الأحيان بلورات هرمية ثنائية ، أو صينوية أو منشورية سميكة ، بالإضافة إلى مجاميع بلورية كثيفة ، ومتموجة ، وحبيبية ، وفي كثير من الأحيان مجاميع ليفية دقيقة. الأشكال الرئيسية في البلورات: الأهرامات الثنائية (111) و (113)، المنشور (011) و (101)، بيناكويد (001). أيضًا التداخلات والبلورات من البلورات والبلورات الهيكلية والهوابط الكاذبة والكتل المسحوقية والترابية والرواسب والمواد اللاصقة. تتميز البلورات بنمو متوازي متعدد.
أصل

يتشكل الكبريت أثناء الانفجارات البركانية، أثناء تجوية الكبريتيدات، أثناء تحلل الطبقات الرسوبية الحاملة للجبس، وكذلك فيما يتعلق بنشاط البكتيريا. الأنواع الرئيسية من رواسب الكبريت المحلية هي بركانية وخارجية (كيميائية رسوبية). الودائع الخارجية هي السائدة. وهي مرتبطة بأنهيدريت الجبس، والتي، تحت تأثير انبعاثات الهيدروكربون وكبريتيد الهيدروجين، يتم تقليلها واستبدالها بخامات الكبريت والكالسيت. جميع الرواسب الرئيسية لديها مثل هذا التكوين التسلل الميتازوماتي. غالبًا ما يتشكل الكبريت الأصلي (باستثناء التراكمات الكبيرة) نتيجة لأكسدة H 2 S. يتم تنشيط العمليات الجيوكيميائية لتكوينه بشكل كبير بواسطة الكائنات الحية الدقيقة (بكتيريا تقليل الكبريتات والثيون). المعادن المرتبطة هي الكالسيت، الأراغونيت، الجبس، الأنهيدريت، السيليستيت، وأحيانا القار. من بين الرواسب البركانية للكبريت الأصلي، الرواسب الرئيسية هي الرواسب الحرارية المائية الميتاسوماتية (على سبيل المثال، في اليابان)، والتي تتكون من الكوارتزيت والأوباليت الحامل للكبريت، والطمي الحامل للكبريت الرسوبي البركاني في البحيرات البركانية. يتم تشكيله أيضًا أثناء نشاط الفومارول. يتكون الكبريت الأصلي في ظل ظروف سطح الأرض، ولا يزال غير مستقر للغاية، ويتأكسد تدريجيًا، ويؤدي إلى ظهور الكبريتات، الفصل. مثل الجص.
يستخدم في إنتاج حامض الكبريتيك (حوالي 50% من الكمية المستخرجة). في عام 1890، اقترح هيرمان فراش صهر الكبريت تحت الأرض واستخراجه إلى السطح من خلال الآبار، وحاليا يتم تطوير رواسب الكبريت بشكل رئيسي عن طريق صهر الكبريت الأصلي من الطبقات الجوفية مباشرة في موقعه. كما يوجد الكبريت بكميات كبيرة في الغاز الطبيعي (على شكل كبريتيد الهيدروجين وثاني أكسيد الكبريت، أثناء إنتاج الغاز، ويترسب على جدران الأنابيب، مما يجعلها غير صالحة للتشغيل، لذلك يتم استخلاصه من الغاز في أسرع وقت ممكن)؛ بعد الإنتاج.
طلب

ويستخدم ما يقرب من نصف الكبريت المنتج في إنتاج حامض الكبريتيك. يستخدم الكبريت في الفلكنة المطاط، كمبيد للفطريات في الزراعة وككبريت غرواني - منتج طبي. كما يستخدم الكبريت الموجود في تركيبات القار الكبريتية لإنتاج الأسفلت الكبريتي، وكبديل للأسمنت البورتلاندي لإنتاج الخرسانة الكبريتية. يستخدم الكبريت لإنتاج تركيبات الألعاب النارية، وكان يستخدم سابقًا في إنتاج البارود، ويستخدم في إنتاج أعواد الثقاب.
الكبريت (المهندس الكبريت) - س
تصنيف
| سترونز (الطبعة الثامنة) | 1/ب.03-10 |
| نيكل سترونز (الطبعة العاشرة) | 1.CC.05 |
| دانا (الطبعة السابعة) | 1.3.4.1 |
| دانا (الطبعة الثامنة) | 1.3.5.1 |
| يا المرجع CIM. | 1.51 |
الكبريت (المعدنية) - غالبًا ما توجد في شكلها الأصلي، وتشكل كتلًا كثيفة أو ترابية أو مجاميع بلورية على شكل براريق بلورية وأفلام ولويحات. هناك أيضًا بلورات جيدة التكوين تصل إلى أحجام كبيرة. تنتمي بلورات S. الأصلية إلى نظام تقويم العظام (فئة الهرم ثنائي الهرم) ولها عادة هرمية، انظر الشكل 1. رقم 1 و 2. في بعض الأحيان، بسبب التطور غير المتكافئ لطائرات الهرم الثنائي، يتم الحصول على شكل بلوري وتدي. الأشكال الأكثر شيوعًا الموجودة على بلورات S.: الهرم الثنائي المعيني الرئيسي (111)P، ومحاورها هي أ:ب:مع= 0.8138:1:1.9076؛ بالإضافة إلى: (١١٣)ق؛ (011) ن و (001) ق. تنمو البلورات أحيانًا معًا في وضع مزدوج. عند الانقسام، فإنه يكشف عن كسر محاري مميز. صلابة S. ضئيلة، 1.5-2.5 (على مقياس موس). الثقل النوعي 1.9-2.1. يختلف لون S. الأصلي (عن الشوائب الأجنبية للسيلينيوم وكبريتيد الزرنيخ والمواد العضوية): أصفر عسلي وأصفر كبريتي ورمادي وبني. اللمعان دهني، يشبه الماس تقريبًا. يتميز S. بانكسار مزدوج قوي، والذي، إذا كانت البلورة شفافة، يمكن ملاحظتها (كما هو الحال في أيسلندا الصاري) مباشرة، دون أي أدوات. بصريا سلبي. يقع مستوى المحاور البصرية في القسم العضدي القطري. زاوية بصرية 2 محاور ص= 69° 40′. لمعرفة خصائص S. الأخرى، راجع الجزء الكيميائي من المقالة. يتشكل Native S. في الطبيعة بطرق مختلفة. وتحدث الكميات الأكبر عن طريق المياه من المصادر، وبشكل عام، المياه المنتشرة في أعماق القشرة الأرضية والتي تحتوي على كبريتيد الهيدروجين. هذا الأخير، عند تعرضه للأكسجين الجوي، يتأكسد ويشكل الماء ويطلق C. وتتشكل مصادر مماثلة حيث توجد رواسب الجبس والمواد العضوية. بسبب عدد من التحولات الكيميائية، يتم تشكيل كبريتيد الهيدروجين من الجبس تحت تأثير المواد العضوية والماء، ومن الأخير - كبريتيد الهيدروجين. يفسر هذا الأصل التواجد المشترك للجبس والجير ومصادر الكبريت وكبريتيد الهيدروجين و. المواد العضوية. في بعض الأحيان يكون S. الأصلي مجاورًا بشكل وثيق وحتى مدمج في بلورات الجبس الكبيرة. يظهر S. في الغالب على شكل عروق وأعشاش ومضغ في الطين والمرل والجبس. هذه هي الرواسب الأكثر شهرة في صقلية وأراغونيا وكرواتيا وداغستان وبولندا وشفاه كازان. الطريقة الثانية لتشكيل S. هي بركانية. وتترسب على طول جدران الفوهات البركانية إما نتيجة التسامي المباشر، أو نتيجة تفاعل كبريتيد الهيدروجين وثاني أكسيد الكبريت، والذي يعد وجوده شائعا جدا في منتجات النشاط البركاني. يتم تفسير عزل S. بالمعادلة: 2H 2 S + SO 2 = 2H 2 O + 3S. أخيرًا، على ما يبدو، يتشكل الكبريت في الطبيعة بطريقة ثالثة: يمكن لمركبات الكبريت من المعادن أثناء الأكسدة إطلاق الكبريت الحر، وهذا يمكن أن يفسر التواجد المشترك للأخير، على سبيل المثال، مع بيريتات الكبريت (رواسب سويمونوفسكوي في جبال الأورال، ريو). تينتو في إسبانيا). حول كمية S. المستخرجة سنويا واستخدامها -
 FizMat: دالة تربيعية
FizMat: دالة تربيعية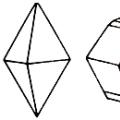 الخصائص الفيزيائية وصور الكبريت كيف يبدو الكبريت الطبيعي
الخصائص الفيزيائية وصور الكبريت كيف يبدو الكبريت الطبيعي يوم المجد العسكري لروسيا – يوم معركة بورودينو
يوم المجد العسكري لروسيا – يوم معركة بورودينو