التفاعلات الكيميائية للهالوجينات مع الأملاح. الهالوجينات – هايبر ماركت المعرفة
من كتاب الكيمياء المدرسي، يعرف الكثير من الناس أن الهالوجينات تتضمن عناصر كيميائية للنظام الدوري لمندليف من المجموعة 17 في الجدول.
ترجمت من اليونانية باسم الولادة والأصل. جميعها تقريبًا نشطة للغاية، ولهذا السبب تتفاعل بعنف مع المواد البسيطة، باستثناء عدد قليل من اللافلزات. ما هي الهالوجينات وما هي خصائصها؟
في تواصل مع
قائمة الهالوجينات
الهالوجينات هي عوامل مؤكسدة جيدة، ولهذا السبب، لا يمكن العثور عليها في الطبيعة إلا في بعض المركبات. كلما زاد العدد الذري، قل النشاط الكيميائي لعناصر هذه المجموعة. تتضمن مجموعة الهالوجين العناصر التالية:
- الكلور (الكلور)؛
- الفلور (F)؛
- اليود (أنا) ؛
- البروم (ر)؛
- أستاتين (في).
وقد تم تطوير هذا الأخير في معهد البحوث النووية الذي يقع في مدينة دوبنا. الفلور هو غاز سام ذو لون أصفر شاحب. الكلور سام أيضًا. هذا غاز له رائحة نفاذة وغير سارة إلى حد ما من اللون الأخضر الفاتح. يحتوي البروم على لون بني محمر وهو سائل سام يمكن أن يؤثر حتى على حاسة الشم. وهو شديد التقلب، لذلك يتم تخزينه في أمبولات. اليود هو مادة بلورية، سهلة التسامي، ذات لون أرجواني داكن. الأستاتين مشع، لونه بلوري: أسود مع أزرق، نصف عمره 8.1 ساعة.
 يتناقص نشاط الأكسدة العالي للهالوجينات من الفلور إلى اليود. وأنشط إخوانه هو الفلور الذي لديه القدرة على التفاعل مع أي معادن وتكوين الأملاحوبعضها يشتعل تلقائيًا، ويطلق كمية هائلة من الحرارة. وبدون تسخين، يتفاعل هذا العنصر مع جميع المواد غير المعدنية تقريبًا، تكون التفاعلات مصحوبة بإطلاق كمية معينة من الحرارة (طاردة للحرارة).
يتناقص نشاط الأكسدة العالي للهالوجينات من الفلور إلى اليود. وأنشط إخوانه هو الفلور الذي لديه القدرة على التفاعل مع أي معادن وتكوين الأملاحوبعضها يشتعل تلقائيًا، ويطلق كمية هائلة من الحرارة. وبدون تسخين، يتفاعل هذا العنصر مع جميع المواد غير المعدنية تقريبًا، تكون التفاعلات مصحوبة بإطلاق كمية معينة من الحرارة (طاردة للحرارة).
يتفاعل الفلور مع الغازات الخاملة ويتم تشعيعه (Xe + F 2 = XeF 2 + 152 كيلوجول). عند تسخينه، يؤثر الفلور على الهالوجينات الأخرى، ويؤكسدها. تحمل الصيغة: Hal 2 + F 2 = 2HalF، حيث Hal = Cl، Br، I، At، في الحالة التي تكون فيها حالات أكسدة النصف للكلور والبروم واليود والأستاتين مساوية لـ + 1.
يتفاعل الفلور أيضًا بقوة مع المواد المعقدة. والنتيجة هي أكسدة الماء. في هذه الحالة، يحدث تفاعل متفجر، وهو مكتوب باختصار بالصيغة: 3F 2 + ZH 2 O = OF 2 + 4HF + H 2 O 2.
الكلور
نشاط الكلور الحر أقل بقليل من الفلور، لكنه يتمتع أيضًا بقدرة جيدة على التفاعل. ويمكن أن يحدث هذا عند التفاعل مع العديد من المواد البسيطة، مع استثناءات نادرة في شكل الأكسجين والنيتروجين والغازات الخاملة. هو يمكن أن تتفاعل بعنف مع المواد المعقدة، إنشاء تفاعلات بديلة، خاصية إضافة الهيدروكربونات متأصلة أيضًا في الكلور. عند تسخينها، يتم إزاحة البروم أو اليود من المركبات التي تحتوي على الهيدروجين أو المعادن.
 هذا العنصر له علاقة غريبة مع الهيدروجين. وفي درجة حرارة الغرفة ودون التعرض للضوء، لا يتفاعل الكلور بأي شكل من الأشكال مع هذا الغاز، ولكن بمجرد تسخينه أو توجيهه نحو الضوء، سيحدث تفاعل متسلسل متفجر. الصيغة موضحة أدناه:
هذا العنصر له علاقة غريبة مع الهيدروجين. وفي درجة حرارة الغرفة ودون التعرض للضوء، لا يتفاعل الكلور بأي شكل من الأشكال مع هذا الغاز، ولكن بمجرد تسخينه أو توجيهه نحو الضوء، سيحدث تفاعل متسلسل متفجر. الصيغة موضحة أدناه:
Cl2+ حν → 2Cl، Cl + H2 → HCl + H، H + Cl2 → HCl + Cl، Cl + H2 → HCl + H، إلخ.
تتسبب الفوتونات عند استثارتها في تحلل جزيئات Cl 2 إلى ذرات، ويحدث تفاعل متسلسل يؤدي إلى ظهور جسيمات جديدة تبدأ بداية المرحلة التالية. تمت دراسة هذه الظاهرة في تاريخ الكيمياء. الكيميائي الروسي والحائز على جائزة نوبل إن إن سيمينوف. في عام 1956 درس التفاعل المتسلسل الكيميائي الضوئي، وبالتالي قدم مساهمة كبيرة في العلوم.
يتفاعل الكلور مع العديد من المواد المعقدة، وهي تفاعلات الاستبدال والإضافة. يذوب جيدا في الماء.
Cl 2 + H 2 O = HCl + HClO - 25 كيلوجول.
مع القلويات، عند تسخينها، يمكن للكلور غير متناسب.
البروم واليود والأستاتين
النشاط الكيميائي للبروم أقل قليلاً من نشاط الفلور أو الكلور المذكور أعلاه، ولكنه أيضًا مرتفع جدًا. غالبًا ما يستخدم البروم في شكل سائل. وهو، مثل الكلور، يذوب جيدًا في الماء. ويحدث معها تفاعل جزئي مما يسمح بالحصول على "ماء البروم".
يختلف النشاط الكيميائي لليود بشكل ملحوظ عن الممثلين الآخرين لهذه السلسلة. يكاد لا يتفاعل مع غير المعادن، ولكن مع يحدث التفاعل مع المعادن ببطء شديد وفقط عند تسخينه. في هذه الحالة، يحدث امتصاص كبير للحرارة (تفاعل ماص للحرارة)، وهو قابل للعكس بدرجة كبيرة. بجانب لا يمكن إذابة اليود في الماء بأي شكل من الأشكالوهذا لا يمكن تحقيقه حتى بالتسخين، ولهذا لا يوجد "ماء اليود" في الطبيعة. لا يمكن إذابة اليود إلا في محلول اليوديد. في هذه الحالة، يتم تشكيل الأنيونات المعقدة. في الطب، يسمى هذا المركب بمحلول لوغول.
يتفاعل الأستاتين مع المعادن والهيدروجين. في سلسلة الهالوجينات، يتناقص النشاط الكيميائي في الاتجاه من الفلور إلى الأستاتين. كل هالوجين في السلسلة F - At قادر على إزاحة العناصر اللاحقة من المركبات التي تحتوي على معادن أو هيدروجين. الأستاتين هو الأكثر سلبية من بين هذه العناصر. لكنه يتميز بالتفاعل مع المعادن.
طلب
الكيمياء راسخة في حياتنا وتتغلغل في جميع المجالات. لقد تعلم الإنسان استخدام الهالوجينات ومركباتها لمصلحته الخاصة. الأهمية البيولوجية للهالوجينات لا يمكن إنكارها. مجالات تطبيقهم مختلفة:
- الدواء؛
- علم العقاقير؛
- إنتاج مختلف أنواع البلاستيك والأصباغ وما إلى ذلك؛
- زراعة.
 يتم الحصول على المركب الطبيعي الكريوليت، وصيغته الكيميائية كما يلي: Na3AlF6 الألومنيوم. تستخدم مركبات الفلور على نطاق واسع في الإنتاج معاجين الأسنان. من المعروف أن الفلورايد يساعد في منع التسوس. يتم استخدام صبغة الكحول من اليود لتطهير وتعقيم الجروح.
يتم الحصول على المركب الطبيعي الكريوليت، وصيغته الكيميائية كما يلي: Na3AlF6 الألومنيوم. تستخدم مركبات الفلور على نطاق واسع في الإنتاج معاجين الأسنان. من المعروف أن الفلورايد يساعد في منع التسوس. يتم استخدام صبغة الكحول من اليود لتطهير وتعقيم الجروح.
لقد وجد الكلور الاستخدام الأكثر انتشارًا في حياتنا. نطاق تطبيقه متنوع للغاية. أمثلة على الاستخدام:
- إنتاج البلاستيك.
- الحصول على حمض الهيدروكلوريك.
- إنتاج الألياف الاصطناعية والمذيبات والمطاط وغيرها.
- تبييض الأقمشة (الكتان والقطن) والورق.
- تعقيم مياه الشرب. لكن الأوزون يستخدم بشكل متزايد لهذا الغرض، لأن استخدام الكلور ضار بجسم الإنسان.
- تطهير المباني
يجب أن نتذكر أن الهالوجينات مواد سامة للغاية. هذه الخاصية واضحة بشكل خاص في الفلور. يمكن أن تسبب الهالوجينات الاختناق وتهيج الجهاز التنفسي وتلف الأنسجة البيولوجية.
يمكن أن تكون أبخرة الكلور خطيرة للغاية، وكذلك رذاذ الفلور، الذي له رائحة باهتة ويمكن الشعور به بتركيزات عالية. قد يعاني الشخص من تأثير الاختناق. عند العمل مع مثل هذه الاتصالات، يجب اتخاذ الاحتياطات اللازمة.
طرق إنتاج الهالوجينات معقدة ومتنوعة. في الصناعة، يتم التعامل مع هذا بمتطلبات معينة، والتي يتم التقيد بها بدقة.
كيمياء العناصر
اللافلزات من المجموعة الفرعية VIIA
عناصر المجموعة الفرعية VIIA هي عناصر غير معدنية نموذجية ذات نسبة عالية
السالبية الكهربية، لديهم اسم المجموعة - "الهالوجينات".
أهم القضايا التي تناولتها المحاضرة
الخصائص العامة للمواد غير المعدنية للمجموعة الفرعية VIIA. التركيب الإلكتروني، أهم خصائص الذرات. الأكثر تميزا-
عقوبات الأكسدة ملامح كيمياء الهالوجينات.
مواد بسيطة.
مركبات طبيعية.
مركبات الهالوجين
الأحماض الهيدروهاليكية وأملاحها. الملح وحمض الهيدروفلوريك
فتحات والاستلام والتطبيق.
مجمعات هاليد.
مركبات الأكسجين الثنائية من الهالوجينات. عدم الاستقرار تقريبا
خصائص الأكسدة والاختزال للمواد البسيطة والمركبات المشتركة
الوحدات. تفاعلات عدم التناسب. مخططات لاتيمر.
المنفذ: |
رقم الحدث |
||||||||||||||||

كيمياء عناصر المجموعة الفرعية VIIA
الخصائص العامة
المنغنيز |
||||||||
التكنيتيوم |
||||||||
تتكون مجموعة VIIA من عناصر p: الفلور F، الكلور
Cl، البروم Br، اليود I والأستاتين At.
الصيغة العامة لإلكترونات التكافؤ هي ns 2 np 5.
جميع عناصر المجموعة VIIA هي عناصر غير معدنية نموذجية.
كما يتبين من التوزيع |
|||||||
إلكترونات التكافؤ |
|||||||
حسب مدارات الذرات |
إلكترون واحد فقط مفقود |
||||||
لتكوين غلاف مستقر بثمانية إلكترونات
صناديق، لهذا السبب لديهمهناك ميل قوي نحو
إضافة إلكترون.
جميع العناصر تشكل بسهولة شحنة واحدة بسيطة
نيويورك الأنيونات G - .
على شكل أنيونات بسيطة، توجد عناصر المجموعة VIIA في المياه الطبيعية وفي بلورات الأملاح الطبيعية، على سبيل المثال الهاليت NaCl، السيلفيت KCl، الفلوريت
CaF2.
اسم المجموعة العامة للعناصر VIIA-
مجموعة "الهالوجينات" أي "التي تولد الأملاح" يرجع إلى أن معظم مركباتها مع المعادن تكون مسبقة الذوبان.
هو ملح نموذجي (CaF2، NaCl، MgBr2، KI)، والذي
والتي يمكن الحصول عليها من خلال التفاعل المباشر
تفاعل المعدن مع الهالوجين. يتم الحصول على الهالوجينات الحرة من الأملاح الطبيعية، لذلك يُترجم اسم "الهالوجينات" أيضًا على أنه "مولود من الأملاح".
المنفذ: |
رقم الحدث |
||||||||||||||||

حالة الأكسدة الدنيا (-1) هي الأكثر استقرارًا
لجميع الهالوجينات.
بعض خصائص ذرات عناصر المجموعة VIIA مذكورة في
أهم خصائص ذرات عناصر المجموعة VIIA
نسبي- |
التقارب |
||||||
كهربائي |
|||||||
سلبي |
التأين, |
||||||
نيس (بحسب |
|||||||
الاقتراع) |
|||||||
زيادة في العدد |
|||||||
الطبقات الإلكترونية |
|||||||
زيادة في الحجم |
|||||||
تخفيض الكهربائية |
|||||||
سلبية ثلاثية |
الهالوجينات لها ألفة إلكترونية عالية (الحد الأقصى عند
Cl) وطاقة تأين عالية جدًا (الحد الأقصى عند F) والحد الأقصى
السالبية الكهربية المحتملة في كل فترة. الفلور هو الأكثر
السالبية الكهربائية لجميع العناصر الكيميائية.
يحدد وجود إلكترون واحد غير متزاوج في ذرات الهالوجين
يمثل اتحاد الذرات في المواد البسيطة في جزيئات ثنائية الذرة Г2.
بالنسبة للمواد البسيطة، الهالوجينات هي أكثر العوامل المؤكسدة المميزة
الخصائص التي تكون أقوى في F2 وتضعف عند الانتقال إلى I2.
تتميز الهالوجينات بأكبر تفاعلية بين جميع العناصر غير المعدنية. ويبرز الفلور، حتى بين الهالوجينات
لديه نشاط مرتفع للغاية.
ويختلف عنصر الدورة الثانية، الفلور، بقوة عن الآخر
عناصر أخرى من المجموعة الفرعية. وهذا هو النمط العام لجميع المعادن غير المعدنية.
المنفذ: |
رقم الحدث |
||||||||||||||||
الفلور، باعتباره العنصر الأكثر سالبية كهربية، لا يظهر الجنس
حالات الأكسدة المقيمة. في أي اتصال، بما في ذلك مع كي-
الأكسجين والفلور في حالة الأكسدة (-1).
تظهر جميع الهالوجينات الأخرى درجات أكسدة إيجابية
لينيا بحد أقصى +7.
حالات الأكسدة المميزة للهالوجينات:
ف: -1، 0؛
Cl، Br، I: -1، 0، +1، +3، +5، +7.
يحتوي Cl على أكاسيد معروفة توجد في حالات الأكسدة: +4 و+6.
أهم مركبات الهالوجين في الحالات الإيجابية
عقوبات الأكسدة هي الأحماض المحتوية على الأكسجين وأملاحها.
جميع مركبات الهالوجين في حالات الأكسدة الإيجابية هي
هي عوامل مؤكسدة قوية.
درجة رهيبة من الأكسدة.يتم تعزيز عدم التناسب من خلال البيئة القلوية.
تطبيق عملي للمواد البسيطة ومركبات الأكسجين
يرجع انخفاض الهالوجينات بشكل أساسي إلى تأثيرها المؤكسد.
أبسط المواد، Cl2، تجد أوسع تطبيق عملي.
وF2. يتم استهلاك أكبر كمية من الكلور والفلور في الصناعة
التخليق العضوي: في إنتاج البلاستيك، ومواد التبريد، والمذيبات،
المبيدات الحشرية، المخدرات. وتستخدم كميات كبيرة من الكلور واليود للحصول على المعادن وتكريرها. يستخدم الكلور أيضًا
لتبييض السليلوز، لتطهير مياه الشرب وفي الإنتاج
ماء التبييض وحمض الهيدروكلوريك. تستخدم أملاح الأحماض الأوكسية في إنتاج المتفجرات.
المنفذ: |
رقم الحدث |
||||||||||||||||

وتستخدم الأحماض - أحماض الهيدروكلوريك والأحماض المنصهرة - على نطاق واسع في الممارسة العملية.
يعد الفلور والكلور من بين العناصر العشرين الأكثر شيوعًا
هناك، هناك كمية أقل بكثير من البروم واليود في الطبيعة. جميع الهالوجينات تحدث في الطبيعة في حالة الأكسدة الخاصة بها(-1). يوجد اليود فقط على شكل ملح KIO3،
والذي يتم تضمينه كشوائب في الملح الصخري التشيلي (KNO3).
الأستاتين هو عنصر مشع يتم إنتاجه بشكل مصطنع (لا يوجد في الطبيعة). ينعكس عدم استقرار أت في الاسم الذي يأتي من اليونانية. "أستاتوس" - "غير مستقر". الأستاتين هو باعث مناسب للعلاج الإشعاعي للأورام السرطانية.
مواد بسيطة
تتشكل المواد البسيطة من الهالوجينات بواسطة جزيئات ثنائية الذرة G2.
في المواد البسيطة أثناء الانتقال من F2 إلى I2 مع زيادة عدد الإلكترونات
طبقات العرش وزيادة في استقطاب الذرات، هناك زيادة
التفاعل بين الجزيئات، مما يؤدي إلى تغيير في مجموع المشترك
الوقوف في ظل الظروف القياسية.
الفلور (في الظروف العادية) هو غاز أصفر، يتحول إلى -181 درجة مئوية
الحالة السائلة.
الكلور هو غاز أصفر مخضر يتحول إلى سائل عند -34 درجة مئوية.
يرتبط به اسم Cl، وهو يأتي من الكلمة اليونانية "كلوروس" - "أصفر-"
أخضر". زيادة حادة في درجة غليان Cl2 مقارنة بـ F2،
يشير إلى زيادة التفاعل بين الجزيئات.
البروم سائل أحمر داكن، شديد التطاير، يغلي عند درجة حرارة 58.8 درجة مئوية.
يرتبط اسم العنصر بالرائحة الكريهة الحادة للغاز وهو مشتق من
"بروموس" - "رائحة كريهة".
اليود - بلورات أرجوانية داكنة، ذات لون "معدني" باهت.
كتل، والتي عند تسخينها تتسامى بسهولة، وتشكل أبخرة بنفسجية؛
مع التبريد السريع |
أبخرة تصل إلى 114 درجة مئوية |
يتكون السائل. درجة حرارة |
|||||||||||||||||
المنفذ: |
رقم الحدث |
||||||||||||||||||
درجة غليان اليود هي 183 درجة مئوية. ويأتي اسمه من لون بخار اليود -
"يودوس" - "أرجواني".
جميع المواد البسيطة لها رائحة نفاذة وهي سامة.
استنشاق أبخرةها يسبب تهيج الأغشية المخاطية وأعضاء الجهاز التنفسي، وفي تركيزات عالية - الاختناق. خلال الحرب العالمية الأولى، تم استخدام الكلور كعامل سام.
يتسبب غاز الفلور والبروم السائل في حروق الجلد. العمل مع ها-
تسجيل الدخول، وينبغي اتخاذ الاحتياطات اللازمة.
حيث أن المواد البسيطة للهالوجينات تتشكل بواسطة جزيئات غير قطبية
تبرد، فإنها تذوب جيدًا في المذيبات العضوية غير القطبية:
الكحول والبنزين ورابع كلوريد الكربون، وما إلى ذلك. الكلور والبروم واليود قابلة للذوبان بشكل طفيف في الماء، وتسمى محاليلها المائية ماء الكلور والبروم واليود. يذوب Br2 بشكل أفضل من غيره، حيث أن تركيز البروم في المركب سات.
يصل المحلول إلى 0.2 مول / لتر والكلور - 0.1 مول / لتر.
الفلورايد يفكك الماء:
2F2 + 2H2 يا = O2 + 4HF
تظهر الهالوجينات نشاطًا مؤكسدًا عاليًا وانتقالًا
إلى أنيونات الهاليد.
Г2 + 2e– 2Г–
يمتلك الفلور نشاطًا مؤكسدًا عاليًا بشكل خاص. يؤكسد الفلور المعادن النبيلة (Au، Pt).
حزب العمال + 3F2 = PtF6
حتى أنه يتفاعل مع بعض الغازات الخاملة (الكريبتون،
الزينون والرادون)، على سبيل المثال،
Xe + 2F2 = XeF4
العديد من المركبات المستقرة للغاية تحترق في جو F2، على سبيل المثال.
الماء والكوارتز (SiO2).
SiO2 + 2F2 = SiF4 + O2
المنفذ: |
رقم الحدث |
||||||||||||||||

في التفاعلات مع الفلور، حتى العوامل المؤكسدة القوية مثل النيتروجين والكبريت
يعمل حمض النيكل كعوامل اختزال، بينما يعمل الفلور على أكسدة المدخلات
تحتوي على O(-2) في تركيبها.
2HNO3 + 4F2 = 2NF3 + 2HF + 3O2 H2 SO4 + 4F2 = SF6 + 2HF + 2O2
التفاعلية العالية لـ F2 تخلق صعوبات في اختيار المحتوى.
المواد الهيكلية للعمل معها. عادة لهذه الأغراض نستخدمها
هناك النيكل والنحاس، اللذان عند أكسدتهما يشكلان طبقات واقية كثيفة من الفلوريد على سطحهما. الاسم F يرجع إلى عملها العدواني.
أنا آكل، فهو يأتي من اليونانية. "الفلوروس" - "المدمرة".
في السلسلة F2، Cl2، Br2، I2، تضعف قدرة الأكسدة بسبب الزيادة
زيادة حجم الذرات وتقليل السالبية الكهربية.
في المحاليل المائية، خصائص الأكسدة والاختزال للمادة
عادة ما يتم وصف المواد باستخدام إمكانات القطب. يوضح الجدول جهود القطب القياسية (Eo، V) لتفاعلات الاختزال النصفية
تشكيل الهالوجينات. للمقارنة، قيمة Eo لـ ki-
الكربون هو العامل المؤكسد الأكثر شيوعا.
إمكانات القطب القياسية للمواد الهالوجينية البسيطة
Eo، B، لرد الفعل |
|||||||||||||
O2 + 4e– + 4H+ 2H2 O |
|||||||||||||
إيو، V |
|||||||||||||
للقطب |
|||||||||||||
2Г– +2е – = Г2 |
|||||||||||||
انخفاض النشاط التأكسدي
وكما يتبين من الجدول، F2 هو عامل مؤكسد أقوى بكثير،
من O2، وبالتالي فإن F2 لا يوجد في المحاليل المائية ، فهو يؤكسد الماء،
يتعافى إلى F–. إذا حكمنا من خلال قيمة Eо، فإن القدرة المؤكسدة لـ Cl2
المنفذ: |
رقم الحدث |
||||||||||||||||
كما أنها أعلى من نسبة O2. في الواقع، أثناء تخزين مياه الكلور على المدى الطويل، فإنها تتحلل مع إطلاق الأكسجين وتكوين حمض الهيدروكلوريك. لكن التفاعل بطيء (جزيء Cl2 أقوى بشكل ملحوظ من جزيء F2 و
طاقة التنشيط للتفاعلات مع الكلور أعلى)،
التقسيم:
Cl2 + H2 O حمض الهيدروكلوريك + HOCl
في الماء لا يصل إلى النهاية (K = 3.9 .10–4)، لذلك يوجد Cl2 في المحاليل المائية. يتميز Br2 وI2 بثبات أكبر في الماء.
عدم التناسب هو مادة مؤكسدة مميزة للغاية
رد فعل الاختزال للهالوجينات. عدم التناسب في التضخيم
يصب في بيئة قلوية.
يؤدي عدم تناسب Cl2 في القلويات إلى تكوين الأنيونات
الكلورين- و ClO-. ثابت عدم التناسب هو 7.5. 1015.
Cl2 + 2NaOH = NaCl + NaClO + H2O
عندما يكون اليود غير متناسب في القلويات، يتم تشكيل I– وIO3–. آنا-
منطقيا، Br2 لا يتناسب مع اليود. تغيير المنتج غير متناسب
الأمة يرجع إلى حقيقة أن الأنيونات GO– وGO2– في Br وI غير مستقرة.
يستخدم تفاعل عدم تناسب الكلور في الصناعة
القدرة على الحصول على مؤكسد هيبوكلوريت قوي وسريع المفعول،
تبييض الجير، ملح بيرثوليت.
3Cl2 + 6 KOH = 5KCl + KClO3 + 3H2O
المنفذ: |
رقم الحدث |
||||||||||||||||
تفاعل الهالوجينات مع المعادن
تتفاعل الهالوجينات بقوة مع العديد من المعادن، على سبيل المثال:
Mg + Cl2 = MgCl2 Ti + 2I2 TiI4
Na + هاليدات، حيث يكون المعدن ذو حالة أكسدة منخفضة (+1، +2)،
- وهي مركبات شبيهة بالأملاح ذات روابط أيونية في الغالب. كيف
لو، الهاليدات الأيونية هي مواد صلبة ذات نقطة انصهار عالية
هاليدات معدنية يكون فيها المعدن على درجة عالية من الأكسدة
هي مركبات ذات روابط تساهمية في الغالب.
العديد منها عبارة عن غازات أو سوائل أو مواد صلبة قابلة للانصهار في الظروف العادية. على سبيل المثال، WF6 عبارة عن غاز، وMoF6 سائل،
TiCl4 سائل.
تفاعل الهالوجينات مع اللافلزات
تتفاعل الهالوجينات بشكل مباشر مع العديد من اللافلزات:
الهيدروجين والفوسفور والكبريت وغيرها، على سبيل المثال:
H2 + Cl2 = 2HCl 2P + 3Br2 = 2PBr3 S + 3F2 = SF6
الترابط في الهاليدات اللافلزية يكون في الغالب تساهميًا.
عادةً ما تكون لهذه المركبات نقاط انصهار وغليان منخفضة.
عند الانتقال من الفلور إلى اليود، تزداد الطبيعة التساهمية للهاليدات.
الهاليدات التساهمية في اللافلزات النموذجية هي مركبات حمضية؛ عند تفاعلها مع الماء، فإنها تتحلل لتشكل الأحماض. على سبيل المثال:
PBr3 + 3H2 O = 3HBr + H3 PO3
PI3 + 3H2 O = 3HI + H3 PO3
PCl5 + 4H2 O = 5HCl + H3 PO4
المنفذ: |
رقم الحدث |
||||||||||||||||

يتم استخدام التفاعلين الأولين لإنتاج البروم ويوديد الهيدروجين.
حمض نويك.
الهاليدات البينية. تتحد الهالوجينات مع بعضها البعض لتشكل جزيئات متداخلة
يؤدي. في هذه المركبات، يكون الهالوجين الأخف والأكثر سالبية كهربية في حالة الأكسدة (-1)، والهالوجين الأثقل في الحالة الإيجابية.
عقوبات الأكسدة
نتيجة للتفاعل المباشر للهالوجينات عند التسخين يتم الحصول على ما يلي: ClF، BrF، BrCl، ICl. هناك أيضًا هاليدات أكثر تعقيدًا:
ClF3، BrF3، BrF5، IF5، IF7، ICl3.
جميع الهاليدات في الظروف العادية هي مواد سائلة ذات نقاط غليان منخفضة. Interhalides لها نشاط مؤكسد عالي
نشاط. على سبيل المثال، المواد المستقرة كيميائيًا مثل SiO2 وAl2 O3 وMgO وما إلى ذلك تحترق في أبخرة ClF3.
2Al2 O3 + 4ClF3 = 4 AlF3 + 3O2 + 2Cl2
يعتبر Fluoride ClF 3 كاشفًا قويًا للفلورة يعمل بسرعة
ساحة F2. يتم استخدامه في التركيبات العضوية وللحصول على أفلام واقية على سطح معدات النيكل للعمل مع الفلور.
في الماء، تتحلل الهاليدات الداخلية لتشكل الأحماض. على سبيل المثال،
ClF5 + 3H2 O = HClO3 + 5HF
الهالوجينات في الطبيعة. الحصول على مواد بسيطة
وفي الصناعة يتم الحصول على الهالوجينات من مركباتها الطبيعية. الجميع
تعتمد عمليات الحصول على الهالوجينات الحرة على أكسدة الهالوجين
أيونات نيد.
2Г – Г2 + 2e–
توجد كمية كبيرة من الهالوجينات في المياه الطبيعية على شكل أنيونات: Cl–، F–، Br–، I–. يمكن أن تحتوي مياه البحر على ما يصل إلى 2.5% من كلوريد الصوديوم.
يتم الحصول على البروم واليود من مياه آبار النفط ومياه البحر.
المنفذ: |
رقم الحدث |
||||||||||||||||
وتتكون مجموعة فرعية من الهالوجينات من عناصر الفلور والكلور والبروم واليود.
والتكوينات الإلكترونية لطبقة التكافؤ الخارجية للهالوجينات هي تلك الخاصة بالفلور والكلور والبروم واليود على التوالي). تحدد هذه التكوينات الإلكترونية خصائص الأكسدة النموذجية للهالوجينات - جميع الهالوجينات لديها القدرة على اكتساب الإلكترونات، على الرغم من أنه عند الانتقال إلى اليود، تضعف قدرة الهالوجينات المؤكسدة.
في الظروف العادية، توجد الهالوجينات على شكل مواد بسيطة تتكون من جزيئات ثنائية الذرة من النوع الذي له روابط تساهمية. تختلف الخصائص الفيزيائية للهالوجينات بشكل كبير: على سبيل المثال، في الظروف العادية، الفلور هو غاز يصعب تسييله، والكلور هو أيضًا غاز، ولكنه يسيل بسهولة، والبروم سائل، واليود مادة صلبة.
الخواص الكيميائية للهالوجينات.
على عكس جميع الهالوجينات الأخرى، يُظهر الفلور في جميع مركباته حالة أكسدة واحدة فقط، 1-، ولا يُظهر تكافؤًا متغيرًا. بالنسبة للهالوجينات الأخرى، فإن حالة الأكسدة الأكثر تميزًا هي أيضًا 1-، ومع ذلك، نظرًا لوجود مدارات حرة على المستوى الخارجي، فإنها يمكن أن تظهر أيضًا حالات أكسدة غريبة أخرى من إلى بسبب الاقتران الجزئي أو الكامل لإلكترونات التكافؤ.
الفلور لديه أعظم النشاط. معظم المعادن، حتى في درجة حرارة الغرفة، تشتعل في غلافها الجوي، وتطلق كمية كبيرة من الحرارة، على سبيل المثال:
بدون تسخين، يتفاعل الفلور أيضًا مع العديد من العناصر غير المعدنية (الهيدروجين - انظر أعلاه)، بينما يطلق أيضًا كمية كبيرة من الحرارة:
عند تسخين الفلور، يؤكسد جميع الهالوجينات الأخرى وفقا للمخطط التالي:
حيث وفي المركبات تكون حالات أكسدة الكلور والبروم واليود متساوية.
أخيرًا، عند تشعيع الفلور، فإنه يتفاعل حتى مع الغازات الخاملة:
تفاعل الفلور مع المواد المعقدة يحدث أيضًا بقوة شديدة. فيتأكسد الماء ويكون التفاعل متفجراً:
كما أن الكلور الحر شديد التفاعل أيضًا، على الرغم من أن نشاطه أقل من نشاط الفلور. يتفاعل مباشرة مع جميع المواد البسيطة ما عدا الأكسجين والنيتروجين والغازات النبيلة، على سبيل المثال:

بالنسبة لهذه التفاعلات، كما هو الحال بالنسبة لجميع التفاعلات الأخرى، فإن شروط حدوثها مهمة جدًا. وبالتالي، في درجة حرارة الغرفة، لا يتفاعل الكلور مع الهيدروجين؛ عند تسخينه، يحدث هذا التفاعل، ولكن تبين أنه قابل للانعكاس بدرجة كبيرة، ومع التشعيع القوي، يستمر بشكل لا رجعة فيه (مع انفجار) من خلال آلية السلسلة.
يتفاعل الكلور مع العديد من المواد المعقدة، على سبيل المثال، الاستبدال والإضافة مع الهيدروكربونات:

الكلور قادر على عند التسخين، يزيح البروم أو اليود من مركباتهما بالهيدروجين أو المعادن:

ويتفاعل أيضًا بشكل عكسي مع الماء:
يذوب الكلور في الماء ويتفاعل معه جزئيًا، كما هو موضح أعلاه، ويشكل خليطًا متوازنًا من المواد يسمى ماء الكلور.
لاحظ أيضًا أن الكلور الموجود على الجانب الأيسر من المعادلة الأخيرة له حالة أكسدة تساوي 0. ونتيجة للتفاعل، أصبحت حالة الأكسدة لبعض ذرات الكلور 1- (in)، ولبعضها الآخر (في حمض الهيبوكلوروس). هذا التفاعل هو مثال على تفاعل الأكسدة الذاتية والاختزال الذاتي، أو عدم التناسب.
دعونا نتذكر أن الكلور يمكن أن يتفاعل (غير متناسب) مع القلويات بنفس الطريقة (انظر قسم "القواعد" في الفقرة 8).
النشاط الكيميائي للبروم أقل من الفلور والكلور، لكنه لا يزال مرتفعًا جدًا نظرًا لأن البروم يستخدم عادةً في حالة سائلة وبالتالي فإن تركيزاته الأولية، مع تساوي العوامل الأخرى، أكبر من تركيزات الكلور. كونه كاشف "لين"، يستخدم البروم على نطاق واسع في الكيمياء العضوية.
لاحظ أن البروم، مثل الكلور، يذوب في الماء، ويتفاعل معه جزئيًا، ويشكل ما يسمى بـ "ماء البروم"، في حين أن اليود غير قابل للذوبان عمليًا في الماء وغير قادر على أكسدته حتى عند تسخينه؛ ولهذا السبب لا يوجد "ماء اليود".
إنتاج الهالوجينات.
الطريقة التكنولوجية الأكثر شيوعًا لإنتاج الفلور والكلور هي التحليل الكهربائي للأملاح المنصهرة (انظر الفقرة 7). عادة ما يتم الحصول على البروم واليود في الصناعة كيميائيا.
في المختبر، يتم إنتاج الكلور من خلال عمل عوامل مؤكسدة مختلفة على حمض الهيدروكلوريك، على سبيل المثال:
تتم عملية الأكسدة بكفاءة أكبر باستخدام برمنجنات البوتاسيوم - راجع قسم "الأحماض" في الفقرة 8.
هاليدات الهيدروجين والأحماض الهيدروهاليك.
جميع هاليدات الهيدروجين تكون غازية في الظروف العادية. الرابطة الكيميائية المنفذة في جزيئاتها تكون تساهمية قطبية، وتتناقص قطبية الرابطة في السلسلة. تنخفض قوة الرابطة أيضًا في هذه السلسلة. بسبب قطبيتها، جميع هاليدات الهيدروجين، على عكس الهالوجينات، قابلة للذوبان بدرجة عالية في الماء. لذلك، في درجة حرارة الغرفة، في حجم واحد من الماء، يمكنك إذابة حوالي 400 مجلد من الأحجام وحوالي 400 مجلد من
عندما تذوب هاليدات الهيدروجين في الماء، فإنها تتفكك إلى أيونات، وتتكون محاليل أحماض الهيدروهاليد المقابلة. علاوة على ذلك، عند الذوبان، ينفصل حمض الهيدروكلوريك بشكل كامل تقريبًا، لذلك تعتبر الأحماض الناتجة قوية. وفي المقابل، حمض الهيدروفلوريك ضعيف. ويفسر ذلك ارتباط جزيئات HF بوجود روابط هيدروجينية بينها. وبالتالي، تقل قوة الأحماض من HI إلى HF.
نظرًا لأن الأيونات السالبة لأحماض الهيدروهاليك لا يمكن أن تظهر إلا خصائص اختزالية، فعندما تتفاعل هذه الأحماض مع المعادن، يمكن أن تحدث أكسدة الأخيرة فقط بسبب الأيونات، لذلك تتفاعل الأحماض فقط مع المعادن الموجودة في سلسلة الجهد على يسار الهيدروجين.
جميع الهاليدات المعدنية، باستثناء أملاح Ag وPb، قابلة للذوبان بدرجة عالية في الماء. تسمح ذوبان هاليدات الفضة المنخفضة باستخدام تفاعل التبادل مثل
كنوعية للكشف عن الأيونات المقابلة. نتيجة للتفاعل، يترسب AgCl راسبًا أبيض، AgBr - أبيض مصفر، Agl - أصفر ساطع.
على عكس أحماض الهيدروهاليك الأخرى، يتفاعل حمض الهيدروفلوريك مع أكسيد السيليكون (IV):
وبما أن أكسيد السيليكون جزء من الزجاج، فإن حمض الهيدروفلوريك يؤدي إلى تآكل الزجاج، وبالتالي يتم تخزينه في المختبرات في حاويات مصنوعة من البولي إيثيلين أو التيفلون.
يمكن لجميع الهالوجينات، باستثناء الفلور، أن تشكل مركبات لها حالة أكسدة موجبة. وأهم هذه المركبات هي الأحماض المحتوية على الأكسجين من النوع الهالوجيني وما يقابلها من أملاح وأنهيدريدات.
تحتوي ذرة الهيدروجين على الصيغة الإلكترونية لمستوى الإلكترون الخارجي (والوحيد) 1 س 1 . فمن ناحية وجود إلكترون واحد على المستوى الإلكتروني الخارجي فإن ذرة الهيدروجين تشبه ذرات الفلزات القلوية. ومع ذلك، تمامًا مثل الهالوجينات، فإنه يحتاج فقط إلى إلكترون واحد لملء المستوى الإلكتروني الخارجي، حيث أن المستوى الإلكتروني الأول لا يمكن أن يحتوي على أكثر من إلكترونين. اتضح أنه يمكن وضع الهيدروجين في وقت واحد في كل من المجموعة الأولى وما قبل الأخيرة (السابعة) من الجدول الدوري، وهو ما يتم أحيانًا في إصدارات مختلفة من النظام الدوري:
ومن وجهة نظر خصائص الهيدروجين باعتباره مادة بسيطة، فإنه لا يزال لديه الكثير من القواسم المشتركة مع الهالوجينات. الهيدروجين، مثل الهالوجينات، هو مادة غير معدنية ويشكل جزيئات ثنائية الذرة (H 2) مثلها.
في الظروف العادية، يكون الهيدروجين مادة غازية منخفضة النشاط. يرجع النشاط المنخفض للهيدروجين إلى القوة العالية للروابط بين ذرات الهيدروجين في الجزيء، والتي يتطلب كسرها إما تسخينًا قويًا، أو استخدام المحفزات، أو كليهما.
تفاعل الهيدروجين مع مواد بسيطة
مع المعادن
ومن بين المعادن يتفاعل الهيدروجين فقط مع الفلزات القلوية والقلوية الأرضية! تشمل الفلزات القلوية معادن المجموعة الفرعية الرئيسية للمجموعة الأولى (Li، Na، K، Rb، Cs، Fr)، وتشمل المعادن الأرضية القلوية معادن المجموعة الفرعية الرئيسية للمجموعة الثانية، باستثناء البريليوم والمغنيسيوم (Ca، Sr، Ba، رع)
عند التفاعل مع المعادن النشطة، يظهر الهيدروجين خصائص مؤكسدة، أي. يخفض حالة الأكسدة الخاصة به. في هذه الحالة، يتم تشكيل هيدريدات الفلزات القلوية والقلوية الأرضية، والتي لها بنية أيونية. يحدث التفاعل عند تسخينه:
تجدر الإشارة إلى أن التفاعل مع المعادن النشطة هو الحالة الوحيدة عندما يكون الهيدروجين الجزيئي H2 عاملًا مؤكسدًا.
مع غير المعادن
من بين اللافلزات، يتفاعل الهيدروجين فقط مع الكربون والنيتروجين والأكسجين والكبريت والسيلينيوم والهالوجينات!
يجب أن يُفهم الكربون على أنه جرافيت أو كربون غير متبلور، حيث أن الماس عبارة عن تعديل متآصل خامل للغاية للكربون.
عند التفاعل مع المواد غير المعدنية، يمكن للهيدروجين أن يؤدي فقط وظيفة عامل اختزال، أي أنه يزيد فقط من حالة الأكسدة:
تفاعل الهيدروجين مع المواد المعقدة
مع أكاسيد المعادن
لا يتفاعل الهيدروجين مع أكاسيد المعادن الموجودة في سلسلة نشاط المعادن حتى الألومنيوم (ضمناً)، إلا أنه قادر على اختزال العديد من أكاسيد المعادن إلى يمين الألومنيوم عند تسخينه:
مع أكاسيد غير معدنية
ومن بين الأكاسيد اللافلزية، يتفاعل الهيدروجين عند تسخينه مع أكاسيد النيتروجين والهالوجينات والكربون. من بين جميع تفاعلات الهيدروجين مع الأكاسيد غير المعدنية، تجدر الإشارة بشكل خاص إلى تفاعله مع أول أكسيد الكربون CO.
إن خليط ثاني أكسيد الكربون وH2 له اسم خاص به - "الغاز الاصطناعي"، لأنه، وفقًا للظروف، يمكن الحصول عليه من المنتجات الصناعية الشهيرة مثل الميثانول والفورمالدهيد وحتى الهيدروكربونات الاصطناعية:
مع الأحماض
الهيدروجين لا يتفاعل مع الأحماض غير العضوية!
من بين الأحماض العضوية، يتفاعل الهيدروجين فقط مع الأحماض غير المشبعة، وكذلك مع الأحماض التي تحتوي على مجموعات وظيفية قادرة على الاختزال بالهيدروجين، ولا سيما مجموعات الألدهيد أو الكيتو أو النيترو.
مع الأملاح
وفي حالة المحاليل المائية للأملاح لا يحدث تفاعلها مع الهيدروجين. ومع ذلك، عند تمرير الهيدروجين على الأملاح الصلبة لبعض المعادن ذات النشاط المتوسط والمنخفض، فمن الممكن اختزالها جزئيًا أو كليًا، على سبيل المثال:
الخواص الكيميائية للهالوجينات
الهالوجينات هي العناصر الكيميائية للمجموعة VIIA (F، Cl، Br، I، At)، بالإضافة إلى المواد البسيطة التي تتكون منها. هنا وفي النص، ما لم ينص على خلاف ذلك، سيتم فهم الهالوجينات على أنها مواد بسيطة.
جميع الهالوجينات لها بنية جزيئية، والتي تحدد درجات الانصهار والغليان المنخفضة لهذه المواد. جزيئات الهالوجين ثنائية الذرة، أي. يمكن كتابة صيغتها بشكل عام كـ Hal 2.
تجدر الإشارة إلى خاصية فيزيائية محددة لليود مثل قدرته على ذلك تساميأو بكلمات أخرى، تسامي. تسامي، هي ظاهرة لا تذوب فيها المادة في الحالة الصلبة عند تسخينها، ولكنها تتجاوز الطور السائل، وتنتقل على الفور إلى الحالة الغازية.
الهيكل الإلكتروني لمستوى الطاقة الخارجي لذرة أي هالوجين له الشكل ns 2 np 5، حيث n هو رقم فترة الجدول الدوري التي يوجد فيها الهالوجين. كما ترون، تحتاج ذرات الهالوجين إلى إلكترون واحد فقط للوصول إلى الغلاف الخارجي المكون من ثمانية إلكترونات. من هذا فمن المنطقي أن نفترض الخصائص المؤكسدة في الغالب للهالوجينات الحرة، وهو ما تم تأكيده في الممارسة العملية. وكما هو معروف فإن السالبية الكهربية لللافلزات تتناقص عند التحرك إلى أسفل مجموعة فرعية، وبالتالي يتناقص نشاط الهالوجينات في السلسلة:
F 2 > Cl 2 > Br 2 > I 2
تفاعل الهالوجينات مع المواد البسيطة
جميع الهالوجينات هي مواد شديدة التفاعل وتتفاعل مع معظم المواد البسيطة. ومع ذلك، تجدر الإشارة إلى أن الفلور، بسبب تفاعله العالي للغاية، يمكن أن يتفاعل حتى مع تلك المواد البسيطة التي لا تستطيع الهالوجينات الأخرى التفاعل معها. وتشمل هذه المواد البسيطة الأكسجين والكربون (الماس) والنيتروجين والبلاتين والذهب وبعض الغازات النبيلة (الزينون والكريبتون). أولئك. في الحقيقة، ولا يتفاعل الفلور إلا مع بعض الغازات النبيلة.
الهالوجينات المتبقية، أي. الكلور والبروم واليود هي أيضًا مواد فعالة، ولكنها أقل نشاطًا من الفلور. تتفاعل مع جميع المواد البسيطة تقريبًا باستثناء الأكسجين والنيتروجين والكربون على شكل الماس والبلاتين والذهب والغازات النبيلة.
تفاعل الهالوجينات مع اللافلزات
هيدروجين
عندما تتفاعل جميع الهالوجينات مع الهيدروجين، فإنها تتشكل هاليدات الهيدروجينبالصيغة العامة HHal. وفي هذه الحالة يبدأ تفاعل الفلور مع الهيدروجين تلقائياً حتى في الظلام ويستمر بانفجار وفقاً للمعادلة:
يمكن أن يبدأ تفاعل الكلور مع الهيدروجين عن طريق الأشعة فوق البنفسجية المكثفة أو الحرارة. ويتابع أيضًا الانفجار:
يتفاعل البروم واليود مع الهيدروجين فقط عند تسخينه، وفي نفس الوقت يكون التفاعل مع اليود قابلاً للعكس:
الفوسفور
تفاعل الفلور مع الفوسفور يؤدي إلى أكسدة الفوسفور إلى أعلى حالة أكسدة (+5). في هذه الحالة يتكون خماسي فلوريد الفوسفور:
عندما يتفاعل الكلور والبروم مع الفسفور، من الممكن الحصول على هاليدات الفوسفور في حالة الأكسدة +3 وفي حالة الأكسدة +5، والتي تعتمد على نسب المواد المتفاعلة:
علاوة على ذلك، في حالة وجود الفوسفور الأبيض في جو من الفلور أو الكلور أو البروم السائل، فإن التفاعل يبدأ تلقائياً.
يمكن أن يؤدي تفاعل الفوسفور مع اليود إلى تكوين ثلاثي يوديد الفوسفور فقط نظرًا لقدرته المؤكسدة الأقل بكثير من قدرة الهالوجينات الأخرى:
رمادي
يؤكسد الفلور الكبريت إلى أعلى حالة أكسدة +6، مكونًا سداسي فلوريد الكبريت:
يتفاعل الكلور والبروم مع الكبريت، مكونين مركبات تحتوي على الكبريت في حالات الأكسدة +1 و+2، وهو أمر غير معتاد بالنسبة له. هذه التفاعلات محددة للغاية، ولاجتياز امتحان الدولة الموحدة في الكيمياء، ليس من الضروري القدرة على كتابة معادلات لهذه التفاعلات. ولذلك، يتم إعطاء المعادلات الثلاث التالية بدلا من ذلك كمرجع:
تفاعل الهالوجينات مع المعادن
كما ذكرنا أعلاه، الفلور قادر على التفاعل مع جميع المعادن، حتى تلك غير النشطة مثل البلاتين والذهب:
تتفاعل الهالوجينات المتبقية مع جميع المعادن باستثناء البلاتين والذهب:
تفاعلات الهالوجينات مع المواد المعقدة
تفاعلات الاستبدال مع الهالوجينات
المزيد من الهالوجينات النشطة، أي. العناصر الكيميائية التي تقع في أعلى الجدول الدوري قادرة على إزاحة الهالوجينات الأقل نشاطًا من الأحماض الهيدروهاليكية والهاليدات المعدنية التي تشكلها:
وبالمثل، يحل البروم واليود محل الكبريت من محاليل الكبريتيدات و/أو كبريتيد الهيدروجين:
الكلور هو عامل مؤكسد أقوى ويؤكسد كبريتيد الهيدروجين في محلوله المائي ليس إلى الكبريت، ولكن إلى حمض الكبريتيك:
تفاعل الهالوجينات مع الماء
يحترق الماء في الفلور بلهب أزرق وفقا لمعادلة التفاعل:
يتفاعل البروم والكلور مع الماء بشكل مختلف عن الفلور. إذا كان الفلور يعمل كعامل مؤكسد، فإن الكلور والبروم يكونان غير متناسبين في الماء، ويشكلان خليطًا من الأحماض. في هذه الحالة، ردود الفعل قابلة للعكس:
إن تفاعل اليود مع الماء يحدث بدرجة ضئيلة بحيث يمكن إهماله ويمكن افتراض عدم حدوث التفاعل على الإطلاق.
تفاعل الهالوجينات مع المحاليل القلوية
عند تفاعل الفلور مع محلول قلوي مائي، يعمل مرة أخرى كعامل مؤكسد:
القدرة على كتابة هذه المعادلة ليست مطلوبة لاجتياز امتحان الدولة الموحدة. ويكفي معرفة حقيقة إمكانية حدوث مثل هذا التفاعل والدور التأكسدي للفلور في هذا التفاعل.
على عكس الفلور، فإن الهالوجينات الأخرى في المحاليل القلوية غير متناسبة، أي أنها تزيد وتقلل في نفس الوقت من حالة الأكسدة الخاصة بها. علاوة على ذلك، في حالة الكلور والبروم، اعتمادًا على درجة الحرارة، من الممكن التدفق في اتجاهين مختلفين. على وجه الخصوص، في البرد تتم التفاعلات على النحو التالي:
وعند تسخينه:
يتفاعل اليود مع القلويات حصرا وفق الخيار الثاني أي. مع تكوين اليودات، لأن هيبويوديت غير مستقر ليس فقط عند تسخينه، ولكن أيضًا في درجات الحرارة العادية وحتى في البرد.
الهالوجينات الفلور F، الكلور C1، البروم Br، اليود I هي عناصر من مجموعة VILA. التكوين الإلكتروني لقذيفة التكافؤ لذرات الهالوجين في الحالة الأرضية نس 2 نب 5 .إن وجود خمسة إلكترونات في المدار p الخارجي، بما في ذلك إلكترون واحد غير مزدوج، هو سبب الألفة الإلكترونية العالية للهالوجينات. تؤدي إضافة إلكترون إلى تكوين أنيونات الهاليد (F-، Cl-، Br-، I-) مع غلاف مستقر مكون من 8 إلكترونات من أقرب غاز نبيل. الهالوجينات هي غير معدنية متميزة.
العنصر الأكثر سالبية كهربية، الفلور، لديه حالة أكسدة واحدة فقط في المركبات - 1، لأنه دائمًا متقبل للإلكترون. الهالوجينات الأخرى في المركبات يمكن أن يكون لها حالات أكسدة تتراوح من -1 إلى +7. تنجم حالات الأكسدة الإيجابية للهالوجينات عن انتقال إلكترونات التكافؤ الخاصة بها إلى مدارات d الحرة من المستوى الخارجي (القسم 2.1.3) عند تكوين روابط مع عناصر أكثر سالبية كهربية.
جزيئات الهالوجين ثنائية الذرة: F 2، C1 2، Br 2، I 2. في ظل الظروف القياسية، يكون الفلور والكلور غازات، والبروم سائل متطاير (Tbp = 59 درجة مئوية)، واليود مادة صلبة، ولكنها تتسامى بسهولة (تتحول إلى حالة غازية، متجاوزة الحالة السائلة).
خصائص الأكسدة والاختزال.الهالوجينات هي عوامل مؤكسدة قوية، تتفاعل مع جميع المعادن تقريبًا والعديد من العناصر غير المعدنية:
يُظهر الفلور نشاطًا كيميائيًا عاليًا بشكل خاص، والذي يتفاعل عند تسخينه حتى مع الغازات النبيلة زينون والكريبتون والرادون:
![]()
يتناقص النشاط الكيميائي للهالوجينات من الفلور إلى اليود، لأنه مع زيادة نصف القطر الذري تقل قدرة الهالوجينات على ربط الإلكترونات:

دائمًا ما يحل الهالوجين الأكثر نشاطًا محل الهالوجين الأقل نشاطًا من مركباته بالمعادن. وبالتالي، فإن الفلور يزيح جميع الهالوجينات الأخرى من هاليداتها، كما يزيح البروم اليود فقط من اليوديدات:
تتجلى الخصائص المؤكسدة المختلفة للهالوجينات أيضًا في تأثيرها على الجسم. يعتبر الكلور والفلور الغازيان، بسبب خصائصهما المؤكسدة القوية جدًا، من المواد السامة القوية التي تسبب أضرارًا جسيمة للرئتين والأغشية المخاطية للعينين والأنف والحنجرة. اليود هو عامل مؤكسد أخف وله خصائص مطهرة، لذلك يستخدم على نطاق واسع في الطب.
تظهر أيضًا الاختلافات في خصائص الأكسدة والاختزال للهالوجينات عندما تتفاعل مع الماء. يقوم الفلور بأكسدة الماء، ويكون عامل الاختزال هو ذرة الأكسجين في جزيء الماء:
يصاحب تفاعل الهالوجينات الأخرى مع الماء تفكك الأكسدة والاختزال في ذراتها. وهكذا، عندما يتفاعل الكلور مع الماء، فإن إحدى ذرات جزيء الكلور، التي اكتسبت إلكترونًا من ذرة أخرى، تقل، وتتأكسد ذرة الكلور الأخرى، التي تتخلى عن إلكترون. هذا يصنع ماء الكلور,تحتوي على كلوريد الهيدروجين (حمض الهيدروكلوريك) وحمض هيبوكلوروس (هيبوكلوروس):
يكون التفاعل عكسيًا، وينزاح توازنه بقوة نحو اليسار. حمض الهيبوكلوروز غير مستقر ويتحلل بسهولة، خاصة في الضوء، مع تكوين عامل مؤكسد قوي جدًا - الأكسجين الذري:
وهكذا، يحتوي ماء الكلور بتركيزات مختلفة على ثلاثة عوامل مؤكسدة بقدرات أكسدة مختلفة: الكلور الجزيئي، وحمض الهيبوكلوروس، والأكسجين الذري، والتي يُطلق عليها غالبًا اسم "الكلور النشط".
يؤدي الأكسجين الذري الناتج إلى تبييض الأصباغ وقتل الميكروبات، وهو ما يفسر تأثير التبييض والجراثيم لمياه الكلور.
حمض الهيبوكلوروس هو عامل مؤكسد أقوى من غاز الكلور. يتفاعل مع المركبات العضوية RH كعامل مؤكسد وككاشف مكلور:
لذلك، عندما تتم معالجة مياه الشرب التي تحتوي على مواد عضوية كشوائب بالكلور، فإنها يمكن أن تتحول إلى مركبات كلورية عضوية أكثر سمية RC1. يجب بالتأكيد أن يؤخذ ذلك في الاعتبار عند تطوير طرق تنقية المياه وتطبيقها.
عند إضافة القلويات إلى ماء الكلور، ينتقل التوازن إلى اليمين بسبب معادلة حمضي الهيبوكلوروس والهيدروكلوريك:
ويسمى المحلول الناتج من خليط من الأملاح ماء جافيل,يستخدم كمبيض ومطهر. ترجع هذه الخصائص إلى حقيقة أن هيبوكلوريت البوتاسيوم تحت تأثير ثاني أكسيد الكربون + H 2 0 ونتيجة للتحلل المائي يتحول إلى حمض هيبوكلوروس غير مستقر، ويشكل الأكسجين الذري. ونتيجة لذلك، فإن ماء جافيل يدمر الأصباغ ويقتل الميكروبات.
عندما يعمل الكلور الغازي على الجير المطفأ الرطب Ca(OH) 2، يتم الحصول على خليط من أملاح CaCl 2 و Ca(0C1) 2 يسمى مبيض:
يمكن اعتبار كلوريد الجير عبارة عن ملح كالسيوم مختلط من أحماض الهيدروكلوريك وهيبوكلوروس CaCl (OCl). في الهواء الرطب، يقوم المبيض، الذي يتفاعل مع الماء وثاني أكسيد الكربون، بإطلاق حمض الهيبوكلوروس تدريجيًا، والذي يوفر خصائص التبييض والمطهر وإزالة الغازات:
عند تعرض المبيض لحمض الهيدروكلوريك، يتحرر الكلور الحر:
عند تسخينه، يتحلل حمض الهيبوكلوروس نتيجة عدم تناسب الأكسدة والاختزال لتكوين أحماض الهيدروكلوريك والبيركلوريك:
![]()
عندما يتم تمرير الكلور من خلال محلول قلوي ساخن، مثل KOH، يتكون كلوريد البوتاسيوم وكلورات البوتاسيوم KClO 3 (ملح بيرثوليت):
تتناقص قدرة أكسدة أنيونات أحماض الكلور المحتوية على الأكسجين في المحاليل المائية في السلسلة СlO - - СlO4(-) على الرغم من زيادة درجة أكسدة الكلور فيها:
![]()
ويفسر ذلك زيادة في استقرار الأنيونات في هذه السلسلة بسبب زيادة عدم تمركز شحنتها السالبة. وفي الوقت نفسه، تعد بيركلورات LiC10 4 وKClO 4 في الحالة الجافة عند درجات حرارة عالية عوامل مؤكسدة قوية وتستخدم لتمعدن المواد الحيوية المختلفة عند تحديد المكونات غير العضوية التي تحتوي عليها.
أنيونات الهالوجين (ما عدا F-) قادرة على منح الإلكترونات، لذا فهي عوامل اختزال. مع زيادة نصف قطرها، تزداد قدرة أنيونات الهاليد على الاختزال من أنيون الكلوريد إلى أنيون اليوديد:

وبالتالي، يتأكسد حمض الهيدروديك بواسطة الأكسجين الجوي الموجود بالفعل في درجة الحرارة العادية:
![]()
لا يتأكسد حمض الهيدروكلوريك بالأكسجين، وبالتالي فإن أنيون الكلوريد مستقر في ظروف الجسم، وهو أمر مهم جدًا من وجهة نظر علم وظائف الأعضاء والطب.
خصائص الحمض القاعدي.هاليدات الهيدروجين HF، HC1، HBr، HI، بسبب قطبية جزيئاتها، قابلة للذوبان بدرجة عالية في الماء. في هذه الحالة، يحدث ترطيب الجزيئات، مما يؤدي إلى تفككها وتكوين البروتونات المائية وأنيونات الهاليد. تزداد قوة الأحماض في السلسلة HF، HC1، HBr، HI بسبب زيادة نصف قطر واستقطاب الأنيونات من F- إلى I-.
يلعب حمض الهيدروكلوريك، باعتباره أحد مكونات عصير المعدة، دورا هاما في عملية الهضم. ويرجع ذلك أساسًا إلى حمض الهيدروكلوريك، الذي تبلغ نسبة كتلته في عصير المعدة 0.3٪، ويتم الحفاظ على الرقم الهيدروجيني في النطاق من 1 إلى 3. ويعزز حمض الهيدروكلوريك انتقال إنزيم البيبسين إلى شكله النشط، مما يضمن هضم البروتينات. بسبب الانقسام المائي للروابط الببتيدية مع تكوين الأحماض الأمينية المختلفة:
تمت مناقشة تحديد محتوى حمض الهيدروكلوريك والأحماض الأخرى في عصير المعدة في القسم. 8.3.3.
في سلسلة أحماض الكلور المحتوية على الأكسجين، مع زيادة حالة الأكسدة، تزداد قوة الأحماض.

ويرجع ذلك إلى زيادة قطبية الرابطة OH بسبب تحول كثافة إلكتروناتها نحو ذرة الكلور، وكذلك بسبب زيادة ثبات الأنيونات.
خصائص معقدة.تميل أنيونات الهالوجين إلى تكوين معقدات مثل الروابط. عادة ما يتناقص استقرار مجمعات الهاليد بالترتيب F- > Cl- > Br- > > I-. إنها عملية التكوين المعقد التي تفسر التأثير السام لأنيونات الفلورايد، والتي، من خلال تكوين مجمعات الفلورايد مع الكاتيونات المعدنية المدرجة في المراكز النشطة للإنزيمات، تثبط نشاطها.
يُظهر جزيء اليود خصائص تشكيل معقدة مثيرة للاهتمام. وبالتالي فإن ذوبان اليود الجزيئي في الماء يزداد بشكل حاد في وجود يوديد البوتاسيوم، والذي يرتبط بتكوين أنيون معقد
يضمن الثبات المنخفض لهذا الأيون المعقد وجود اليود الجزيئي في المحلول. لذلك، في الطب، يتم استخدام محلول مائي من اليود مع إضافة KI كعامل مبيد للجراثيم. بالإضافة إلى ذلك، يشكل اليود الجزيئي معقدات متضمنة مع النشا (القسم 22.3) وكحول البولي فينيل. (اليود الأزرق).في هذه المجمعات، تملأ جزيئات اليود أو ما يرتبط بها من أنيونات اليوديد القنوات التي تشكلها البنية الحلزونية لبوليمرات بولي هيدروكسي المقابلة. مجمعات الاشتمال ليست مستقرة جدًا وتكون قادرة على إطلاق اليود الجزيئي تدريجيًا. ولذلك، فإن دواء مثل اليود الأزرق هو عامل مبيد للجراثيم فعال ولكنه خفيف وطويل المفعول.
الدور البيولوجي واستخدام الهالوجينات ومركباتها في الطب.الهالوجينات على شكل مركبات مختلفة هي جزء من الأنسجة الحية. في الجسم، جميع الهالوجينات لها حالة أكسدة تبلغ 1. وفي الوقت نفسه، يوجد الكلور والبروم على شكل Cl- وBr- أيونات، والفلور واليود جزء من الركائز الحيوية غير القابلة للذوبان في الماء:
مركبات الفلور هي مكونات أنسجة العظام والأظافر والأسنان. يرتبط التأثير البيولوجي للفلورايد في المقام الأول بمشكلة أمراض الأسنان. أنيون الفلورايد، الذي يحل محل أيون الهيدروكسيد في الهيدروكسيباتيت، يشكل طبقة من المينا الواقية من الفلوراباتيت الصلب:
إن فلورة مياه الشرب إلى تركيز أيون الفلورايد بمقدار 1 ملغم / لتر وإضافة فلوريد الصوديوم إلى معجون الأسنان تقلل بشكل كبير من تسوس الأسنان لدى السكان. وفي الوقت نفسه، عندما يزيد تركيز أنيون الفلورايد في مياه الشرب عن 1.2 ملغم/لتر، تزداد هشاشة العظام ومينا الأسنان ويظهر الإرهاق العام للجسم، وهو ما يسمى التسمم بالفلور.
توفر أنيونات الكلوريد التدفقات الأيونية عبر أغشية الخلايا، وتشارك في الحفاظ على التوازن الأسموزي، وتخلق بيئة مواتية لعمل وتنشيط الإنزيمات المحللة للبروتين في عصير المعدة.
تتمركز أنيونات البروميد في جسم الإنسان بشكل رئيسي في الغدة النخامية والغدد الصماء الأخرى. تم إثبات وجود علاقة ديناميكية بين محتوى أنيونات البروميد والكلوريد في الجسم. وبالتالي، فإن زيادة محتوى أنيونات البروميد في الدم تساهم في الإطلاق السريع لأنيونات الكلوريد عن طريق الكلى. يتم توطين البروميدات بشكل رئيسي في السائل بين الخلايا. أنها تعزز العمليات المثبطة في الخلايا العصبية لقشرة الدماغ، وبالتالي يتم استخدام بروميدات البوتاسيوم والصوديوم والبروموكافور في علم الصيدلة.
يؤثر اليود ومركباته على تخليق البروتينات والدهون والهرمونات. أكثر من نصف كمية اليود موجودة في الغدة الدرقية في حالة مقيدة على شكل هرمونات الغدة الدرقية. مع عدم كفاية كمية اليود في الجسم، يتطور تضخم الغدة الدرقية المتوطن. من أجل الوقاية من هذا المرض، يتم إضافة NaI أو KI إلى ملح الطعام (1-2 جم لكل 1 كجم من كلوريد الصوديوم). وبالتالي، فإن جميع الهالوجينات ضرورية للعمل الطبيعي للكائنات الحية.
الفصل 13
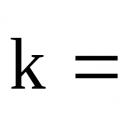 معدل التفاعل ثابت المبادئ التوجيهية للعمل المختبري
معدل التفاعل ثابت المبادئ التوجيهية للعمل المختبري هل هناك حياة بعد الموت؟
هل هناك حياة بعد الموت؟ علماء: الأرض “سجن فضائي” للإنسانية علماء: الأرض سجن فضائي في الكون
علماء: الأرض “سجن فضائي” للإنسانية علماء: الأرض سجن فضائي في الكون