بناء مخطط توازن الطور لخليط ثنائي. نسبة العناصر الكيميائية
بناء مخطط توازن الطور لخليط ثنائي
1. محتويات المهمة:
صياغة المشكلة:
عند الضغط P، قم ببناء مخطط توازن الطور لخليط مكون من مكونين باستخدام النماذج التالية: أ) الخليط المثالي؛ ب) ويلسون؛ ج) نرتل.
منح:
ف، المواد.
يبني:
أقوم بجدولة: ت = F (س أ); ت = F (ذ أ) – عدد النقاط ن = 101 للخليط حسب نماذج : أ) الخليط المثالي ; ب) ويلسون؛ ج) نرتل.
الجدول الثاني: ذ أ = F (س أ) - عدد النقاط ن = 101. المخاليط حسب النماذج: أ) الخليط المثالي؛ ب) ويلسون؛ ج) نرتل.
خيارات المهمة:
|
عناصر |
عناصر |
||||||
أسطورة:
أ- مكون شديد التقلب؛
ب- مكون منخفض التطاير؛
× ط- محتوى المكون i في الطور السائل (mol.%)؛
ذ ط- محتوى المكون i في طور البخار (mol.%)؛
أنا- فهرس المكونات؛
ك ط- ثابت توازن الطور للمكون i؛
ص- الضغط في النظام، آتا؛
باي- ضغط البخار على مذيب نقي، ATA؛
ت- درجة حرارة النظام، درجة مئوية
تي بالأنا- نقطة غليان المكون i، درجة مئوية
γ – معامل النشاط
Λ اي جاي, السادس, χ ي- معلمات نموذج ويلسون؛
جي جي, ز ي- معلمات نموذج NRLT؛
نموذج رياضي:
نسبة العناصر الكيميائية:
∑× ط = 1; ∑ذ ط = 1
توازن المرحلة:
ثابت توازن المرحلة:
ضغط البخار المشبع للمكون الأول:
![]()
معاملات النشاط:
أ) خليط مثالي
ب) وفقا لويلسون
ملحوظة:المرتفع هو مربع.
البيانات المرجعية:
معامل معادلة أنطوان
الخامس 1 = 104.00؛ الخامس 2 = 49.60؛ الخامس 3 = 18.70
أ 12 = 0.30؛ أ 13 = 0.20؛ a23 = 0.46
خوارزمية الحساب باستخدام نموذج الخليط المثالي:
1. اكتب المعاملات أأنا،ب أنا،ج طمعادلات أنطوان لزوج معين من المواد.
2. العثور على درجات غليان المواد وفق “خوارزمية البحث عن نقطة الغليان” تي بالعند ضغط نظام معين P" وتحديد من زوج من المواد المادة شديدة التقلب A والمادة شديدة التقلب B.
3. ابحث عن خطوة درجة الحرارة

4. نجد تي يفي ي = 1, … , ن.
ت 1 =ذتي ي +1 =تي ي +Δ ت
5. للجميع تي ينجد ص أو ص بوفقا لمعادلة أنطوان.
6. للجميع تي ينجد ك أو ك بفي γ = 1.
7. للجميع تي ينجد س أ

8. للجميع تي ينجد ذ أ.
9. نبني الرسوم البيانية.
خوارزمية الحساب باستخدام ويلسون ونرت:
البنود من 1 إلى 7 هي نفسها الموجودة في "خوارزمية الحساب باستخدام نموذج الخليط المثالي"
8. ل × 1 =س أو × 2 = 1 –س أأوجد اللوغاريتمات الطبيعية لمعاملات النشاط ln γ 1و ln γ 2وفقا لنموذج ويلسون أو NRLT.
9. إيجاد معاملات النشاط γ 1و γ 2وفقا لنموذج ويلسون أو NRLT.
10. للجميع تي ينجد ك أو ك بفي γ 1و γ 2، محسوبة في الفقرة 9.
11. للجميع تي يدعونا نوضح س أ

12. للجميع تي ينجد ذ أ.
13. نبني الرسوم البيانية.
خوارزمية البحث عن نقطة الغليانتي بال عند ضغط النظامف:
1. قم بضبط درجة الحرارة المخصصة ت.
2. ابحث عن بايمن مادة معينة عند درجة حرارة معينة توفقا لمعادلة أنطوان.
3. إذا | باي – ف|< 0.001 إذن تي بال = ت. إذا | باي – ف| ≥ 0.001، ثم انتقل إلى الخطوة 1، مع تحديد T حتى يتم استيفاء شرط الخطوة 3.
2. محتويات التقرير:
صياغة المشكلة
الهدف من العمل
تقدم العمل، مع وصف للحسابات، والتي يتم عرض نتائجها في شكل رسوم بيانية؛
3. أسئلة للتحكم:
1) المراحل الرئيسية لبناء الوصف الرياضي لعمليات النقل الجماعي. على ماذا يعتمد الوصف الرياضي لعملية النقل الجماعي؟
2) المعنى الفيزيائي لمخطط توازن الطور. أنظمة غير متجانسة ومتجانسة. اعتماد مخططات توازن الطور على الضغط.
3) لزوجة المكون في الخليط، معامل نشاط المكون.
4) معادلة ويلسون (مفهوم التراكيب المحلية). معادلة NRTL (نوعان من الخلايا).
لقد قمت ذات مرة بإعداد الفطائر مع مجموعة من الرفاق، حيث كان هناك ممتنعون عن تناول الكحول يعانون من القرحة. أنا أكذب، لا يبدو أن هناك أي تقرحات، لكن الممتنعين عن تناول الكحول كانوا مميزين. رفض البعض بشكل قاطع تناول الكحول الإيثيلي بأي شكل من الأشكال، حتى في شكل الكفير. والحجج مثل حقيقة أن جسم الإنسان نفسه ينتج الكحول بكمية ما لم تمر. إنها تنتج، نعم، لكن هذه عملية غير واعية (اقرأ غير عقلانية)، ونحن، كتجسيد للعقلانية، لا نريد أن نضيف إليها ما لا نريد أن نضيفه.
نعم، لقد نسيت أن أقول، أردت طهي الفطائر ليس بأي شيء، ولكن بالبيرة الحقيقية - 5٪ من هيدروكسيد خماسي هيدرو ثنائي الكربون من الكحول الإيثيلي.
كان علي أن أفكر في الحجج العقلانية الأخرى.
كان من الضروري إثبات (اقرأ إثبات) بطريقة أو بأخرى عدم وجود الكحول في المنتج النهائي.
حسنًا، دعونا نتذكر شبابنا.
يتم حساب كتلة المادة المتبخرة من أي سطح باستخدام الصيغة (نتذكر هذا؛ وكل شيء منطقي):
م = ث * س * ر، حيث
ث - شدة التبخر،
S - مساحة السطح بالمتر المربع،
ر - الوقت في ق.
نعرف الكتلة (مع إهمال الكثافة): 0.5 كجم 5% - 25 جم = 0.025 كجم كحول. ولكن هذا في كتلة الفطائر بأكملها. مع الأخذ في الاعتبار أنه من حجم العجين الذي يدخل في زجاجة بيرة واحدة، خططت للحصول على حوالي 40 فطيرة، مما يعني أن فطيرة واحدة تحتوي على حوالي 0.000625 كجم من الكحول. القليل. لكن التقنيين الرقميين لا يحتاجون إلى حجج إلا في شكل أرقام، وفي بعض الأحيان يتنازلون عن الرسوم البيانية والرسوم البيانية. نعم. فلنكمل.
نحن نعرف أيضًا مساحة سطح التبخر - لنعتبرها مساحة الفطيرة (أي مقلاة 22 سم = 0.22 م) = π*0.22² ~ 0.1521 م²
أنت الآن بحاجة إلى معرفة معدل تبخر الكحول.
هنا كان علي أن أذهب إلى الإنترنت، الذي أفاد أنه يتم حساب معدل التبخر على أنه
ث = 10⁻⁶ * ن * √م * ف،
حيث n هو المعامل مع الأخذ في الاعتبار سرعة تدفق الهواء بيئة(مأخوذ من الجداول). في هذه الحالة، قررت تجاهلها، بمعنى اعتبارها 1 (أي التدفق = 0 م/ث).
م هو الوزن الجزيئي للمادة. أوه، هذا سهل بما فيه الكفاية. C₂H₅OH - 46.07 جم/مول (ساعدنا الإنترنت هنا).
لكن P هو ضغط البخار المشبع للمادة عند درجة حرارة معينة ويتم حسابه باستخدام معادلة أنطوان
logP = A-B/(C+T)، حيث T هي درجة الحرارة التصميمية، وA، B، C هي ثوابت معادلة أنطوان لاعتماد ضغط البخار المشبع على درجة الحرارة.
يبرش. يأخذ الأشخاص العاديون هذه القيم من الكتب المرجعية، ولكن لحسن الحظ، لم يكن لدي أي شيء مناسب في متناول اليد. والإنترنت، العدوى، كانت صامتة. يبدو أنني طرحت الأسئلة الخاطئة في الحديقة...
لكن... درجة حرارة خبز الفطائر أعلى بشكل واضح من درجة غليان الكحول (حتى لا نخلط أيهما يفعل ماذا)، وهذا لا يعني أي شيء آخر سوى أن ضغط المادة المتبخرة يساوي الضغط الخارجي ، أي. دع أنطوان يدخن بعصبية على الهامش، وسوف نأخذ بيانات الضغط الجوي القياسي - 100 كيلو باسكال.
لذلك، كل البيانات الأولية هناك. نحن نعد:
العرض = 10⁻⁶ * 1* √46.07 * 100 = 0.00068 كجم/م²
ر = 0.000625 / (0.00068 * 0.1521) = 6.04 ثانية
احصل عليه. سوف يتبخر كل الكحول من الفطيرة في أقل من 10 ثوانٍ.
كان على الممتنعين عن التدخين التحقق من الحسابات والتذمر من عدم صحة الطريقة المستخدمة (لم يؤخذ النشاط الكيميائي للمادة في الاعتبار ويُزعم أنه تم إجراء الحسابات على مادة نقية، وما إلى ذلك)، لكنهم ما زالوا يأكلون الفطائر . Q.E.D!
معادلة كلابيرون
عند دمج معادلة كلاوزيوس-كلابيرون، في أبسط الحالات، يُفترض أن المجموعة لها قيمة ثابتة لا تعتمد على درجة الحرارة.
وقد عين قيمة ثابتةالتكامل من خلال "أ" نحصل عليه
تسمى العلاقة (7.5) أحيانًا بمعادلة كلابيرون. بيانياً، يتم التعبير عن الاعتماد المعطى بخط مستقيم. في كثير من الأحيان تكون المعادلة (7.5) تقريبية جيدة، ولكنها في الحالة العامة تعطي أخطاء كبيرة بسبب حقيقة أن الاعتماد على س-مظهر على شكل. لا تنطبق المعادلة (7.5) على درجات الحرارة الأقل من نقطة الغليان الطبيعية، حتى بالنسبة للمواد غير القطبية التي لا تكون عرضة لتكوين مواد زميلة. بالنسبة للأخيرة، الشكل الخطي بي تييمكن استخدام التبعيات لتقريب بي تيالبيانات فقط في نطاق درجة حرارة ضيق، حتى في نطاق درجة الحرارة أعلى من نقطة الغليان العادية.
علاقة أنطوان لضغط البخار
اقترح أنطوان تعديلاً بسيطًا واسع الاستخدام للمعادلة (7.5):
وعند C=0 تتحول المعادلة (7.6) إلى معادلة كلابيرون (7.5). تم الحصول على الثوابت "أ" و"ب" و"ج" في معادلة أنطوان عن طريق التقريب التجريبي بي تيبيانات. بالنسبة للعديد من المواد، يتم إعطاء قيم هذه الثوابت في الأدبيات المرجعية. يقتصر تطبيق ثوابت معادلة أنطوان على نطاقات درجات الحرارة أو الضغط التي أوصى بها مؤلفو هذه الكتب المرجعية. لا يمكن استخدام معادلة أنطوان خارج الفترات الموصى بها.
علاقة كوكس أنطوان لضغط البخار
اقترح كوكس وجود علاقة رسومية لضغط البخار. على الرسم البياني، يتم رسم اللوغاريتم على طول المحور الإحداثي ويتم رسم خط مستقيم (مع ميل إيجابي)، تتوافق إحداثياته مع قيم ضغط بخار الماء (أو بعض المواد المرجعية الأخرى). نظرًا لأن اعتماد ضغط بخار الماء على درجة الحرارة معروف جيدًا، يتم تحديد الإحداثي وفقًا لذلك بوحدات درجة الحرارة. وفي مجال الإحداثيات المعد بهذه الطريقة، سيتم أيضًا تصوير ضغوط بخار المواد الأخرى بخطوط مستقيمة. ومع ذلك، فإن مثل هذه الرسوم البيانية غير ملائمة إلى حد ما للاستخدام العملي نظرًا لحقيقة أن الاستيفاء حسب درجة الحرارة تبين أنه غير دقيق للغاية.
أظهر كالينجيرت وديفيس أن مقياس درجة الحرارة الذي تم الحصول عليه بهذه الطريقة يعادل تقريبًا دالة؛ هنا "C" يساوي تقريبًا 43 كلفن لمعظم المواد التي تغلي عند درجات حرارة من 0 إلى 100 درجة مئوية. وقد قام نفس المؤلفين ببناء اعتمادات ضغط البخار لعدد من المواد باستخدام الطريقة المشار إليها وحصلوا على خطوط مستقيمة تقريبًا. المعادلة الخاصة بهم
تشبه إلى حد كبير معادلة أنطوان، وغالبًا ما يطلق عليها ذلك بالضبط، وهي كذلك صورة بيانيةيعتبر مخطط كوكس.
يمكنك العثور في الأدبيات على دلائل تشير إلى وجود قواعد بسيطة للغاية تربط بين الثابت "C" ونقطة الغليان الطبيعية للمادة. على الرغم من أن هذه القواعد ليست موثوقة للغاية، إلا أن بعضها مذكور أدناه كمقدمة للنهج.
قواعد طومسون:
· بالنسبة لأحادية الذرة وجميع المواد ذات درجة الغليان الطبيعية K
· للاتصالات الأخرى
· بالنسبة للمواد التي تزيد درجة غليانها الطبيعية عن 250 كلفن، يوصى بتناول C = 43 K؛
· للغازات منخفضة الغليان C0.
يتم الحصول على شكل آخر أكثر شيوعًا من ارتباط كوكس-أنطوان عن طريق تفاضل المعادلة (7.7) بالنسبة إلى 1/T ودمج العلاقة الناتجة مع معادلة كلاوسيوس-كلابيرون (7.3). بالنسبة لدرجة الغليان العادية، يتم التعبير عن الثوابتين "أ" و"ب" في هذه الحالة على النحو التالي:
أين ص نائب الرئيسيتم التعبير عنها في الأجواء المادية.
لاستخدام المعادلات (7.8)، ما عليك سوى أن تعرف في ت بو ت ب. . وفقًا لتوصية ميلر، يمكن أخذ ~ 1.05 لمعظم المواد الموجودة في منطقة الضغط المنخفض.
 قصيدة ميخائيل ليرمونتوف "الوطن الأم" (أنا أحب وطني ولكن بحب غريب!
قصيدة ميخائيل ليرمونتوف "الوطن الأم" (أنا أحب وطني ولكن بحب غريب!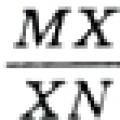 أسئلة المراجعة للفصل السادس
أسئلة المراجعة للفصل السادس المواضيع: الموارد الطبيعية في الشرق الأقصى حماية الموارد المائية في البلاد ومنطقتنا
المواضيع: الموارد الطبيعية في الشرق الأقصى حماية الموارد المائية في البلاد ومنطقتنا